
- •Виды ингибирования
- •1. Обратимое 2. Необратимое
- •Сходство строения сульфаниламидов и парааминобензойной кислоты, компонента витамина в9
- •1. Специфические и неспецифические ингибиторы
- •1. Пространственная локализация ферментов
- •2. Структура метаболических путей
- •1. Регуляция количества молекул фермента в клетке
- •2. Регуляция скорости ферментативной реакции доступностью молекул субстрата и коферментов
- •3. Регуляция каталитической активности ферментов
- •Основные способы регуляции активности ферментов:
- •Аллостерическая регуляция
- •Регуляция каталитической активности ферментов белок-белковыми взаимодействиями.
- •Регуляция каталитической активности ферментов путём фосфорилирования/дефосфорилирования
- •Регуляция каталитической активности ферментов частичным (ограниченным) протеолизом
- •Энзимодиагностика
- •Энзимотерапия -
Ферменты 2
Регуляция действия ферментов
Медицинские аспекты энзимологии
Ингибирование
– это торможение активности фермента. При этом денатурации ферментов не происходит.
Ингибитор - вещество, вызывающее специфичное снижение активности фермента. Неорганические кислоты и тяжелые металлы ингибиторами не являются, а являются инактиваторами, так как снижают активность любых ферментов, т.е. действуют неспецифично.Так же денатурирующие агенты к ингибитррам не относят.
Ингибиторы: ионы или небольшие молекулы, составляющие часть ферментативной регуляторной системы, а так же фармакологические препараты.
по прочности связывания фермента с ингибитором ингибирование бывает обратимым и необратимым.
по отношению ингибитора к активному центру фермента ингибирование делят на конкурентное и неконкурентное.
Виды ингибирования
1. Обратимое 2. Необратимое
А. КОНКУРЕНТНОЕ А. СПЕЦИФИЧЕСКОЕ
Б. НЕКОНКУРЕНТНОЕ Б. НЕСПЕЦИФИЧЕСКОЕ
Обратимое ингибирование. Большинство ингибиторов действуют обратимо, образуя нековалентные связи с ферментом, и при определенных условиях диссоциируют с восстановлением активности фермента.
Конкурентное ингибирование. Ингибитор похож на субстрат фермента по своей структуре и соперничает с субстратом за активный центр (садится на активный центр фермента), что приводит к уменьшению связывания субстрата с ферментом и нарушению катализа. В этом состоит особенность конкурентного ингибирования – возможность усилить или ослабить ингибирование через изменение концентрации субстрата.
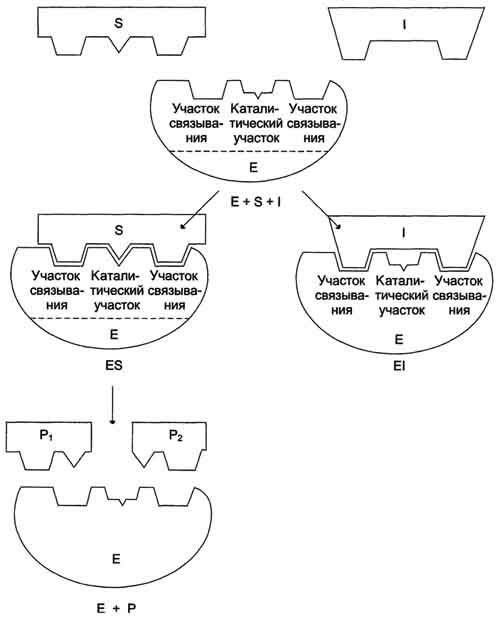
Для конкурентного типа ингибирования справедливы следующие уравнения:
Е + S ⇔ ES → E + P,
E + I ⇔ EI.
1. Конкурентное взаимодействие этанола и метанола за активный центр алкогольдегидрогеназы.
2. Ингибирование сукцинатдегидрогеназы малоновой кислотой, структура которой схожа со структурой субстрата этого фермента – янтарной кислоты (сукцината).
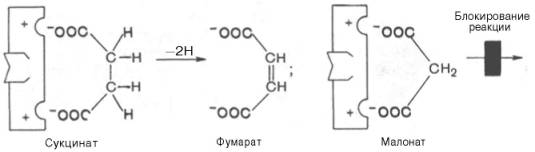
Сукцинат + ФАД ----------- Фумарат + ФАДН2
3.Также к конкурентным ингибиторам относят антиметаболиты или псевдосубстраты, например, антибактериальные средства сульфаниламиды, схожие по структуре с п-аминобензойной кислотой, компонентом фолиевой кислоты. При лечении сульфаниламидами в бактериальной клетке конкурентно нарушается использование п-аминобензойной кислоты для синтеза фолиевой кислоты, что и вызывает лечебный эффект.

Сходство строения сульфаниламидов и парааминобензойной кислоты, компонента витамина в9
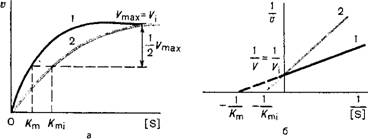
Влияние различных концентраций субстрата на скорость реакции, катализируемой ферментами 1 и 2(в присутствии ингибитора): а) гиперболическая зависимость V от [S], б) прямая зависимость в обратных координатах 1/V от 1/[S] - Лайнуивера-Бэрка.
Конкурентные ингибиторы уменьшают скорость химической реакции. Конкурентный ингибитор повышает Кm для данного субстрата (уменьшает сродство субстрата к ферменту). Это означает, что в присутствии конкурентного ингибитора необходима большая концентрация субстрата для достижения 1/2 Vmax. Увеличение соотношения концентрации субстрата и ингибитора снижает степень ингибирования. При значительно более высоких концентрациях субстрата ингибирование полностью исчезает, потому что активные центры всех молекул фермента будут находиться преимущественно в комплексе с субстратом.
Неконкурентное ингибирование. Ингибитор не имеет структурного сходства с субстратом иприсоединеняется не в активном центре, а в другом месте молекулы, одновременно с субстратом. Образуется тройной комплекс: субстрат - фермент - ингибитор. Это ведет к деформации активного центра и каталитической активности. Например, синильная кислота (цианиды) связывается с гемовым железом ферментов дыхательной цепи и блокирует клеточное дыхание.
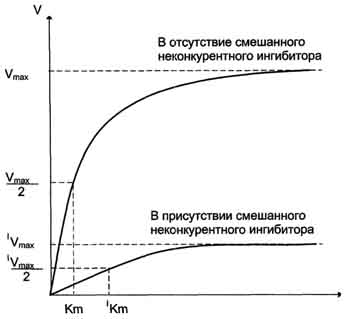
Кинетическая зависимость неконкурентного ингибирования: характеризуется снижением Vmax ферментативной реакции и уменьшением сродства субстрата к ферменту, т.е. увеличением Кm.
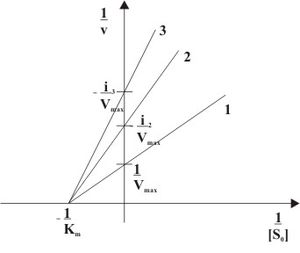
Неконкурентное ингибирование в двойных обратных координатах при различных концентрациях ингибитора (1 - [I]=0; 2 - [I]>0; 3 - [I]>[I]2).
При неконкурентном ингибировании константа Михаэлиса не изменяется, а максимальная скорость реакции уменьшается в (1 + [I]/Ki) раз. Поэтому в двойных обратных координатах семейство прямых, отвечающих разным концентрациям ингибитора, пересекается в одной точке на оси абсцисс.Необратимое ингибирование наблюдают в случае образования ковалентных стабильных связей между молекулой ингибитора и фермента. Чаще всего модификации подвергается активный центр фермента, В результате фермент не может выполнять каталитическую функцию.
К необратимым ингибиторам относят ионы тяжёлых металлов, например ртути (Hg2+), серебра (Ag+) и мышьяка (As3+), которые в малых концентрациях блокируют сульфгидрильные группы активного центра. Субстрат при этом не может подвергаться химическому превращению (рис. 2-26). При наличии реактиваторов ферментативная функция восстанавливается. В больших концентрациях ионы тяжёлых металлов вызывают денатурацию белковой молекулы фермента, т.е. приводят к полной инактивации фермента.
