- •Содержание занятия.
- •Упражнения.
- •Тестовый контроль.
- •Сравнение свойств аминов различного типа.
- •Одномерная восходящая хроматография. Разделение и идентификация смеси 2-х аминокислот в присутствии «свидетелей».
- •Нанесение веществ на хроматограмму.
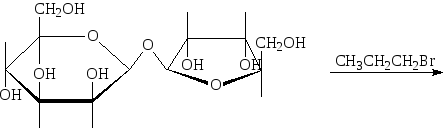
- •Свойства ди- и полисахаридов.
- •Хроматография сахаров на пластинках "Силуфол".
- •Написать формулу дипептида
- •I.Вывести формулу Хеуорса для моносахарида и написать реакции:
- •II. Построить восстанавливающий и не восстанавливающий дисахариды
Методические указания для студентов отделения «медицинская биохимия»
к занятию
ТЕМА» Химия азотсодержащих соединений»
ЦЕЛЬ ИЗУЧЕНИЯ ТЕМЫ: Сформировать и творчески развить знания строения и особенностей химического поведения азотсодержащих соединений (нитро-и аминосоединений), необходимые для понимания строения и поведения природных азотсодержащих соединений в биологических системах.
.
ПЛАН ЗАНЯТИЯ:
1.Практическое занятие по указанной теме
2.Выполнение домашнего задания.
3.Текущий контроль.
СОДЕРЖАНИЕ ЗАНЯТИЯ:
1.Понятие о нитросоединениях. Строение нитро-группы и реакции нитросоединний. Получение нитросоединений ароматического ряда реакциями электрофильного замещения и жирного ряда – реакциями нуклеофильного замещения галогена.
Влияние нитрогруппы на подвижность галогена в ароматическосм ядре.
2. Амины. Классификация аминов. Номенклатура аминов.
3.Получение аминов реакциями нуклеофильного замещения галогена, восстановление нитросоединений,.перегруппировка Гофмана
4.Основность аминов. Зависимость основности аминов от строения. Реакции аминов с кислотами .Нуклеофильные свойства аминов. Реакции аминов с галогенпроизводными, с карбонильными соединениями, карбоновыми кислотами и их производными.Защита амино-группы.Значение этой реакции.
5 Реакции аминов различного типа с азотистой кислотой. Реакция диазотирования первичных ароматических аминов , условия, механизм этой реакции.
6. Диазосоединения. Соли диазония, строение, реакции с выделением и без выделения азота.
Реакция азосочетания. Получение фенола . Строение метилоранжа .
Понятие об алифатических диазосоединений. Диазометан, строение, основные и нуклеофильные свойства.Диазометан как метилирующий агент.
7.Реакции, применяемые для качественного анализа аминов.
ПОДГОТОВКА К ЗАНЯТИЮ:
1.Лекции по указанной теме.
2.Разработка для студентов по диазосоединениям.(см. приложение1)
3.Т.П.Сурикова, В.Н. Захарченко, Курс органической химии , М.,2006г , стр.172-187.
4.Н.А.Тюкавкина , Ю.И.Бауков , БОХ, М.Дрофа, 2008г стр 163-167,171,189-191, 231.
5.И.И.Грандберг и Н.Л.Нам, Органическая химия, Дрофа, М., 2009г,стр.314-323,325-328.
6.Методические указания к лабораторной работе (см. приложение 1).
УПРАЖНЕНИЯ:
1.Написать схему получения 1-нитропропана и его реакции с гидроксидом натрия, пропаналем в щелочной среде.
2.Написать схему получения м-динитробензола и обсудить возможность протекания реакций, указанных в пункте1.
3.Объяснить механизм восстановления о-нитротолуола железом в кислой среде. Предложить другие способы получения продукта реакции.
4.Закончить реакции, указать условия протекания этих реакций:
а) 1-аминопропан с 1)хлороводородом 2) хлористым бензоилом 3) бензальдегидом 4) азотистой кислотой
б) п-этилбензол с теми же реагентами.
в) о-толилдиазоний хлорид с : 1) с водой при нагревании2) СиBr3)N,N-диметиланилином
ПРИМЕР ТЕСТОВОГО ЗАДАНИЯ:
1 Написать схему превращений:

2.Написать схему реакции о-толилдиазоний хлорида с о-метилфенолом. Указать условия (рН) реакции.
Как называется эта реакция?
ОТВЕТ:
1.

2.

Реакция азосочетания.
Методические указания для студентов отделения «медицинская биохимия»
к занятию
Тема: «Химия аминокислот и пептидов. Идентификация аминокислот с помощью хроматографии на бумаге».
Цель изучения темы: сформировать знания строения и реакционной способности α -аминокислот и пептидов, принципов образования пептидной связи, необходимые для структурной организации белков.
ПЛАН ЗАНЯТИЯ.
1.Практическое занятие по теме
2.Текущий контроль
Содержание практического и лабораторного занятия.
План для самоподготовки.
1 Основные аминокислоты, входящиев состав белков. Структура, названия( исторические, названия по ИЮПАК.
2. Строение аминокислот, биполярный ион, катион, анион. Изоэлектрическая точка.
3. Конфигурация аминокислот. Хиральность аминокислот. Обозначение конфигураций аминокислот. L- аминокислоты.
4.Реакции получения аминокислот ( нуклеофильное замещение галогена на амино-группу, восстановление азотсодержещих соединений, циангидринный синтез).
5.Химические свойства аминокислот:
1) реакции аминокислот по амино-группе
2) реакции аминокислот по карбоксильной группе
3)особенности α -аминокислот ( образование дикетопиперазинов, комплексных солей)
4) реакции, применяемые для анализа и идентификации аминокислот (2,4- динитрофенилирование, нингидринная реакция, реакция с фенилизотиоцианатом, с азотистой кислотой и др.)
6.Пептиды, строение, построение названия, общая характеристика свойств, рекции.
7. Принципы определения аминокислотного состава и последовательности аминокислот в пептидах.
8.Основные этапы пептидного синтеза.
9. Методика проведения хроматографии аминокислот на бумаге. Проявление хроматограмм и интерпретация экспериментальных результатов.
Применение хроматографических методов для исследования смеси аминокислот.
.
ПОДГОТОВКА К ЗАНЯТИЮ:
1. Н.А.Тюкавкина, Ю.И.Бауков, БОХ, 2008г, Дрофа, М., стр316- 369.
2. И.И.Грандберг, 2. 2. Н.Л.Нам, Органичесая химия, Дрофа,М., 2009г, стр.484-500.
3. Т.П.Сурикова, В.Н. Захарченко, Курс органической химии, М.,2006г , стр.191-206.
4 И.И.Грандберг , Практ работы по орг. химии, Высшая школа , Москва,стр.98
5. Методические указания к лаб. работам.
Упражнения:
1.Написать реакцию получения аланина и его превращений под действием
а)пропионил хлорида б)этанола в присутствии хлороводорода в) бензальдегида
г) карбоната меди
2.Напишите реакции получения дипептидов ( описать схемы всех стадий синтеза):
а) валиллизин б) аспарагиллейцин
Пример тестового задания:
ВАРИАНТ
1.Написать реакцию получения глицина и его превращений под действием
1)иодметана 2) метанола в присутствии хлороводорода
2.Написать формулы дипептидов, состаящих из фенилаланина и треонина.
Назвать эти дипептиды.
Ответ:

фенилаланилтреонин треонилфенилаланин
Методические указания для студентов отделения «медицинская биохимия»
к занятию
Тема : » Хроматография аминокислот»
Цель изучения темы: сформировать знания основ хроматографии на бумаге и в тонком слое как одного из широко применяемых в медицине и биохимии аналитических методов.
На примере анализа смеси аминокислот приобрести навыки проведения хроматографии и умения интерпретировать полученные результаты.
План занятия:
1.Теоретический опрос.
2.Пояснения к лабораторной работе.
3.Лабораторная работа (учебная задача и контрольная задача)
Содержание занятия.
Программа для самоподготовки.
Хроматография. Сущность метода. Задачи, решаемые с помощью хроматографии (очистка вещества, разделение смесей, анализ смесей, идентификация и др.).
Понятие подвижной и неподвижной фазы. Типы хроматографии в зависимости от характера указанных фаз( Ж-Ж, Ж-Г, Ж-Т, Г-Ж, Г ).
Типы хроматографии в зависимости от характера взаимодействия разделяемых веществ с неподвижной фазой (адсорбционная, распределительная, ионообменная, гельхроматография, аффинная). Типы хроматографии в зависимости от способа разделения (на колонке, в тонком слое, на бумаге).
Типы хроматографии в зависимости от направления элюирования (восходящая, нисходящая, радиальная). Понятие двумерной хроматографии.
Хроматография в тонком слое. Сущность и техника выполнения хроматографии в тонком слое в присутствии « свидетелей». Способы обнаружения зон веществ. Идентификация веществ. Хроматографическая константа ( Rf), ее вычисление.
Метод с использованием « свидетелей».
Методические указания для студентов отделения «медицинская биохимия»
к занятию
ТЕМА: Углеводы, строение, конфигурация и свойства моносахаридов.
Цель изучения темы: сформировать знания особенностей строения и реакционной способности моносахаридов как гетерофункциональных соединений в сравнении со свойствами соответствующих им монофункциональных соединений (альдегидов, кетонов, гликолей), необходимые для понимания их строения и реакционной способности более высокомолекулярных углеводов.
План занятия:
Практическое занятие по теме (теоретический опрос, упражнения)
Текущий контроль
Содержание занятия.:
1.Классификация моносахаридов. Альдозы и кетозы, гексозы и пентозы. Примеры
2 . D- и L- ряды моносахаридов. По какому признаку моносахариды относят к D- или L-ряду?
3.Конф игурационные особенности моносахаридов.
4.Циклические фор мы моносахаридов: фуранозы и пиранозы, α- и β- аномеры.
5.Мутаротация. Причины этого явления. Цикло-оксо-таутомерия.
6.Реакции моносахаридов
а) обусловленные наличием оксо-группы,
б) обусловленные наличием гидрокси – групп,
в) обусловленные наличием цис-гликольных группировок
7.Какой гидроксильный атом называется гликозидным? Какие химические особенности этой группы.
8.Эпимеризация. моносахаридов. Химизм этого явления.
9. С помощью какой реакции можно отличать альдозы от кетоз? Что такое реактив Фелинга?
Подготовка к занятию
1. Н.А.Тюкавкина и Ю.И.Бауков, БОХ, Дрофа,М., 2010 г, стр.371-388;
2.. И.И.Грандберг и Н.Л.Нам, Органическая химия, Дрофа, М , 2008г, стр. 261-277.
3.Т.П.Сурикова, В.Н.Захарченко, Курс органической химии, М.,2006г, стр.206-222
4.Методические указания к лабораторным работам.
УПРАЖНЕНИЯ:
1.Вывести формулу Хеуорса для α – D- арабофуранозы. Написать реакцию с бромэтаном и этанолом. Указать условия. Назвать продукты этих реакций.
2.Провести окисление галактозы азотной кислотой. Назвать продукт. Будет ли полученное соединение обладать оптической активностью?
3.Напишите реакцию D- глюкозы и D – фруктозы с реактивом Фелинга. Пояснить полученные продукты реакций.
4.Получить глюкуроновую кислоту. Сравнить свойства последней со свойствами моносахаридов.
Пример тестового контроля.
2. 1.Написать проекционную формулу Фишера для D-рибозы и реакцию этого соединения с гидроксиламином.Назвать продукт реакции.
2. Вывести формулу Хеуорса для L(β)- арабофуранозы и написать реакцию с анилином. Назвать продукт реакции.
3.Определить стерический ряд и принадлежность к α или β изомеру для моносахарида следующего строения:

Ответ:
СНО
1.

.Dрибоза оксимD- рибозы
2.

Lβ-арабофуранозаN-фениламино-Lβ-арабофуранозид
3.Dряд,β- аномер
Методические указания для студентов отделения «медицинская биохимия»
к занятию
Тема:«Химия углеводов. Гликозиды и дисахариды. Понятие о полисахаридах»
Цель изучения темы: сформировать знания особенностей строения и реакционной способности дисахаридов в сравнении со свойствами моносахаридов, необходимые для понимания строения и пространственной организации высокомолекулярных углеводов.
План занятия:
1.Практическое занятие по указанной теме
2.Текущий контроль
Содержание занятия:
1.Понятие о гликозидах, классификация. О-гликозиды, сравнение с полными ацеталями альдегидов и кетонов. Условия получения и гидролиз. Свойства гликозидов.
2. Строение гликозидов.α – и β –Гликозиды
3. Строение дисахаридов. Невосстанавливающиеся и восстанавливающиеся дисахариды, их отличия. Химические реакции, общие для двух типов дисахаридов, и характерные только для второго типа. Условия гидролиза дисахаридов.
4.Строение и свойства мальтозы, сахарозы и лактозы.
5. Понятие о строении некоторых полисахаридов: крахмала, целлюлозы и гликогена.
Подготовка к занятию:
1Н.А.Тюкавкина и Ю.И.Бауков, БОХ, Дрофа,М., 2010 г, стр.388-390; 400-420;
2.. И.И.Грандберг и Н.Л.Нам, Органическая химия, Дрофа, М , 2008г, стр. 261-277.
3.Т.П.Сурикова, В.Н.Захарченко, Курс органической химии, М.,2006г, стр.221-225
4.Методические указания к лабораторным работам.
УПРАЖНЕНИЯ ПО ТЕМЕ:
1.Написать реакцию Dα-фруктофуранозы с этанолом. Указать условия протекания реакции и назвать продукт.
2. Написать реакцию гидролиза D/β-бутилманнопиранозида. Указать условия и объяснить механизм.
3. Написать реакцию получения восстанавливающего дисахарида исходя из D–α глюкопиранозы иD-β –маннопиранозы. Указать условия получения. Назвать дисахарид.
4. Написать реакцию получения невосстанавливающего дисахарида исходя из D–α глюкопиранозы иD-β –маннопиранозы. Указать условия получения. Назвать дисахарид.
5.Какой качественной реакцией можно различать восстанвливающие и невосстанавливающие дисахариды. Написать реакции.
6. Написать реакцию сахарозы с пропиловым спиртом. Указать условия реакции.
7.Написать реакцию лактозы с иодметаном и с метанолом. Указать условия
8.Возможна ли мутаротация для сахарозы?
9.Возможга ли мутаротация для лактозы?
10 Эпимеризация. Для каких дисахаридов она возможна?
Пример тестового контроля.
1. Написать реакцию гидролиза Dα-метилрибофуранозида.
2. Написать формулу невосстанавливающегося дисахарида, состоящего из Dβ—маннопиранозы иDβ-рибофуранозы. Назвать соединение. Написать реакцию с 1-бромпропаном.
О
 ТВЕТ
ТВЕТ
+
Dβ-маннопиранозил-Dβ-рибофуранозид
Лабораторная работа: научиться проводить характерные общие и специфические
реакции дисахаридов.
Методические указания для студентов .Тема: Липиды. Омыляемые липиды.
Цель изучения темы:
Сформировать знания строения и химических свойств омыляемых липидов (триацилглицеринов и фосфолипидов) и их структурных компонентов, необходимые для изучения структуры биологических мембран и процессов липидного обмена.
Цель лабораторной работы:
Методами качественного и количественного анализа научиться идентифицировать жиры различного состава.
План занятия:
Практическое занятие по теме (теоретический опрос, упражнения).
Текущий контроль.
Лабораторная работа.
Содержание занятия.
Липиды, определение, классификация: простые и сложные, омыляемые и неомыляемые. Примеры. Роль в биологических процессах.
Структурные компоненты простых и сложных омыляемых липидов.
Омыляемые простые липиды. Воски. Жиры и масла (триацилглицерины).
Состав, строение, названия жиров. Основные жирные кислоты, входящие в состав жиров (пальмитиновая, стеариновая, олеиновая, линолевая, линоленовая, арахидоновая). Особенности их строения и конфигурации.
Химические свойства жиров. Реакция гидролиза в кислой и щелочной среде(реакция омыления).
Реакции присоединения, окисления жиров. Пероксидное окисление жиров, условия, механизм. Примеры реакций, применяемых для установления строения жиров (аналитическая характеристика жиров).
Сложные липиды. Фосфолипиды- одна из групп сложных липидов. Состав, строение, отдельные представители. Глицерофосфолипиды как производные L -глицеро-3-фосфата.
L-Фосфатидовые кислоты и фосфатиды- производные этих кислот. Понятие о строении фосфатидилсеринов, фосфатидилэтаноламинов, фосфатидилхолинов. Гидролиз фосфолипидов.
Понятие о неомыляемых липидах (камфора, каротин, холиевые кислоты, холестерин и др.)
Подготовка к занятию:
1.Н.А.Тюкавкина и Ю.И.Бауков, Биоорганическая химия, Дрофа,М.,2010г.,стр.444-464.
Упражнения.
Написать структурную формулу олеиновой кислоты, изобразить конформацию углеводородного радикала этой кислоты.
Написать формулу 2-олеоил-1пальмитоил-3-стеароилглицерина с учетом строения хирального центра в природных жирах.
Провести
а) гидролиз жира, указанного в пункте (2) в щелочной среде,
б) гидрогенолиз
в) окисление KMnO4 в нейтральной и кислой средах.
Написать структурную формулу фосфатидилсерина, содержащего остатки олеиновой и стеариновой кислот. Какие продукты получаются при его гидролизе? Какой из ацильных остатков данного фосфолипида может подвергаться пероксидному окислению? Написать схему этой реакции.
Тестовый контроль.
Напишите схему гидролиза 1-олеоил-2-линолеоил-3-пальмитоил-глицерина гидроксидом натрия. Назвать продукты гидролиза.
Ответ:



олеат, пальмитат, линолеат натрия
Методические указания для студентов отделения «медицинская биохимия»
к занятию
ТЕМА : « Химия гетероциклических соединений. Строение нуклеотидов.»
Цель занятия: определить понятие «гетероциклические соединения». Сформировать знания особенностей строения и химического поведения этих соединений. Рассмотреть вопрос о строении нуклеиновых кислот, их биологической роли.
ПЛАН ЗАНЯТИЯ;
1.Рассмотрение теоретического материала по теме, упражнения.
2.Текущий контроль.
Содержание ЗАНЯТИЯ.
1.Понятие гетероциклического соединения. Классификация. Понятие о номенклатуре гетероциклических соединений. Распространенность в природе, роль в биологических процессах. Ароматический характер гетероциклических соединений.
2. Пятичленные гетероциклические соединения с одним гетероатомом.
Основные представители: фуран, пиррол, тиофен. Строение, ароматичность. Сравнение со свойствами бензола.
Особенности реакций электрофильного замещения (нитрования, сульфировании, галоидирования). Особые свойства пиррола.
Кислотные свойства пиррола. Распространенность пиррольного цикла в природе( гемин, хлорофилл, витамин В 12и др.).
3.Шестичленные гетероциклические соединения. Пиридин как пример шестичленного гетероциклического соединения с одним гетероатомом.
Ароматические свойства пиридинового ядра, сравнение со свойствами бензола и пиррола. Пиридин как основание. Природные соединения на основе пиридинового ядра. Примеры.( никотиновая кислота, витамин В 6, никотинамид).
4.Азотсодержащие гетероциклические соединения с двумя и более гетероатомами. Примеры. Азотсодержащие основания на основе пиримидина и пурина, входяшие в состав нуклеиновых кислот. Строение пиримидиновых ( урацил, тимин, цитозин) и пуриновых ( аденин, гуанин) оснований.
5.Строение и названия нуклеозидов и нуклеотидов. Строение АТФ. Понятие о макроэргических связях.
6.Понятие о структуре нуклеиновых кислот как полимерной цепи нуклеотидов.
Сравнение структуры ДНК и РНК. Двойная спираль ДНК. Роль комплементарных оснований в пространственной организации ДНК.
МАТЕРИАЛ ДЛЯ ПОДГОТОВКИ К ЗАНЯТИЮ.
1Лекции по указанной теме
2.Н, А.Тюкавкина и Ю.И.Бауков , БОХ, «Дрофа», М.,2008г, стр.147-149; 420-434.
Упражнения.
1.Сравнить действие серной кислоты на пиррол и пиридин.
2.Сравнить условия нитрования пиридина и пиррола.
3.На примере каких реакций можно продемонстрировать сходство химического поведения пиррола и фенола?
4.Осуществить следующие превращения:
дымящая железо в нитрит нагревание
пиридин --------------- А ------------- Б ------------В ----------- Г
HNO3 кислой среде натрия
Бром Mg, абс. СО2 Н2О,Н+
5. пиридин--------------- А ---------------- Б------------ В ----------- Г
эфир
6.Написать формулу нуклеозида, состоящего из рибозы и урацила, 2-дезоксирибозы и аденина. Назвать полученные нуклеозиды.
ПРИМЕР ТЕСТОВОГО КОНТРОЛЯ:
Вариант
1.Закончить реакции:
Mg,абс.CH3CHO
тиофен + диоксандибромид---- А-------------Б ------------- В
эфир
2.Написать формулу 5’- D-β- рибоуридиловой кислоты, дать другое название.
Ответ:

Приложение 1.
Диазосоединения ароматического ряда и их использование в органическом синтезе
Диазосоединения ароматического ряда получают взаимодействием первичного ароматическог амина с азотистой кислотой.В общем виде эта реакция может быть представлена следующей схемой:

Э та
реакция называется реакцией диазотирования.
Азотистая кислота образуется из
нитрита натрия, однако в реакции
диазотирования принимает участие не
сама азотистая кислота , а образующиеся
из нее электрофильные диазотирующие
агенты , например, катион нитрозония
N=O.Механизм диазотирования
сложен,так как образующиеся промежуточные
продукты подвержены различным таутомерным
превращениям в зависимости от рН
среды.Один из упрощенных механизмов
диазотирования может быть представлен
следующим образом:
та
реакция называется реакцией диазотирования.
Азотистая кислота образуется из
нитрита натрия, однако в реакции
диазотирования принимает участие не
сама азотистая кислота , а образующиеся
из нее электрофильные диазотирующие
агенты , например, катион нитрозония
N=O.Механизм диазотирования
сложен,так как образующиеся промежуточные
продукты подвержены различным таутомерным
превращениям в зависимости от рН
среды.Один из упрощенных механизмов
диазотирования может быть представлен
следующим образом:
Диазотирование ароматических аминов проводится в водной среде в присутствии 2-3 молей минеральной кислоты притемпературе ниже нуля грудусов.Первичный амин вступает в реакцию в свободном состоянии, но так как реакция проводится в кислой среде, то амин присутствует в виде соли:
Д![]()
![]() ля
каждого амина существует оптимальное
значение рН, при котором он диазотируется
наиболее эффективно.Как правило, чем
меньше основность амина, тем более
кислой должна быть среда при
диазотировании.Ароматические амины в
воде практически нерастворимы , в отличие
от их солей, которые хорошо растворимы
в воде.В воде соли аминов не только
растворимы, но и частично диссоциируют,
подвергаясь гидролизу:
ля
каждого амина существует оптимальное
значение рН, при котором он диазотируется
наиболее эффективно.Как правило, чем
меньше основность амина, тем более
кислой должна быть среда при
диазотировании.Ароматические амины в
воде практически нерастворимы , в отличие
от их солей, которые хорошо растворимы
в воде.В воде соли аминов не только
растворимы, но и частично диссоциируют,
подвергаясь гидролизу:
По мере диазотирования , равновесие смещается вправо, в сторону образования свободного амина. Минеральная кислота выполняет несколько функций:растворяет амин, образует азотистую кислоту из нитритов, образует активный нитрозирующий агент. Ее избыток приводит к уменьшению концентрации свободного амина, ее недостаток способствует протеканию побочной реакции – образованию диазоаминосоединений:
![]()
Для предотвращения этой побочной реакции диазотирование ведут с такой скоростью, чтобы в растворе не было избытка свободного амина и постоянно присутствовал диазотирующий агент.Наиболее оптимальные условия диазотирования, как уже было сказано, 2-3 моля кислоты на 1 моль амина.Реакция диазотирования эндотермична, поэтому перед началом реакции растворы амина и нитрита натрия охлаждают, а при проведении ее держат реакционную смесь в кристаллизаторе со льдом и даже прибавляют лед в реакционную массу,постоянно следя за температурой.Охлаждение предотвращает течение еще одной побочной реакции -разрушение соли диазония до фенолов.Оптимальная температура диазотирования - ниже 0 С. Номенклатура солей диазония.
Для названия соли диазония добавляется окончание диазоний к названию ароматического радикала с указанием названия анионаНапример:
![]()
![]() фенилдиазоний
хлорид ,либо хлористый фенилдиазоний
фенилдиазоний
хлорид ,либо хлористый фенилдиазоний
п-нитрофенилдиазонийборфторид, борфторид п-нитрофенилдиазония.
Соли диазония - это ионные соединения,легко растворимые в воде , существуют, в основном,из-за своей крайней неустойчивости, в растворе при низких температурах. При повышении температуры легко распадаются с выделением азота, хотя есть и исключения. Так,например, борфторид фенилдиазония выделен в твердом состоянии. В связи с этим соли арилдиазониев не выделяют, а применяют их относительно безопасные водные растворы, получаемые при диазотировании первичных ароматических аминов. Относительную стабильность ароматических солей диазония (в противоположность алкилдиазониевым ионам, спонтанно разлагающимся даже при низких температурах) объясняют делокализацией положительного заряда по ароматическому ядру. Соли диазония легко вступают в реакции с отщеплением молекулярного азота, причем отрыв молекулы азота может происходить ( в зависимости от условий) как гетеролитически, так и гомолитически:
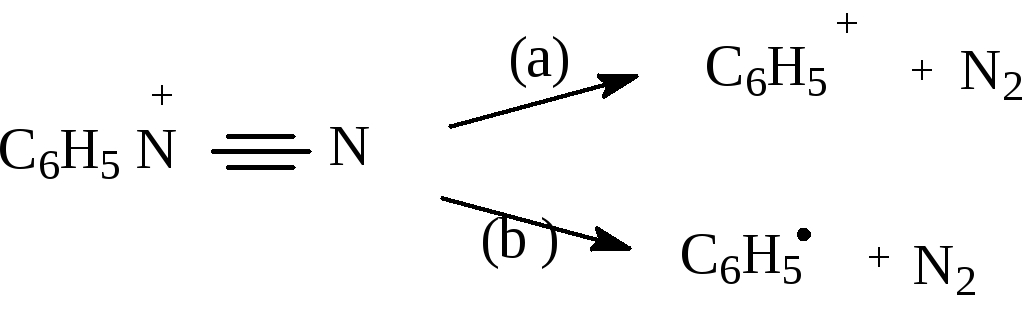
В первом случае реакция идет по S N 1 механизму, в другом - по -SR механизму.Поэтому соли диазония широко используются в органическом синтезе для введения различных функциональных групп:нитро-группы,галогенов,гидрокси-групп,циано-группы,алкокси-группы и др.

Замещение диазогруппы
на галоген является лучшим способом
введения этих заместителей в ароматическое
ядро,так как позволяет получить чистый
изомер в отличие от реакции
прямогогалоидирования в ароматическое
ядро(реакция электрофильного замещения),
в результате которой всегда получается
смесь изомеров.Однако реакции замещения
диазогруппы на галоген протекают, как
уже было сказано, по различному
механизму.Для введения хлора,брома и
иода используют реакцию Зандмейера.( S
R).
Эта реакция проводится при добавлении
порошка меди или солей одновалентной
меди.Образующиеся побочные продукты
указывают на р адикальный
характер этой реакции.Ион меди играет
роль переносчика электронов.
адикальный
характер этой реакции.Ион меди играет
роль переносчика электронов.
При введении легко окисляющихся или обратимо окисляющихся заместителей катализатор реакции становится излишним(например с иодом).Схема реакции :

Однако, как уже указывалось, распад солей диазония может осуществляться по-другому механизму. Так, при нагревании водных растворов солей диазония происходит потеря азота и образуется фенил-катион, который реагирует с растворителем,выступающим в роли нуклеофила. Таким образом эта реакция мономолекулярна и является типичной реакцией мономолекулярного нуклеофильного замещения.( S N1 ),что определяет направление реакции :взаимодействие фенил-катиона с реагентом, обладающим наибольшей электроотрицательностью . По этой причине в водных растворах в качестве реагента выступает вода и получаются фенолы, в спиртовом растворе -эфиры, а из галогенов можно вводить только фтор.( фтор обладает наивысшей электроотрицательностью).
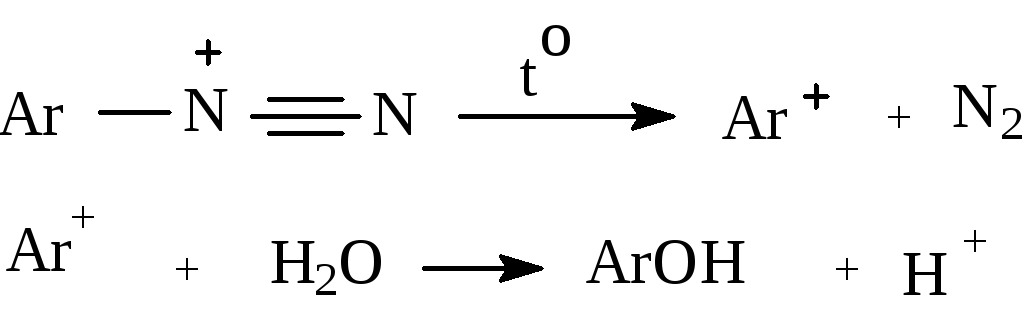
А![]() рилфториды
получают нагреванием твердой
тетрафторборатной соли:
рилфториды
получают нагреванием твердой
тетрафторборатной соли:
Существует "прямой" и "обратный " способ диазотирования. "Прямой" метод диазотирования заключается в предварительном растворении диазотируемого амина в трехкратном избытке минеральной кислоты с последующим постепенным введением в него при охлаждении до 0о раствора эквивалентного количества нитрита натрия."Обратный " метод диазотирования заключается в постепенном введении во взятый в избытке и охлажденный до 0о раствор минеральной кислоты смеси щелочного раствора диазотируемого амина и нитрита натрия. Обычно применяется при диазотировании аминокарбоновых и аминосульфокислот.Конец диазотирования определяется по иодкрахмальной бумаге(бумага,пропитанная раствором иодистого калия и крахмала). Азотистая кислота -окислитель,поэтому она , находясь в избытке,окисляет I- до Iо , который и дает характерную окраску с крахмалом.Избыток азотистой кислоты при проведении реакции с солями диазония нежелателен, поэтому избыток кислоты удаляют из реакционнной смеси после диазотирования с помощью сухой мочевины ,которую добавляют до прекращения выделения газов,образующихся в результате реакции мочевины с азотистой кислотой.
Соли диазония могут вступать в реакции и с сохранением молекулы азота.Соли диазония являются по своей природе электрофильными агентами, но слабыми из-за возможности делокализации положительного заряда с участием бензольного ядра, вследствие чего они взаимодействуют только с ароматическими соединениями, активированными сильными электронодонорными заместителями, какими являются амино - и гидрокси-группы. В результате такого взаимодействия получаются азосоединения. Сама реакция протекает по схеме реакции электрофильного замещения в ароматическом ряду.
С![]() уммарная
реакция: азосоединение
уммарная
реакция: азосоединение
Этот процесс называется реакцией азосочетания. Реакция азосочетания
протекает при определенной рН среды. Для реакции с аминами оптимальные
условия реакции рН = 3,5-9; для фенолов – 9-10.
В сильно кислой среде амины могут протонироваться и терять свои
нуклеофильные свойства:

Основная среда способствует протеканию другой реакции: таутомерным
превращениям соли диазония в зависимости от рН среды:

Лабораторные работы.