
- •1. Взаимодействие фотонов оптического излучения с молекулами. Квантово-механические основы и последствия.
- •1.1. Основные характеристики оптического излучения
- •1.2. Основные квантово-механические механизмы взаимодействия оптического излучения с атомами и молекулами
- •1.3. Электронные переходы в атомах и молекулах при поглощении квантов оптического излучения.
- •2. Законы поглощения света веществом. Спектрофотометрический анализ. Особенности спектрофотометрии биологических объектов. Некоторые специальные методы спектрофотометрического анализа.
- •2.1. Количественное описание поглощения света растворами. Закон Бугера-Ламберта-Бера.
- •2.2. Условия выполнения закона Бугера-Ламберта-Бера.
- •2.3. Качественный и количественный спектрофотометрический анализ.
- •2.3.1. Качественный спектрофотометрический анализ.
- •2.3.2. Количественный спектрофотометрический анализ.
- •2.4. Некоторые специальные методы спектрофотометрии
- •2.5. Особенности спектрофотометрии биологических объектов
- •Оптические неоднородности
- •3. Вторичное излучение света молекулами объекта. Люминесцентный анализ и особенности его использования для исследования биологических объектов.
- •3.1. Явление фотолюминесценции
- •3.2. Электронные переходы в возбужденной молекуле. Законы люминесценции.
- •3.3. Зависимость интенсивности фотолюминесценции от концентрации люминесцирующих молекул. Люминесцентный анализ.
- •3.4. Методы регистрации фотолюминесценции. Спектрофлуориметры. Особенности флуориметрии биологических объектов.
- •3.5. Время жизни возбужденного состояния молекул. Связь между временем жизни возбужденных состояний и квантовым выходом фотолюминесценции.
- •3.6. Влияние окружения люминесцирующих молекул на параметры фотолюминесценции. Флуоресцентные зонды и метки.
- •3.7. Причины снижения интенсивности фотолюминесценции в биологических объектах. Тушение фотолюминесценции. Миграция энергии электронного возбуждения.
- •3.8. Поляризация фотолюминесценции.
- •3.9. Замедленная флуоресценция и фосфоресценция.
- •3.10. Хемилюминесценция биологических систем. Хемилюминесцентный анализ.
- •3.11. Проточная цитофлуориметрия.
- •3.12. Влияние размера люминесцирующей полупроводниковой частицы на ее свойства как люминофора. Квантовые точки.
- •В обычных полупроводниках радиус экситона Бора (ах) определяет размер областей электронного возбуждения.
- •Применение квантовых точек в качестве флуорофоров в медицине и биологии
- •Молекулярные сенсоры
- •Молекулярная диагностика
- •Гибридные молекулярные устройства
- •4.Биофизические основы некоторых фотобиологических процессов. Применение оптического излучения в медицине.
- •4.1. Общие закономерности фотохимических процессов в биомолекулах.
- •4.1.1. Кинетика однофотонных необратимых фотохимических реакций
- •4.1.2. Кинетика однофотонных обратимых фотохимических реакций
- •4.1.2. Кинетика многофотонных фотохимических реакций
- •4.2. Спектры действия фотопревращений молекул и фотобиологических процессов.
- •4.2.1 Спектры действия фотобиологических эффект при небольшой постоянной дозе облучения
- •4.2.2.Спектры действия при постоянной величине фотобиологического эффекта.
- •4.2.3.Спектры действия биологических ответов, зависящих от скорости фотопревращения активных молекул.
- •4.3. Фотомодификация олигомерных и однокомпонентных белков под действием ультрафиолетового излучения.
- •4.3.1. Естественное (солнечное) ультрафиолетовое излучение.
- •4.3.2. Кинетика фотоинактивации белковых молекул.
- •4.3.3. Природа первичных продуктов фотолиза аминокислот и их остатков в белках.
- •Значения для
- •4.4. Действие ультрафиолетового излучения на биологические мембраны.
- •4.5. Действие ультрафиолетового излучения на нуклеиновые кислоты.
3.11. Проточная цитофлуориметрия.
Появление высокочувствительных фотодетекторов (фотоэлектронных умножителей), лазерных источников света (позволяющих получать практически монохроматическое высокоинтенсивное излучение), разработка методик мечения биологических молекул флуоресцентными метками с высоким квантовым выходом фотолюминесценции и создание достаточно мощных для быстрой обработки большого объема информации компьютеров позволили разработать специальные флуориметрические устройства для индивидуальной оценки свойств отдельных клеток в клеточных суспензиях (в т.ч. в цельной крови). Такие устройства носят название проточных цитофлуориметров. Схема такого цитофлуориметра и краткое описание принципов его работы приведены на рис. 28
Следует отметить, что разработка проточных цитофлуориметров стала возможна только после того, как было выяснено, что каждый тип клеток несет на своей поверхности специфические антигены (так называемые маркёрные антигены), которые не экспрессируются клетками других типов. Были получены моноклональные антитела против каждого из подобных антигенов, и флуоресцирующие производные этих антител (а также - антител против данных антител), меченные ковалентно присоединяемыми флуоресцентными метками. Наборы подобных антител против клеточных маркеров семейства CD (CD - кластер дифференцировки, англ. cluster of differentiation, cluster designation - номенклатура дифференцировочных антигенов лейкоцитов человека. Данная классификация была предложена в 1982 году для идентификации и исследования поверхностных мембранных белков лейкоцитов. CD-антигенами или CD-маркёрами могут быть белки, которые служат рецепторами или лигандами, участвующими во взаимодействии клеток между собой и являющимися компонентами каскада определённых сигнальных путей. Но они могут быть и белками, выполняющими другие функции, например, белками клеточной адгезии. Список CD-антигенов, внесённых в номенклатуру, постоянно пополняется и в настоящее время содержит 350 CD-антигенов и их подтипов) время коммерчески доступны. В качестве флуоресцентных меток обычно используются возбуждающиеся и фотолюминесцирующие в видимой области красители, либо флуорофоры на базе так называемых «квантовых точек» (см. ниже).
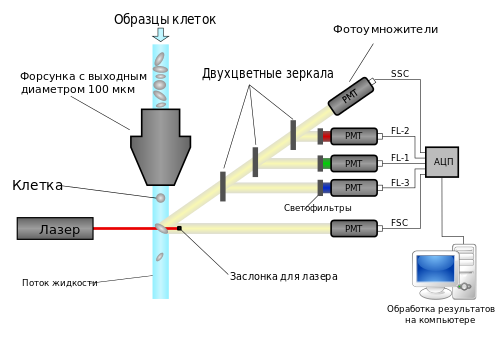
Рисунок 28. Схема устройства проточного цитофлуориметра. Исследуемая суспензия клеток, которые были предварительно обработаны тем или иным набором флуоресцентно-меченных моноклональных антител против маркерных антигенов с помощью насоса высокого давления прогоняется через форсунку с диаметром выходного отверстия около 100 мкм. Далее клетки по одной попадают в проточный капиллярный канал, где освещаются излучением лазера (иногда в приборе бывают установлены несколько лазерных источников, испускающих свет в разных спектральных диапазонах). Во время прохождения через лазерный пучок вторичное излучение клеток анализируется набором фотоэлектронных умножителей, каждый из которых измеряет интенсивность свечения в спектральной области, соответствующей зоне флуоресценции какой-либо из флуоресцентных меток, которыми были обработаны исследуемые клетки. Регистрируются также интенсивности рассеянного клеткой под прямым углом излучения и прямо проходящего света лазера. Сигналы всех фотоэлектронных умножителей попадают в компьютер, где происходит обработка полученных данных.
Регистрируемая интенсивность свечения каждой метки на каждой из проходящих через пучок лазера клеток (напомним, клетки двигаются в капиллярной проточной кювете строго по одной, см. рис. 28) запоминаются компьютером. После того, как через лазерный пучок прошло заранее задаваемое количество клеток (зарегистрировано определенное количество «клеточных событий»), на основании полученной информации рассчитываются распределения клеток по размеру (рассчитываемым на основании времени прохождения клетки через лазерный пучок), по экспресии тех или иных антигенов и т.д. Получаемая информация позволяет оценить качественный и количественный состав исследуемой клеточной суспензии, функциональное состояние отдельных групп клеток (например, активация лейкоцитов обычно сопровождается появлением на их поверхности антигенов, которые отсутствуют у покоящихся клеток данного типа). Можно также определить долю погибших клеток в исследуемом образце и даже установить механизм их гибели (антигенные детерминанты и размеры у клеток, погибших по механизму некроза, отличаются от таковых у клеток, погибших вследствие апоптоза).
Очень важной областью применения проточной цитофлуориметрии стала диагностика гемобластозов, поскольку каждый тип патологических (лейкозных) клеток имеет свои маркерные антигены. Соответственно, выявив присутствие в крови больного клеток с определенным (присущим только конкретному типу гемобластоза) набором маркерных антигенов, можно точно диагностировать наличие гемобластоза данного типа. Количество же таких клеток в крови указывает на тяжесть течения патологии на момент обследования пациента.
