
- •Саратовский государственный технический университет
- •Краткий очерк истории развития физической химии
- •Разделы физической химии
- •1 Основы термодинамики
- •1.1 Природа энергии
- •1.2 Энергетические эффекты в химических реакциях
- •1.3 Энтальпия
- •1.4 Закон Гесса
- •1.5 Теплоты образования
- •1.6 Измерение изменений энергии, калориметрия
- •1.7 Теплотворная способность топлив и пищи
- •1.8 Потребление энергии: тенденции и перспективы
- •2 Химическая кинетика. Химическое равновесие
- •2.1 Скорость химических реакций
- •2.2 Зависимость скорости реакции от концентрации. Закон действия масс
- •2.3 Влияние температуры на скорость реакции. Правило Вант-Гоффа
- •2.4 Химическое равновесие и его смещение
- •2.4.1 Влияние изменения концентрации веществ на смещение химического равновесия
- •2.4.2 Влияние изменения давления на смещение химического равновесия, если в реакции участвуют газообразные вещества
- •2.4.3 Влияние изменения температуры на смещение химического равновесия
- •3 Свободная энергия. Энтропия и равновесие
- •3.1 Самопроизвольные процессы
- •3.2 Самопроизвольные процессы и изменение энтропии
- •3.3 Интерпретация энтропии на молекулярном уровне
- •3.4 Вычисление изменений энтропии
- •3.5 Функция свободной энергии
- •3.6 Свободная энергия и константа равновесия
- •4 Аналитические выражения основых законов термодинамики
- •4.1 Термодинамическая система и термодинамические функции.
- •Первый закон термодинамики
- •4.2 Второй закон термодинамики. Теорема Карно
- •4.3 Постулат Планка. Абсолютное значение энтропии
- •4.4 Характеристические функции. Приложение второго закона термодинамики
- •4.4.1 Изохорно-изотермический потенциал
- •4.4.2 Изобарно-изотермический потенциал
- •4.4.3 Уравнение максимальной работы (уравнение Гиббса-Гельмгольца)
- •4.4.4 Термодинамические потенциалы. Характеристические функции. Условия равновесия
- •4.5 Фазовые переходы. Уравнение Клайперона-Клаузиуса
- •4.5.1 Фазовые переходы первого рода. Плавление. Испарение
- •5 Поверхностные явления. Адсорбция
- •5.1 Изотеормы адсорбции газов. Уравнение Генри
- •5.2. Уравнение Лэнгмюра. Адсорбция смеси газов
- •5.3 Уравнение изотермы адсорбции паров Брунауера, Эммета и Теллера (уравнение бэт)
- •6 Правило фаз гиббса. Равновесие гетерогенных систем
- •6.1 Однокомпонентные системы
- •6.2 Двухкомпонентные системы с одной фазой переменного состава
- •6.2.1 Диаграмма плавкости двухкомпонентных систем, не образующих химических соединений и твердых растворов
- •6.2.2 Диаграммы плавкости систем, компоненты которых образуют химическое соединение
- •6.3 Термический анализ
- •6.4 Физико-химический анализ
- •7 Термодинамика и кинетика твердофазного
- •7.2 Основные типы реакций взаимодействия соединяемых материалов
- •I. Кристаллохимические реакции замещения катиона оксида.
- •III. Реакции взаимного растворения оксидов.
- •IV. Образование нового оксида при переменной валентности катиона.
- •V. Окисление металла в контакте с оксидами переменного состава.
- •VI. Реакции растворения оксида в металле.
- •VII. Реакции с частичным окислением свариваемого металла
- •7.3 Термодинамика и кинетика формирования соединений при слабом химическом взаимодействии материалов
4.3 Постулат Планка. Абсолютное значение энтропии
По уравнениям (4.34) и (4.37) невозможно вычислить абсолютное значение энтропии системы. Такую возможность дает новое недоказуемое положение, которое было сформулировано Планком (1912). Согласно этому положению, называемому постулатом Планка энтропия индивидуального кристаллического вещества при абсолютном нуле равна нулю:
![]() (4.39)
(4.39)
Постулат Планка справедлив только для индивидуальных веществ, кристаллы которых идеально построены, такие тела называются идеальными твердыми телами. Реальные кристаллы не являются таковыми. Поэтому реальные кристаллы при 0 К обладают энтропией больше нуля.
В соответствии с постулатом Планка уравнение (4.39) для идеального твердого тела примет вид:
![]() (4.40)
(4.40)
Можно показать, что при очень низких температурах не только энтропия и теплоемкость твердого тела стремятся к нулю (как это установлено экспериментально), но и многие другие свойства твердых тел (объем тела, давление насыщенного пара и др.) изменяются с температурой так, что их производные по температуре стремятся к нулю. Этим объясняется принцип недостижимости абсолютного нуля, согласно которому никакие процессы не могут снизить температуру тела до абсолютного нуля.
Постулат Планка используется при термодинамических расчетах химических процессов для вычисления абсолютных значений энтропий химических соединений. Энтропия твердого вещества вычисляется по уравнению (4.40). Для вычисления необходимо знать экспериментальные значения теплоемкостей, определенные для возможно низких температур до 10 К или 80 К. Значения теплоемкостей до 0 К находят путем экстраполяции по уравнениям Дебая или Тарасова либо с помощью эмпирических приемов.
Уравнение
для вычисления энтропии газа при
некоторой температуре
![]() будет иметь вид:
будет иметь вид:
 ,
(4.41)
,
(4.41)
где
![]() и
и![]() .
– удельные теплоты агрегатных превращений.
.
– удельные теплоты агрегатных превращений.
Очевидно,
что энтропию вещества, находящегося в
жидком состоянии при температуре
![]() ,
также можно вычислить по уравнению
(4.41), исключив два последних члена в
правой части:
,
также можно вычислить по уравнению
(4.41), исключив два последних члена в
правой части:
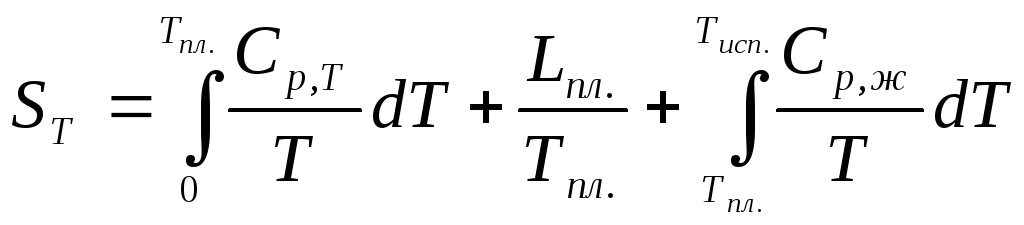 (4.42)
(4.42)
Интегральные
члены уравнения (4.42) находят графическим
интегрированием. Для этого строят кривые
![]() и численное значение интеграла определяют
по величине площади, ограниченной кривой
и осью
и численное значение интеграла определяют
по величине площади, ограниченной кривой
и осью
абсцисс, заключенными между соответствующими температурами. Однако для расчета энтропии требуется выполнить серию точных и трудных экспериментальных исследований.
4.4 Характеристические функции. Приложение второго закона термодинамики
4.4.1 Изохорно-изотермический потенциал
Работа процесса в общем случае зависит от пути процесса. Работа неравновесного процесса меньше, чем работа равновесного процесса, протекающего между теми же начальными и конечными состояниями системы. Исходя из уравнения первого закона термодинамики (4.2) и уравнения (4.33), получаем в общем случае:
![]() (4.43)
(4.43)
Величина правой части этого уравнения не зависит от того равновесен или не равновесен процесс. В случае равновесного процесса:
![]() (4.44)
(4.44)
Для неравновесного процесса:
![]() <
<
![]() (4.45)
(4.45)
Сравнивая уравнения (4.44) и (4.45), получаем:
![]() .>
.>![]()
Таким образом, работа равновесного процесса максимальна.
Максимальная
работа не зависит от пути, а определяется
лишь начальным и конечным состоянием
системы. Так, при
![]()
![]() (равновесный адиабатный процесс):
(равновесный адиабатный процесс):
![]() и
и
![]() ,
,
т.е. величина максимальной работы определяется изменением внутренней энергии системы.
Интегрируя
при постоянной
![]() уравнение (4.44), получим:
уравнение (4.44), получим:
![]() (4.46)
(4.46)
или
![]() (4.47)
(4.47)
Выражения, стоящие в скобках являются функциями состояния системы. Введя в уравнение (4.47) обозначение:
![]() ,
(4.48)
,
(4.48)
получаем
(при
![]() ):
):
![]() ,
(4.49)
,
(4.49)
где
![]() – функция состояния, называемая
изохорно-изотермическим потенциалом
(более коротко – изохорным потенциалом)
илисвободной
энергией системы.
Таким образом, максимальная
работа при изохорно-изотермических
равновесных процессах равна убыли
свободной энергии системы.
– функция состояния, называемая
изохорно-изотермическим потенциалом
(более коротко – изохорным потенциалом)
илисвободной
энергией системы.
Таким образом, максимальная
работа при изохорно-изотермических
равновесных процессах равна убыли
свободной энергии системы.
Переписав
уравнение (4.49) в виде
![]() ,
можно рассматривать внутреннюю энергию,
как состоящую из двух частей - свободной
энергии
,
можно рассматривать внутреннюю энергию,
как состоящую из двух частей - свободной
энергии![]() и связанной энергии
и связанной энергии![]() .
.
Лишь
часть внутренней энергии – свободная
энергия, которую система отдает вовне
при
![]() ,
может превратиться в работу (условием
такого превращения является равновесность
процесса; в неравновесном процессе
свободная энергия частично и полностью
переходит в теплоту). Другая часть
внутренней энергии – связанная энергия
– при изменении системы при
,
может превратиться в работу (условием
такого превращения является равновесность
процесса; в неравновесном процессе
свободная энергия частично и полностью
переходит в теплоту). Другая часть
внутренней энергии – связанная энергия
– при изменении системы при![]() не дает работы, а переходит только в
теплоту:
не дает работы, а переходит только в
теплоту:![]() .
.
Таким образом, энтропия есть фактор емкости связанной энергии.
Полный дифференциал функции можно получить, дифференцируя уравнение (4.48):
![]() (4.50)
(4.50)
Сопоставив это уравнение с уравнениями (4.44) и (4.45), получим в общем виде:
![]() (4.51)
(4.51)
Откуда
при
![]()
![]() или
или
![]()
![]() (4.52)
(4.52)
Выражение (4.52) отражает уже известное положение, что работа неравновесного процесса меньше работы равновесного процесса.
Если
при равновесном процессе совершается
только работа расширения (![]() ),
то из уравнения (4.51) получаем:
),
то из уравнения (4.51) получаем:
![]() (4.53)
(4.53)
Это
выражение является полным дифференциалом
функции
![]() при переменных
при переменных![]() и
и![]() .
Частные производные этой функции:
.
Частные производные этой функции:
![]() (4.54)
(4.54)
всегда
отрицательны. Следовательно, изохорный
потенциал убывает при возрастании
объема и при возрастании температуры.
Мерой убыли изохорного потенциала
системы при возрастании температуры
(при условии
![]() )
является энтропия системы.
)
является энтропия системы.
Полагая
![]() и
и![]() ,
а также при условии отсутствия всех
других видов работы (
,
а также при условии отсутствия всех
других видов работы (![]() ),
получаем из уравнения (4.51):
),
получаем из уравнения (4.51):
![]() ,
(4.55)
,
(4.55)
т.е.
изохорный
потенциал системы, находящейся при
постоянных
![]() и
и![]() ,
не изменяется при равновесных процессах
и убывает при неравновесных процессах.
,
не изменяется при равновесных процессах
и убывает при неравновесных процессах.
Изохорный потенциал, являясь производным понятием по отношению к энтропии, представляет собой более удобный практически критерий направления процессов, чем энтропия.
Таким образом, изохорный потенциал системы, находящейся при постоянных объеме и температуре, стремится уменьшиться в естественных самопроизвольных процессах. Когда он достигает минимального значения, система приходит в равновесие.
Условия равновесия для системы при постоянных объеме и температуре:
![]() ;
;
![]() (4.56)
(4.56)
