
- •Саратовский государственный технический университет
- •Краткий очерк истории развития физической химии
- •Разделы физической химии
- •1 Основы термодинамики
- •1.1 Природа энергии
- •1.2 Энергетические эффекты в химических реакциях
- •1.3 Энтальпия
- •1.4 Закон Гесса
- •1.5 Теплоты образования
- •1.6 Измерение изменений энергии, калориметрия
- •1.7 Теплотворная способность топлив и пищи
- •1.8 Потребление энергии: тенденции и перспективы
- •2 Химическая кинетика. Химическое равновесие
- •2.1 Скорость химических реакций
- •2.2 Зависимость скорости реакции от концентрации. Закон действия масс
- •2.3 Влияние температуры на скорость реакции. Правило Вант-Гоффа
- •2.4 Химическое равновесие и его смещение
- •2.4.1 Влияние изменения концентрации веществ на смещение химического равновесия
- •2.4.2 Влияние изменения давления на смещение химического равновесия, если в реакции участвуют газообразные вещества
- •2.4.3 Влияние изменения температуры на смещение химического равновесия
- •3 Свободная энергия. Энтропия и равновесие
- •3.1 Самопроизвольные процессы
- •3.2 Самопроизвольные процессы и изменение энтропии
- •3.3 Интерпретация энтропии на молекулярном уровне
- •3.4 Вычисление изменений энтропии
- •3.5 Функция свободной энергии
- •3.6 Свободная энергия и константа равновесия
- •4 Аналитические выражения основых законов термодинамики
- •4.1 Термодинамическая система и термодинамические функции.
- •Первый закон термодинамики
- •4.2 Второй закон термодинамики. Теорема Карно
- •4.3 Постулат Планка. Абсолютное значение энтропии
- •4.4 Характеристические функции. Приложение второго закона термодинамики
- •4.4.1 Изохорно-изотермический потенциал
- •4.4.2 Изобарно-изотермический потенциал
- •4.4.3 Уравнение максимальной работы (уравнение Гиббса-Гельмгольца)
- •4.4.4 Термодинамические потенциалы. Характеристические функции. Условия равновесия
- •4.5 Фазовые переходы. Уравнение Клайперона-Клаузиуса
- •4.5.1 Фазовые переходы первого рода. Плавление. Испарение
- •5 Поверхностные явления. Адсорбция
- •5.1 Изотеормы адсорбции газов. Уравнение Генри
- •5.2. Уравнение Лэнгмюра. Адсорбция смеси газов
- •5.3 Уравнение изотермы адсорбции паров Брунауера, Эммета и Теллера (уравнение бэт)
- •6 Правило фаз гиббса. Равновесие гетерогенных систем
- •6.1 Однокомпонентные системы
- •6.2 Двухкомпонентные системы с одной фазой переменного состава
- •6.2.1 Диаграмма плавкости двухкомпонентных систем, не образующих химических соединений и твердых растворов
- •6.2.2 Диаграммы плавкости систем, компоненты которых образуют химическое соединение
- •6.3 Термический анализ
- •6.4 Физико-химический анализ
- •7 Термодинамика и кинетика твердофазного
- •7.2 Основные типы реакций взаимодействия соединяемых материалов
- •I. Кристаллохимические реакции замещения катиона оксида.
- •III. Реакции взаимного растворения оксидов.
- •IV. Образование нового оксида при переменной валентности катиона.
- •V. Окисление металла в контакте с оксидами переменного состава.
- •VI. Реакции растворения оксида в металле.
- •VII. Реакции с частичным окислением свариваемого металла
- •7.3 Термодинамика и кинетика формирования соединений при слабом химическом взаимодействии материалов
4.2 Второй закон термодинамики. Теорема Карно
Наиболее часто встречающимися и, безусловно, самопроизвольными являются процессы передачи теплоты от горячего тела к холодному (теплопроводность) и перехода работы в теплоту (трение). Многовековая житейская, техническая и научная практика человечества показали повседневную реальность этих процессов, а также невозможность самопроизвольного протекания обратных процессов. Это дает основание утверждать, что единственным результатом любой совокупности процессов не может быть переход теплоты от менее нагретого тела к более нагретому (постулат Клаузиуса).
Другое общее положение утверждает следующее: единственным результатом любой совокупности процессов не может быть превращение теплоты в работу или теплота наиболее холодного тела из участвующих в круговом процессе не может служить источником работы (постулат Томсона).
Оба изложенных положения являются формулировками второго закона термодинамики и эквивалентны друг другу.
Цикл Карно является простейшим круговым процессом, рассматривает сжатие и расширение идеального газа, дающее механическую работу. Существенным является то, что теплообмен в этом цикле совершается при двух постоянных температурах. Путем исследования цикла Карно с помощью второго закона термодинамики могут быть доказаны две важнейшие теоремы.
Коэффициент полезного действия тепловой машины, работающей по циклу Карно, не зависит от природы рабочего тела машины, а лишь от температур нагревателя и холодильника. Коэффициент полезного действия тепловой машины, работающей необратимо, меньше коэффициента полезного действия машины, работающей по обратимому циклу Карно между теми же температурами. Полученные результаты являются общими для любых циклических процессов, так как любой цикл можно заменить бесконечно большим числом бесконечно малых циклов Карно, ограниченных бесконечно малыми отрезками изотерм и конечными отрезками адиабат.
Таким образом, коэффициент полезного действия цикла Карно больше коэффициента полезного действия любого цикла между теми же температурами (теорема Карно). Следовательно, выражение для коэффициента полезного действия циклического процесса, записанного в виде:
![]() ,
(4.25)
,
(4.25)
(где
![]() и
и![]() – максимальная и минимальная температуры
теплообмена рабочего тела с источником
теплоты) является общим законом.
– максимальная и минимальная температуры
теплообмена рабочего тела с источником
теплоты) является общим законом.
ЭНТРОПИЯ
Из уравнения (4.19) для коэффициента полезного действия цикла Карно следует, что
![]() (4.26)
(4.26)
Отношение
![]()
![]() поглощенной
системой теплоты к температуре называется
приведенной
теплотой.
Уравнение показывает, что алгебраическая
сумма приведенных теплот по обратимому
циклу Карно равна нулю.
поглощенной
системой теплоты к температуре называется
приведенной
теплотой.
Уравнение показывает, что алгебраическая
сумма приведенных теплот по обратимому
циклу Карно равна нулю.
Для бесконечно малого обратимого цикла Карно, очевидно:
![]()
![]() ,
(4.27)
,
(4.27)
где
![]() - элементарная приведенная теплота.
Любой цикл может быть заменен совокупностью
бесконечно малых циклов Карно, поэтому,
суммируя выражение (4.27)для всех бесконечно
малых циклов, получаем для любого
обратимого цикла:
- элементарная приведенная теплота.
Любой цикл может быть заменен совокупностью
бесконечно малых циклов Карно, поэтому,
суммируя выражение (4.27)для всех бесконечно
малых циклов, получаем для любого
обратимого цикла:
![]() (4.28)
(4.28)
Разность интегралов поглощенных и выделенных приведенных теплот является алгебраической суммой всех приведенных теплот по обратимому циклу:
![]() (4.29)
(4.29)
Для
необратимого цикла Карно, принимая во
внимание уравнение (4.25), получаем:
![]() <0
и для любого необратимого цикла
<0
и для любого необратимого цикла
![]() <
0. Это – так называемоенеравенство
Клаузиуса.
Интеграл по контуру можно разбить на
два интеграла рис. 4.2:
<
0. Это – так называемоенеравенство
Клаузиуса.
Интеграл по контуру можно разбить на
два интеграла рис. 4.2:
![]() (4.30)
(4.30)
Таким образом, сумма приведенных теплот (интеграл элементарных приведенных теплот) при переходе системы равновесным путем из состояния (1) в состояние (2) не зависит от пути процесса, а только от начального (1) и конечного (2) состояний.
|
Рис. 4.2. Схема циклического процесса. |
Следовательно, интеграл элементарных приведенных теплот в равновесном процессе равен приросту некоторой функции состояния системы:
а подинтегральное выражение есть |
дифференциал
функции
![]() :
:
![]() .
Выражение (4.31) являются определением
функции
.
Выражение (4.31) являются определением
функции
![]() ,
которая являетсяэнтропией.
,
которая являетсяэнтропией.
![]() Энтропия
системы есть функция состояния системы:
ее изменение равно сумме приведенных
теплот, поглощенных системой в равновесном
процессе. Энтропия является однозначной,
непрерывной и конечной функцией
состояния. Энтропия измеряется в тех
же единицах, что и теплоемкость
кал/град∙моль или кал/град∙г.
Энтропия
системы есть функция состояния системы:
ее изменение равно сумме приведенных
теплот, поглощенных системой в равновесном
процессе. Энтропия является однозначной,
непрерывной и конечной функцией
состояния. Энтропия измеряется в тех
же единицах, что и теплоемкость
кал/град∙моль или кал/град∙г.
Для неравновесного процесса, исходя из уравнения (4.30), получим:
![]() <
0 (4.31)
<
0 (4.31)
Полученное выражение не означает, что в результате неравновесного кругового процесса изменяется энтропия системы. Энтропия системы как функция состояния принимает первоначальное значение, и ее изменение равно нулю. Сумма же приведенных теплот, полученных системой, меньше нуля, следовательно, окружающая среда в результате цикла получает от системы некоторое количество приведенной теплоты.
Из уравнения (4.31) получаем:
![]() <
<
![]() или
или![]() <
<![]() (4.32)
(4.32)
Соответствующее
неравенство может быть записано в
дифференциальной форме:
![]() >
>![]() .
Обобщая выражения (4.31) и последнее,
получаем
.
Обобщая выражения (4.31) и последнее,
получаем
![]()
![]()
![]() .
(4.33)
.
(4.33)
В
том случае, если отсутствует теплообмен
системы с окружающей средой
![]() ,
т. е. система является адиабатной,
уравнение принимает вид:
,
т. е. система является адиабатной,
уравнение принимает вид:![]()
![]() 0 или в интегральной форме
0 или в интегральной форме
![]()
![]() 0.
Таким образом, энтропия адиабатной
системы постоянна в равновесных процессах
и возрастает в неравновесных.
0.
Таким образом, энтропия адиабатной
системы постоянна в равновесных процессах
и возрастает в неравновесных.
Исследуя
энтропию, можно предсказать направление
процесса. Если в изолированной системе
энтропия возрастает, то процесс возможен.
Если энтропия, согласно расчету должна
убывать, то процесс невозможен. При
постоянстве энтропии процесс равновесен
и система бесконечно близка к равновесию.
В изолированной системе процессы
прекратятся, когда энтропия системы
достигнет максимального значения,
возможного для данной системы при
постоянстве некоторых ее параметров,
а именно при постоянстве внутренней
энергии
![]() и объема
и объема![]() (условия изолированности системы).
(условия изолированности системы).
МЕТОДЫ РАСЧЕТА ЭНТРОПИИ
Уравнение (4.31), определяющее энтропию, является единственными исходным уравнением для термодинамического расчета изменений энтропии системы, который возможен только путем подсчета приведенных теплот в равновесных процессах. Заменяя элементарную теплоту в уравнении (4.31) ее выражениями через калорические коэффициенты (4.10), получаем для равновесных процессов:
![]()
![]() и
и
![]()
![]() (4.34)
(4.34)
Уравнения
(4.34) являются полными дифференциалами
энтропии как функции переменных
![]() ,
,![]() или
или![]() ,
,![]() .
Коэффициенты этих уравнений – частные
производные энтропии по соответствующим
производным. Подставив в уравнение
(4.34) значения калорических коэффициентов
для моля идеального газа (уравнение
состояния идеального газа)
.
Коэффициенты этих уравнений – частные
производные энтропии по соответствующим
производным. Подставив в уравнение
(4.34) значения калорических коэффициентов
для моля идеального газа (уравнение
состояния идеального газа)![]() и
и
![]() и
полагая
и
полагая
![]() и
и
![]() независимыми от температуры (лишь в
небольших интервалах), получим после
интегрирования в известных пределах:
независимыми от температуры (лишь в
небольших интервалах), получим после
интегрирования в известных пределах:
![]()
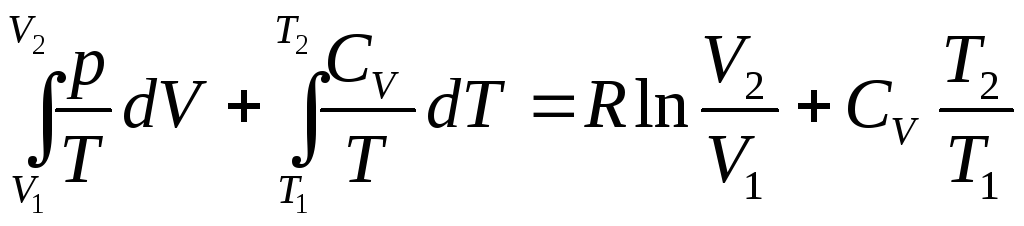 (4.35)
(4.35)
![]()
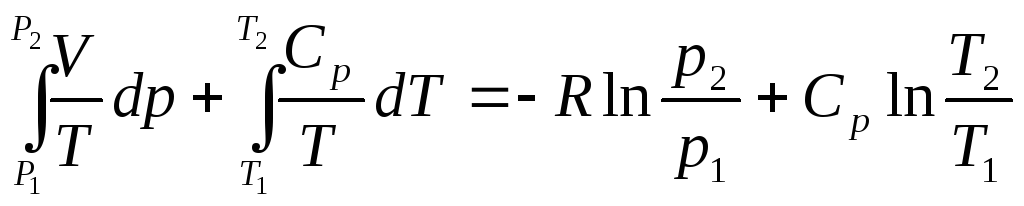 (4.36)
(4.36)
Фиксируя
величины
![]() и
и![]() (или
(или![]() и
и
![]() ),
),![]() а, следовательно, и
а, следовательно, и
![]() ,
и объединяя постоянные члены, получим:
,
и объединяя постоянные члены, получим:
![]()
![]()
![]()
![]() Обозначив
символами
Обозначив
символами
![]() и
и
![]() суммы в скобках (являющиеся постоянными)
и опустив индекс2,
получим для одного моля идеального
газа:
суммы в скобках (являющиеся постоянными)
и опустив индекс2,
получим для одного моля идеального
газа:
![]()
![]() (4.37)
(4.37)
Здесь
![]() и
и
![]() - константы интегрирования.
- константы интегрирования.
Уравнение, используемое для идеального газа в любом интервале температур, имеет вид:
![]()
![]() ,
(4.38)
,
(4.38)
где
![]()
![]() (сумма
постоянной и переменной теплоемкости,
связанной с внутримолекулярным
движением). Здесь
(сумма
постоянной и переменной теплоемкости,
связанной с внутримолекулярным
движением). Здесь![]() –энтропийная
константа идеального газа,
которая имеет совершенно определенную
величину для каждого газа.
–энтропийная
константа идеального газа,
которая имеет совершенно определенную
величину для каждого газа.
Применим полученные выше соотношения для расчетов изменения энтропии при некоторых процессах.
УПРАЖНЕНИЕ 4.1
Фазовые
превращения (изотермические процессы;
![]() ):
):
![]()
Удельная
теплота плавления бензола равна 29,92
кал/г; температура плавления
![]() =
5,50С.
Следовательно изменение энтропии 1 г
бензола при плавлении (энтропия плавления)
равно:
=
5,50С.
Следовательно изменение энтропии 1 г
бензола при плавлении (энтропия плавления)
равно:
![]() кал/г∙град.
кал/г∙град.
УПРАЖНЕНИЕ 4.2
Нагревание
при постоянном давлении (изобарный
процесс;
![]() ).
).
Из уравнения (4.34) получаем:
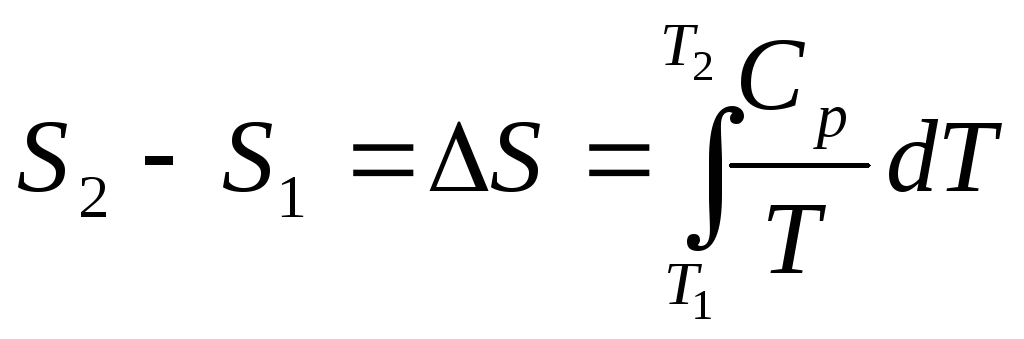
Найдем изменение энтропии 1 грамм-атома алюминия при нагревании от 25 до 6000С. Истинная атомная теплоемкость алюминия может быть выражена уравнением:
![]() 5,006
+ 0,002564
5,006
+ 0,002564![]()
По уравнению (4.39) изменение энтропии будет равно:
![]() ∙
∙![]() кал/г∙град.
кал/г∙град.
УПРАЖНЕНИЕ 4.3
Смешение двух идеальных газов (изотермически-изобарный процесс).
В смеси идеальных газов компоненты ведут себя независимо друг от друга. Поэтому энтропия равновесных смесей идеальных газов является аддитивной функцией состава.
При
смешении двух газов в количестве
![]() и
и![]() молей при постоянной температуре
молей при постоянной температуре![]() и общем давлении
и общем давлении![]() каждый газ изменяет свой объем от
первоначального до объема смеси, равного
сумме объемов газа. Изменение энтропии
при смешении является суммой изменений
энтропий каждого газа при его изотермическом
расширении. В соответствии с уравнением
(4.35) это изменение равно:
каждый газ изменяет свой объем от
первоначального до объема смеси, равного
сумме объемов газа. Изменение энтропии
при смешении является суммой изменений
энтропий каждого газа при его изотермическом
расширении. В соответствии с уравнением
(4.35) это изменение равно:
![]()
Рассчитаем изменение энтропии, происходящее при смешении двух молей азота и одного моля водорода (значение температуры и суммарного давления безразличны для расчета).
Так
как объемы азота, водорода и смеси
находятся в отношениях
![]() ,
то изменение энтропии составит:
,
то изменение энтропии составит:
![]() кал/г∙град.
кал/г∙град.

