
БХ
.pdf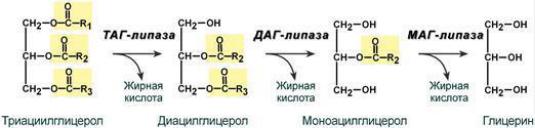
4.Изменена концентрация проинсулина, инсулина и С-пептида. Для диабета 1-го типа характерно снижение или полное отсутствие этих показателей, при диабете 2-го типа они в норме или повышены.
5.Не для диагностики, но для мониторинга длительной гипергликемии используется определение HbA1c (гликозилированный гемоглобин).
6.В сомнительных случаях, т.е. при отсутствии симптомов в сочетании неоднозначностью результатов анализов – рекомендуются глюкозотолерантный тест (ТТГ, нагрузочные пробы с глюкозой):
•самая распространенная проба заключается в приеме испытуемым глюкозы per os из расчета 1,5-2,0 г на кг массы тела. Пробы крови отбирают непосредственно перед приемом глюкозы (нулевая минута, "тощаковый" уровень) и далее через 30, 60, 90 и 120 минут, при необходимости на 150 и 180 минутах.
•в норме в относительных единицах повышение концентрации глюкозы составляет 50-75%
к60 минуте исследования и снижается до исходных величин к 90-120 минутам. В абсолютных единицах по рекомендации ВОЗ подъем уровня глюкозы должен быть не более 7,5 ммоль/л при исходном 4,0-5,5 ммоль/л.
•по результатам теста толерантности к глюкозе определятся тип "сахарной кривой".
Тест на толерантность к глюкозе
Для оценки восприимчивости тканей к действию инсулина (диагностика сахарного диабета) проводят тест на толерантность к глюкозе. Перед проведением теста в течение трех дней рекомендуется низкоуглеводная диета (250-300 мг углеводов/сутки). Утром натощак у пациента берут кровь. Затем пациент выпивает раствор глюкозы (100 г глюкозы/100 мл воды). Это так называемая «сахарная нагрузка». Кровь забирают через 60 и 120 минут после «сахарной нагрузки». Результат на фоне здоровья: натощак менее 5,55 ммоль/л, через 60 мин. – менее 8,88 ммоль/л, через 120 мин. – менее 6,66 ммоль/л. Не рекомендуется проводить пробу при наличии лихорадки, приеме кортикостероидов, диуретиков, контрацептивов и салицилатов, повышающих толерантность к глюкозе.
Определение глюкозы в моче
Содержание глюкозы в моче определяют пробой Бенедикта. Когда уровень глюкозы в крови повышается до 10 ммоль/л, глюкоза начинает выводиться с мочой (глюкозурия). Следовательно, 10 ммоль/л
– почечный порог для глюкозы. Причины глюкозурии: прием большого количества богатой углеводами пищи, стресс, мышечное напряжение, беременность, прием кортикостероидов и АКТГ, сахарный диабет, гипертиреоз, болезнь и синдром Иценко – Кушинга, акромегалия, почечный диабет (нарушения реабсорбции глюкозы в почечных канальцах)
51. Пищевые жиры, их гидролиз. Всасывание продуктов переваривания. Роль желчных кислот в переваривании и всасывании липидов. Транспорт ресинтезированных в кишечнике жиров. Использование жиров, включенных в транспортные липопротеины: липопротеинлипазы. Гиперлипопротеинемия.
Перевариванию подвергаются только эмульгированные липиды. Переваривание начинается в 12- п.к. под действием фермента панкреатической липазы, которая гидролизует ТАГ:
Распад глицерофосфолипидов – осуществляют тканевые фосфолипазы:
Фосфолипаза А1 – гидролизует эфирную связь в 1м положении между глицерином и жирной кислотой;
Фосфолипаза А2 (В) – гидролизует эфирную связь в 2м положении между глицерином и жирной кислотой;
Фосфолипаза С – гидролизует эфирную связь в 3м положении между глицерином и фосфорной кислотой;
Фосфолипаза Д – гидролизует эфирную связь между аминоспиртом и фосфорной кислотой.
101
Панкреатический сок содержит фермент холестеролэстеразу, расщепляющую эфиры холестерина до холестерина и жирной кислоты. Оптимум рН ферментов панкреатического и кишечного сока 7,5 – 8,5.
Эмульгирование липидов:
Суточная потребность взрослого человека в липидах составляет 80-150 г, из них около 90% приходится на жиры. Липиды нерастворимы в воде, поэтому для их переваривания необходимо эмульгирование жировой капли. Эмульгирование происходит:
1)благодаря перистальтике кишечника (происходит механическое дробление капель жира)
2)благодаря выделению СО2 в результате реакции нейтрализации гидрокарбонатов панкреатического сока кислым содержимым желудка; выделяющийся СО2 способствует разрушению крупных капель жира;
3)Под влиянием желчных кислот и их солей капли жира дробятся на мельчайшие капельки. Эмульгированные липиды становятся доступными для действия ферментов.
Роль желчных кислот в эмульгировании липидов:
Желчные кислоты образуются в печени из холестерина, в молекулу которого вводятся гидроксиль-
ные (-ОН) и карбоксильная (-СООН) группы. Желчные кислоты обладают амфипатическими свойствами, т.к. содержат гидрофильные (-ОН и -СООН) и гидрофобные (кольцо стерана) группы. Поэтому желчные кислоты являются детергентами, т.е. эмульгаторами (снижают поверхностное натяжение липидов).
Желчные кислоты:
3,7,12триоксихолановая или холевая кислота,
3,12-диоксихолановая или дезоксихолевая кислота,
3,7- диоксихолановая или хенодезоксихолевая кислота,
3- оксихолановая или литохолевая кислота Большая часть желчных кислот конъюгирует с глицином или таурином по карбоксильной группе
с образованием парных желчных кислот. Парные желчные кислоты обладают более выраженными эмульгирующими свойствами. Кроме того, желчные кислоты активируют панкреатическую липазу, участвуют во всасывании продуктов переваривания липидов в форме мицеллы. Желчные кислоты из печени поступают в желчный пузырь и затем в 12-перстную кишку (12-п.к.), где участвуют в эмульгировании липидов.
Всасывание продуктов переваривания липидов:
Глицерин, фосфорная кислота, холин, инозит, серин, сфингозин и жирные кислоты с короткой цепью (С10-12) легко всасываются из кишечника в кровоток путем диффузии. МАГ, высокомолекулярные жирные кислоты (С>10), холестерин всасываются из просвета кишечника в его стенку в форме смешанных мицелл. Смешанная мицелла состоит из гидрофобного ядра, включающего МАГ, холестерол и жирные кислоты, витамины A, D, E, K, а наружный гидрофильный слой образован фосфолипидами и солями желчных кислот. Мицеллы сближаются со щёточной каймой клеток слизистой оболочки тонкого кишечника, и липидные компоненты мицелл диффундируют через мембраны внутрь клеток. Вместе с продуктами гидролиза липидов всасываются жирорастворимые витамины A, D, Е, К и соли жёлчных кислот. Жёлчные кислоты далее попадают через воротную вену в печень, из печени вновь секретируются в жёлчный пузырь и далее опять участвуют в эмульгировании жиров. Этот путь жёлчных кислот называют «энтерогепатическая циркуляция». Каждая молекула жёлчной кислоты за сутки проходит 5- 8 циклов, и около 5% жёлчных кислот выделяется с фекалиями. В эпителиальных клетках кишечника происходит ресинтез липидов (ТАГ, фосфолипидов и эфиров холестерина). Ресинтезированные в стенке кишечника липиды в составе хиломикронов (ХМ) попадают в лимфатическую систему (из-за больших размеров).
Транспорт хиломикронов:
Хиломикроны (ХМ) – растворимая транспортная форма экзогенных липидов от кишечника к внутренним тканям и органам, в первую очередь, к клеткам жировой ткани. В глубине ХМ содержится до 90% ТАГ, 7% холестерида и его эфиров. Наружный слой образуют свободный холестерин (ХЛ), фосфолипиды (1,5%), а поверхность ХМ образована специфическими белками (1,5%) – апоВ-48. Из грудного лимфатического протока «незрелые» ХМ попадают в кровь и транспортируются к внутренним органам. В кровотоке с поверхности липопротеинов высокой плотности (ЛВП) на ХМ переносятся белки апоС-II и апоЕ и ХМ превращаются в «зрелые», на которые может действовать фермент эндотелия липопротеинлипаза. АпоС-II активирует липопротеинлипазу, которая гидролизует ТАГ до
102
глицерина и жирных кислот в липопротеинах, включая ХМ. Жирные кислоты поглощаются адипоцитами и используются для отложения в запас собственных ТАГ, а также в миоциты, где служат источниками энергии.
Гиперлипопротеинемия - повышенный уровень липидов и/или липопротеинов в крови человека. Гиперлипидемия является фактором риска развития сердечно-сосудистых заболеваний в основном в связи со значительным влиянием холестерина на развитие атеросклероза
52. Мобилизация жиров в жировой ткани, ферменты этого процесса. Гормональная регуляция: роль инсулина, глюкагона, адреналина. Значение внутриклеточного липолиза, нарушение его при ожирении.
Тканевой липолиз происходит в жировой ткани постоянно под действием фермента гормончувствительной липазы (ТАГ-липазы), которая гидролизует ТАГ до глицерина и свободных жирных кислот. Свободные жирные кислоты в жировой ткани могут вновь активироваться и использоваться для синтеза ТАГ. Глицерин не утилизируется в клетках жировой ткани, поэтому он выходит из адипоцитов и поступает в плазму крови, а из кровотока - в печень и далее в почки, где глицерин может превращаться в глицерол-3-фосфат под действием фермента глицерокиназы и затем участвовать в синтетических реакциях. Если скорость липолиза превышает скорость синтеза жиров, то свободные жирные кислоты поступают в плазму крови, где связываются с сывороточными альбуминами, которые переносят их к клеткам печени, скелетной и сердечной мышц. Клетки этих органов используют жирные кислоты как источник энергии.
Фермент гормончувствительная-липаза (ТАГ-липаза) активируется адреналином, норадреналином, глюкагоном, АКТГ. Эти гормоны обладают непрямым механизмом действия и активируют гормончувствительную липазу через вторичных посредников: цАМФ. Инсулин –ингибирует ТАГ-липазу.
Ожирение
Ожирением называется избыточное отложение жира в организме. Ожирение может быть самостоятельным заболеванием либо синдромом, развивающимся при различных заболеваниях. Причинами ожирения является избыточная калорийность пищи, недостаточная физическая активность.
Механизм развития ожирения основан на активации двух процессов: увеличения объема жировых клеток вследствие накопления в них липидов без возрастания количества адипоцитов; усиленного образования жировых клеток из их предшественников – преадипоцитов. Выделяют первичные и вторичные формы ожирения:
1) Первичное ожирение или эндокринно-метаболическое ожирение:
а) гипотиреоидный механизм при недостаточности гормонов щитовидной железы, что снижает интенсивность липолиза, скорость обменных процессов;
б) надпочечниковый (глюкокортикоидный) механизм включается вследствие гиперпродукции ГКС в коре надпочечников;
в) лептиновый механизм - ведущий в развитии первичного ожирения, развивается из-за недостатка лептина в жировых клетках, из-за чего увеличивается образование и выделение гипоталамусом нейропептида Y (участвует в формировании чувства голода - повышает аппетит и снижает энергорасходы организма);
г) инсулиновый механизм развития ожирения развивается вследствие прямой активации инсулином липогенеза в жировой ткани.
2) Вторичное ожирение развивается из-за повышенной калорийности пищи
103
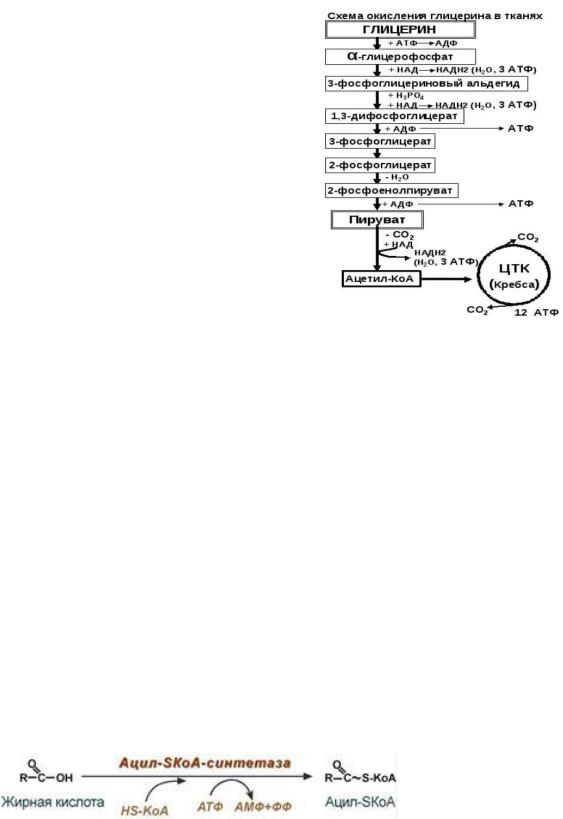
53. Биосинтез и окисление глицерина в тканях, их этапы. Энергетика окисления глицерина. Взаимосвязь обмена глицерина с углеводным обменом.
На этапе гликолиза образуется 7 АТФ. На этапе ОПК 15 АТФ. Итого 22 АТФ.
Синтезируетяс из ТАГ путем действия на него ТАГ-липазы. Глицерин может образовываться из фосфодиоксиацетона или
фосфоглицеринового альдегида - нормальных промежуточных продуктов обмена углеводов.
Глицерин в клетках печени, почек и кишечника под действием глицеролкиназы превращается в глицеролфосфат (затрачивается 1 АТФ). Глицеролфосфат под действием глицеролфосфатдегидрогеназы окисляется до диоксиацетонфосфата (метаболита гликолиза). Затем диоксиацетонфосфат вступает в энергодающую стадию гликолиза (с 5 по 10 реакции) до образования пирувата и 7 АТФ. Пируват окисляется в митохондриях в реакциях общего катаболизма с образованием 15 АТФ.
Использование глицерина и ЖК:
ГЛИЦЕРИН:
1.Для синтеза глюкозы (глюконеогенез) – преимущественно в пе-
чени;
2.Для синтеза ТАГ и глицерофосфолипидов (печени, жировая ткань, кишечник);
3.Для получения энергии.
ЖИРНЫЕ КИСЛОТЫ:
1.Для получения энергии (почки, сердечная мышца, скелетная мускулатура), в том числе с образованием кетоновых тел;
2.Для синтеза ТАГ и глицерофосфолипидов (печени, жировая ткань, кишечник);
3.Для синтеза других жирныхкислот
4.Для синтеза тканевых гормонов - эйказаноидов (из арахидоновой кислоты);
5.Для синтеза эфиров холестерина.
54. Химизм окисления жирных кислот, его связь с митохондриальным окислением. Энергетика окисления жирных кислот. Значение этого процесса для организма. Нарушение окисления жирных кислот при авитаминозах.
Для преобразования энергии, заключенной в жирных кислотах, в энергию АТФ существует метаболический путь окисления жирных кислот до СО2 и воды, тесно связанный с циклом трикарбоновых кислот и дыхательной цепью. Этот путь называется β-окисление. Реакции β-окисления происходят в митохондриях большинства клеток организма (кроме нервных клеток). Для окисления используются жирные кислоты, поступающие в цитозоль из крови или появляющиеся при липолизе собственных внутриклеточных ТАГ.
Этапы окисления ЖК:
1. Активация жирной кислоты. Для дальнейших превращений необходима активация
104
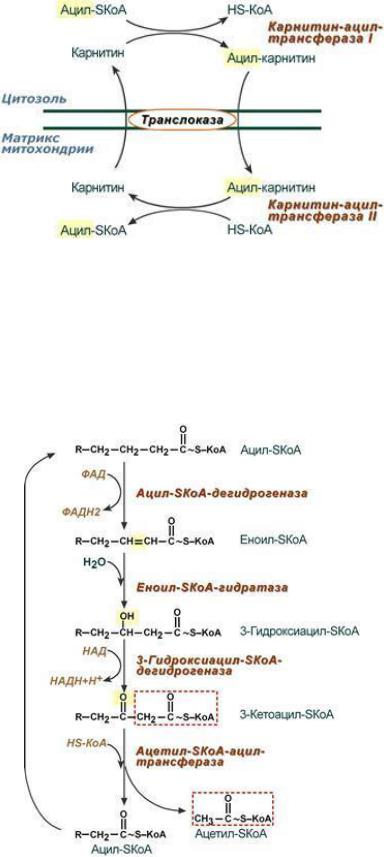
2. Транспорт жирной кислоты из цитоплазмы в матрикс митохондрий при помощи карнитина – низкомолекулярного спирта.
3. Собственно β-окисление, протекающее в матриксе митохондрий только в аэробных условиях. Процесс циклический.
За один цикл:
-от жирной кислоты отщепляется двухуглеродный фрагмент в виде ацетил-КоА, который далее окисляется в ЦТК;
-образуется 2 пары протонов (в составе ФАДН2 и НАДН2), которые поступают в цепь переноса электронов, где синтезируется АТФ по механизму окислительного фосфорилирования.
Для расчета энергетического выхода окисления предельных жирных кислот с четным числом углеродных атомов используют формулу:((5*(n/2)-1)+(12*n/2))-1, где n-число углеродных атомов в жирной кислоте.
При недостатке витамина В2 (ФАД) и витамина РР (НАД) нарушается процесс окисления ЖК. Пример:
Стеариновая кислота (С18) С17Н35СО~S-KoA Стеариновая кислота проходит 8 циклов окисления с образованием 9 ацетил-КоА. В каждом цикле окисления образуется ФАДН2 и НАДН, которые в МХ ЦПЭ образуют 2 и 3 АТФ соответственно: 8 циклов х (2+3=5 АТФ) = 40 АТФ, ацетил-КоА дает 9 х 12 АТФ = 108 АТФ. Итого: 148 АТФ, но 1 АТФ расходуется на активацию жирной кислоты в цитозоле, поэтому итог 147 АТФ. При окислении пальмитиновой кислоты (С16) образуется 130 АТФ.
105
55. Синтез жирных кислот, этапы этого процесса. Строение и функция синтетазы жирных кислот. Взаимосвязь синтеза жирных кислот с обменом углеводов и аминокислот. Образование ненасыщенных жирных кислот. Незаменимые жирных кислоты, их роль в метаболизм
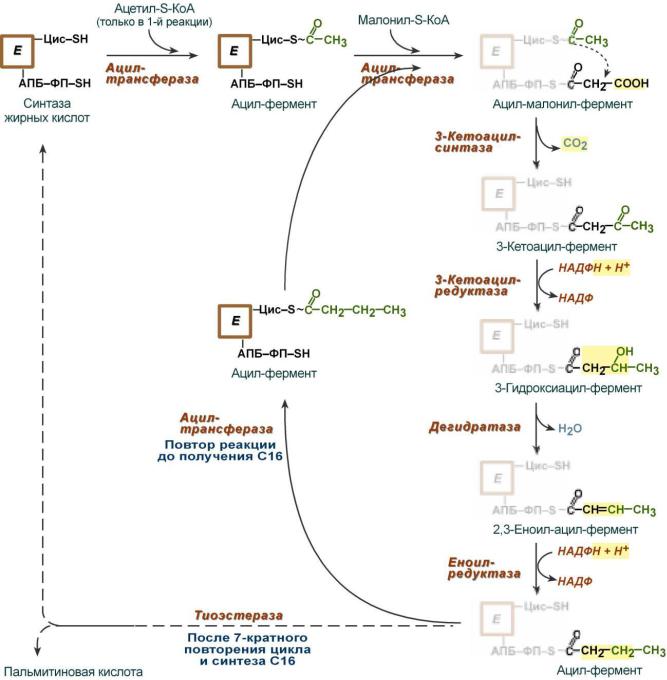
Биосинтез жирных кислот наиболее активно происходит в цитозоле клеток печени, кишечника, жировой ткани в состоянии покоя или после еды.
«Строительным материалом» для синтеза жирных кислот является ацетил-КоА, который может образовываться при окислении углеводов в абсорбтивный период пищеварения. Ацетил-КоА образуется в матриксе митохондрий в результате окисления жирных кислот и глюкозы. Главным источником НАДФН являются реакции окислительной стадии пентозофосфатного цикла, а дополнительным источником НАДФН – «яблочная» реакция (в ЦЗ: малат + НАДФ+ → пируват + СО2 + НАДФН).
Этапы синтеза ЖК:
1.Образование ацетил-SКоА из глюкозы, других моносахаров или кетогенных аминокислот.
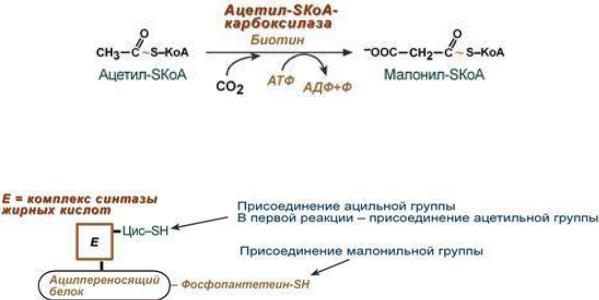
2.Перенос ацетил-SКоА из митохондрий в цитозоль обычно в составе лимонной кислоты, образующейся в первой реакции ЦТК. Поступающий из митохондрий цитрат в цитозоле расщепляется АТФ- цитрат-лиазой до оксалоацетата и ацетил-SКоА.
3.Образование малонил-SКоА из ацетил-SКоА (Карбоксилирование ацетил-SКоА).
4.Синтез пальмитиновой кислоты
Осуществляется синтазой жирных кислот - мультиферментный комплекс – димер, состоит из 2-х идентичных частей (происходит одновременный синтез двух жирных кислот). Каждая часть содержит 7 ферментов и ацилпереносящий белок (АПБ). Имеет 2 SH-группы: центральная принадлежит остатку фосфопантотеновой кислоты (АПБ), периферическая - SH-группа принадлежит цистеину:
Ферменты МФК:
1.Ацетил-трансацилаза;
2.Малонил-трансацилаза;
3.β-кетоацил-АПБ-синтетаза;
4.β -кетоацил-АПБ-редуктаза;
5.β -оксиацил-АПБ-дегидратаза (еноил-АПБ- дегидратаза);
6.Еноил-АПБ-редуктаза;
7.Тиоэстераза (деацилаза).
Этапы синтеза пальмитиновой кислоты:
1.Загрузка синтазы ацетильным и малонильным остатками
2.Наращивание цепи 2-х углеродными фрагментами (за счет малонил-КоА) до образования 16-ти углеродного скелета пальмитиновой кислоты
3.Отщепление жирной кислоты от SH-группы АПБ
106
Регуляция синтеза жирных кислот
Активаторы:
•АТФ (ингибирует изоцитратдегидрогеназу)
•Цитрат (активирует Ацетил-КоА-карбоксилазу)
•Малонил-КоА (ингибирует ацилкарнитил-трансферазу).
Ингибиторы:
•Длинноцепочечные Ацил-КоА
•Адреналин и глюкагон (ингибирует Ацетил-КоА-карбоксилазу)
Образование ненасыщенных жирных кислот (десатурация):
Мононенасыщенные жирные кислоты – пальмитоолеиновая и олеиновая – синтезируются из паль-
митиновой и стеариновой кислот. Эти превращения протекают в ЭПС клеток печени и жировой ткани при участии молекулярного кислорода и микросомальных ферментов. Ферменты, участвующие в этих превращениях, получили название ДЕСАТУРАЗ.
Удлинение цепи жирных кислот (элонгация):
В ЭПС происходит удлинение жирных кислот. Удлинение цепи жирной кислоты происходит путем последовательного присоединения к соответствующему ацил-КоА двухглеродных фрагментов при участии малонил-КоА и НАДФН. Ферменты, катализирующие удлинение жирных кислот, назваются
107
ЭЛОНГАЗЫ. Полиненасыщенные жирны кислоты (имеющие 2 и более двойных связей) являются незаменимыми - арахидоновая, линолевая, линоленовая.
Вещества, необходимые для синтеза ЖК:
-Ацетил-КоА
-Малонил-КоА
-НАДФН*Н
-Цитрат
-АТФ
-Витамины РР, Н, пантотеновая кислота
-Синтаза ЖК
56. Биосинтез жиров в организме: ресинтез жира в эндотелии кишечника, синтез жиров в печени и подкожно-жировой клетчатке. Транспорт жиров липопротеинами крови. Резервирование жиров. Физиологическое значение жиров для организма человека. Нарушение процесса синтеза жиров: ожирение, жировое перерождение печени.
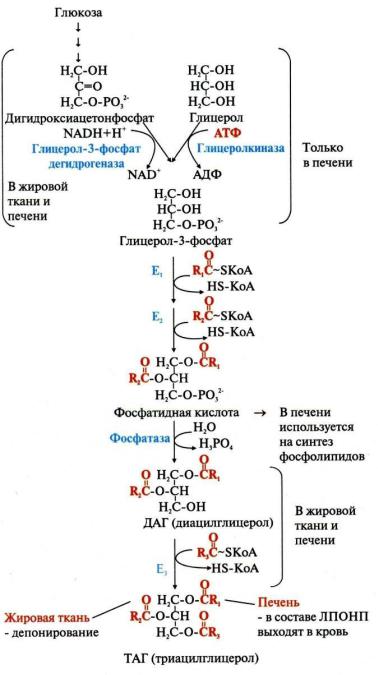
Ресинтез липидов – это синтез липидов в стенке кишечника из поступающих сюда экзогенных жиров, одновременно могут использоваться и эндогенные жирные кислоты, поэтому ресинтезированные жиры отличаются от пищевых и более близки по составу к "своим" жирам. Основная задача этого процесса – связать поступившие с пищей средне- и длинноцепочечные жирные кислоты со спиртом – глицеролом или холестеролом. Это, во-первых, ликвидирует их детергентное действие на мембраны и, вовторых, создает их транспортные формы для переноса по крови в ткани.
Синтез ТАГ
Нейтральные жиры – наиболее выгодная и основная форма депонирования энергии.
Синтез ТАГ происходит в абсорбтивный период в печени и жировой ткани. В жировой ткани происходит депонирование жира, а печень доставляют синтезированные в ней жиры в другие ткани. Непосредственными субстратами в синтезе жиров являются ацил-КоА и глицерол-3-фосфат. Метаболический путь синтеза жиров в печени и жировой ткани одинаков, за исключением разных путей образования глицерол-3-фосфата. И в печени, и в жировой ткани глицерол-3-фосфат может образовываться из глюкозы (из метаболита гликолиза – диоксиацетонфосфата), а из свободного глицерина - в печени, кишечнике и почках. В этих тканях присутствует фермент глицеролкиназа.
В энтероцитах помимо глицеролфосфатного пути синтеза ТАГ существует еще и 2-моноацилг- лицеридный путь (собственно этот процесс и является основным способом синтеза ТАГ в этих клетках). Жиры в стенке кишечника синтезируются из продуктов гидролиза липидов в кишеч-
нике. А процесс получил название РЕСИНТЕЗ ЛИПИДОВ.
108
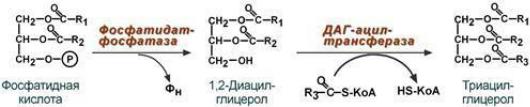
Основная задача этого процесса – связатьпоступившие с пищей жирные кислоты со спиртом (глицеролом или холестеролом). Это ликвидирует их детергентное действие на мембраны и создает их транспортные формы для переноса по крови в ткани.2-моноацилглицеридныйпуть – происходит при участии экзогенных 2-МАГ и ЖК в гладком эндоплазматическом ретикулумеэнтероцитов:
Транспортируются ЛПОНП от печени к тканям.
Резервирование осуществляется в подкожно-жировой клетчатке, печени, околоорганных жировых образованиях, большом и малом сальнике.
Значение жиров:
1)При расщеплении жиров выделяется энергия тепла
2)Защитная и опорная (большой и малый мальник защищают петли кишки, брызжейка подвешивает петли кишки)
3)Депо эндогенной воды
4)Резерв питательных веществ при голодании
5)Гликолипиды являются рецепторами
6)Фосфатидилхолин является вторичных посредником при передаче гормонального сигнала
7)Эйкозаноиды – производные арахидоновой кислоты - являются местными гормонами
Жировой гепатоз печени:
Жировая дистрофия печени — это заболевание печени, сопровождающееся ожирением печѐноч-
ных клеток. Причины ожирения клеток печени - чаще всего избыточное поступление жиров и углеводов в пищу или их избыточное накопление в крови, вследствие различных нарушений обмена веществ, метаболического синдрома, эндокринные заболевания, воздействие токсических для печени веществ, в том числе алкоголя и гепатотоксических лекарственных средств. Возможно развитие жирового гепатоза вследствие нарушения выведения жира из печени. Это происходит при снижении количества веществ, участвующих в переработке жиров (белок, липотропные факторы).
Одним из методов диагностики жировой дистрофии печени является биохимический анализ крови. Наблюдается увеличение печѐночных ферментов: АСТ (аспартатаминотрансфераза), АЛТ (аланинаминотрансфераза), ГГТ (гаммаглутамилтранспептидаза), ЩФ (щелочная фосфатаза); и желчных пигментов: билирубин общий, билирубин прямой
57. Обмен глицерофосфолипидов. Переваривание фосфолипидов в желудочнокишечном тракте. Внутриклеточный гидролиз фосфолипидов. Ферменты этих процессов. Биосинтез глицерофосфолипидов. Этапы этого процесса. Транспорт фосфолипидов липопротеинами крови. Регуляция обмена фосфолипидов: липотропные факторы. Значение фосфолипидов для организма человека.
Биосинтез фосфолипидов имеет общие реакции с процессом синтеза ТАГ. Особенности синтеза заключаются в дополнительной активации компонентов фосфолипидов - фосфатидной кислоты или аминоспирта (холина и этаноламина). Выделяют 2 пути синтеза глицерофосфолипидов:
1 путь (спасательный):
Благодаря этому пути холин и этаноламин используются повторно и не катаболизируют. Активацияхолина (или этаноламина) происходит через промежуточное образование фосфорилированных производных с последующим присоединением ЦМФ. В следующей реакции фосфохолин (или фосфоэтаноламин) переносится на ДАГ. Этот путь особенно характерен для легких и кишечника, но идет и в других тканях. ДАГ синтезируется глицерол-3-фосфата так же, как при синтезе ТАГ.
109
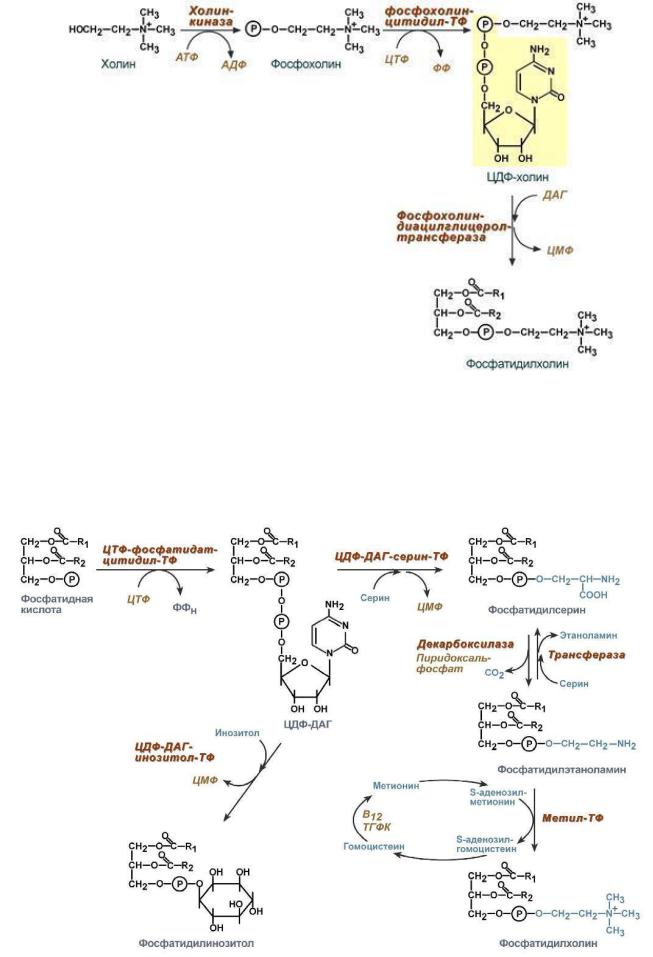
2 путь (основной):
Здесь холин (или этаноламин) не встраиваются в готовом виде, а образуются уже в молекуле фосфолипида.
Активация фосфатидной кислоты заключается в присоединении к ней ЦМФ с образованием ЦДФДАГ. Далее к нему присоединяется шестиатомный спирт инозитол или серин с образованием фосфатидилинозитола и фосфатидилсерина.
Синтезированный фосфатидилсерин подвергается декарбоксилированию с образованием фосфатидилэтаноламина. Последний метилируется при участии Sаденозилметионина в фосфатидилхолин.
Транспортируются от печени к тканям в виде ЛПНП.
110
