
- •Введение
- •1. Формулировка задания
- •2. Теоретические основы
- •3. Исходные данные для выполнения расчетно-
- •Расчетно-графическое задание №1
- •1. Составление уравнения зависимости от температуры величины теплового эффекта и изменения энтропии
- •3. Выведение приближенного уравнения вида где а, в – постоянные
- •4. Определение количества фаз, независимых компонентов и числа степеней свободы
- •5. Определение возможного направления протекания реакции и равновесного состава газовой смеси
- •5.1 Классический способ расчета
- •5.2. Другие случаи расчета равновесного состава газовой смеси
- •6. Установление направления смещения равновесия
- •Библиографический список
Расчетно-графическое задание №1
По дисциплине «Физическая химия»
Раздел «Термодинамика»
вариант 1-21
Выполнил
Студент гр. ТМ-03 (подпись) С.В. Некрасов
Проверила
Проф., канд. техн. наук (подпись) Э.В. Дюльдина
Магнитогорск
2013
ПРИЛОЖЕНИЕ 4
ПРИМЕР ВЫПОЛНЕНИЯ ЗАДАНИЯ
В начале расчета необходимо переписать формулировку задания, вписывая вместо многоточия исходные данные, взятые из табл.1. После подстановки стехиометрических коэффициентов (см. задание 21 в варианте 1) уравнение реакции примет вид:
![]()
Для удобства последующих расчетов составляем таблицу исходных данных, используя справочный материал.
Таблица 2
Исходные
данные для термодинамического исследования
реакции:
![]()
|
№ п/п |
Вещество |
кДж/моль |
Дж/моль•К |
Коэффициенты
в уравнении
=а + bТ + с'Т -2, Дж/моль∙К | ||
|
а |
|
| ||||
|
1 |
CO (Г) |
-110,53 |
197,55 |
28,41 |
4,10 |
-0,46 |
|
2 |
Сl2 (Г) |
0 |
222,98 |
37,03 |
0,67 |
-2,85 |
|
3 |
СОС12 (Г) |
-219,50 |
283,64 |
67,15 |
12,03 |
-9,04 |
1. Составление уравнения зависимости от температуры величины теплового эффекта и изменения энтропии
Зависимость теплового эффекта реакции от температуры определяется законом Кирхгофа (1):
![]()
Рассчитаем
![]() по уравнению (2):
по уравнению (2):
![]()
![]()
Рассчитаем
![]() :
:
![]()
![]()
Рассчитаем
![]() :
:
![]()
![]()
Рассчитаем
![]() :
:
![]()
![]()
Рассчитаем
![]() :
:
![]()
![]()
Найдем тепловой эффект по уравнению (1):

Уравнение зависимости от температуры величины теплового эффекта:
![]()
Составим теперь уравнение зависимости от температуры изменения энтропии.
Изменение энтропии системы в результате протекания процесса определяется по уравнению (7)
![]()
Рассчитаем ![]() по уравнению (8):
по уравнению (8):
![]()
Значения
![]() для соответствующих веществ приведены
в таблице 2, после их подстановки получим:
для соответствующих веществ приведены
в таблице 2, после их подстановки получим:
![]()
Найдем изменение энтропии системы по уравнению (7):
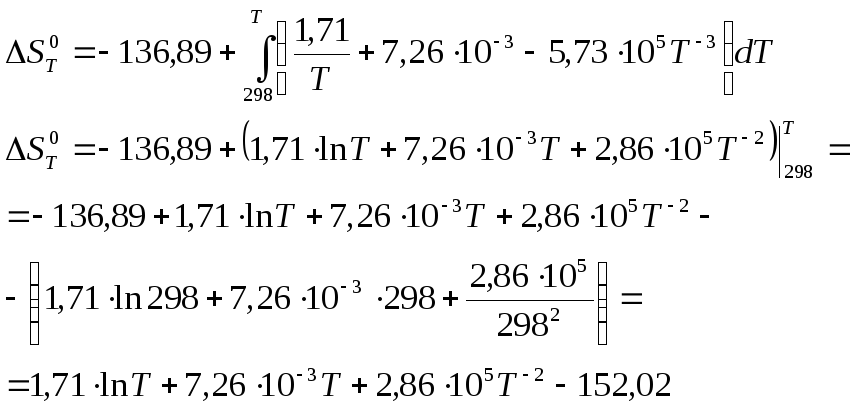
Уравнение зависимости от температуры изменения энтропии:
![]()
2. Вычисление величин
![]() ,
,![]() ,
,![]() и
и![]() при
различных температурах и построение
графиков в координатах
при
различных температурах и построение
графиков в координатах
![]() ;
;![]() ;
;![]() и
и![]()
Определение теплового эффекта реакции при различных
температурах
![]()
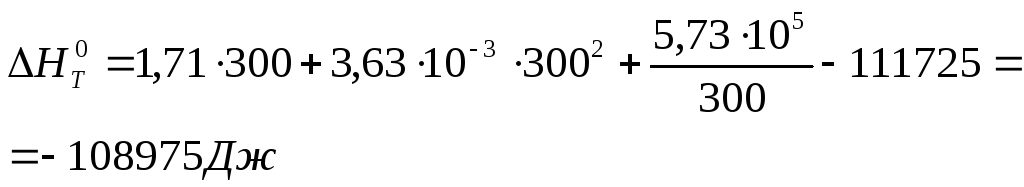
Рассчитаем по аналогии тепловой эффект реакции для других температур заданного интервала (300 – 750 К) и данные занесем в таблицу 3.
Таблица 3
Величина
![]() при различных температурах для реакции:
при различных температурах для реакции:
![]()
|
T, K |
300 |
350 |
400 |
450 |
500 |
|
|
-108975 |
-109045 |
-109028 |
-108947 |
-108817 |
|
Т, К |
550 |
600 |
650 |
700 |
750 |
|
|
-108645 |
-108437 |
-108198 |
-107931 |
-107637 |
По данным таблицы
3 построим график
![]() (рис.1)
(рис.1)

Рис.1 Зависимость теплового эффекта реакции
![]() от температуры
от температуры
Определение изменения энтропии при различных
температурах
![]()
![]()
Рассчитаем по аналогии изменение энтропии для других температур заданного интервала (300 – 750 К) и данные занесем в таблицу 4.
Таблица 4
Значения
изменения энтропии ![]() при
различных
при
различных
температурах
|
Т, К |
300 |
350 |
400 |
450 |
500 |
|
|
-136,91 |
-137,13 |
-137,08 |
-136,89 |
-136,62 |
|
Т, К |
550 |
600 |
650 |
700 |
750 |
|
|
-136,29 |
-135,93 |
-135,55 |
-135,15 |
-134,75 |
По данным таблицы
4 построим график
![]() (рис.2)
(рис.2)

Рис.2 Зависимость изменения энтропии от температуры для реакции
![]()
Расчет изменения стандартной энергии Гиббса
При расчете изменения стандартной энергии Гиббса для реакции воспользуемся уравнением Гиббса- Гельмгольца(9):
![]()
![]()
Рассчитаем по аналогии изменение стандартной энергии Гиббса для других температур заданного интервала (300 - 750К) и данные занесем в табл.5
Таблица 5
Значения изменения
стандартной энергии Гиббса (![]() )
при различных температурах
)
при различных температурах
|
Т, К |
300 |
350 |
400 |
450 |
500 |
|
|
- 67903 |
-61051 |
-54195 |
- 47345 |
- 40507 |
|
Т, К |
550 |
600 |
650 |
700 |
750 |
|
|
- 33684 |
- 26878 |
-20091 |
-13324 |
-6576 |
По данным таблицы
5 построим график
![]() (рис.3)
(рис.3)
Расчет константы равновесия
Константа равновесия связана с изменением стандартной энергии Гиббса соотношением (10):
![]()
![]()
Рассчитаем по
аналогии
![]() для других
температур заданного интервала (300
- 750К) и
данные занесем в табл.6.
для других
температур заданного интервала (300
- 750К) и
данные занесем в табл.6.
![]()

Рис.3 Зависимость
изменения Стандартной энергии Гиббса
от температуры для реакции
![]()
Таблица 6
Константы равновесия для реакции
![]() при
различных температурах
при
различных температурах
|
Т, К |
300 |
350 |
400 |
450 |
500 |
|
|
3,33 |
2,86 |
2,50 |
2,22 |
2,00 |
|
|
27,24 |
20,99 |
16,30 |
12,66 |
9,75 |
|
|
6,75∙1011 |
1,31∙109 |
1,20∙107 |
3,15∙105 |
1,71∙104 |
|
Т, К |
550 |
600 |
650 |
700 |
750 |
|
|
1,82 |
1,67 |
1,54 |
1,43 |
1,33 |
|
|
7,37 |
5,39 |
3,72 |
2,29 |
1,05 |
|
|
1,59∙103 |
2,19∙102 |
4,13∙10 |
9,88 |
2,87 |
Реакции, для которых значения константы равновесия находятся в пределах от10-3 до 103 (10-3 < Kp < 103) принято считать практически обратимыми. Уменьшение Кр с ростом температуры означает, что равновесие реакции при этом сдвигается справа налево.
При 650
К
реакция
![]() обратимая.
обратимая.
По данным
табл.6 построим график
![]() (рис.4).
(рис.4).

Рис.4 Зависимость
![]() от
обратной температуры для реакции
от
обратной температуры для реакции
![]()
