
- •Министерство образования и науки Российской Федерации
- •Программа дисциплины
- •3. Растворы. Электрохимические процессы.
- •3.1. Растворы.
- •3.2. Окислительно-восстановительные процессы. Электрохимия.
- •3.3. Коррозия и защита металлов и сплавов от коррозии.
- •5. Химия и охрана окружающей среды.
- •I. Контрольные задания
- •1.1. Основные понятия химии и единицы их измерения
- •1.2. Строение атома. Периодическая система химических элементов д.И. Менделеева. Периодичность свойств элементов и их соединений.
- •Примеры решения типовых задач.
- •1.3. Химическая связь и строение молекул.
- •Энергия химической связи (d) – количество энергии, которое выделяется при образовании данной химической связи из атомов.
- •Метод валентных связей
- •При наложении двух π-связей на одну σ-связь возникает тройная связь, например, в молекулах азота, ацетилена, синильной кислоты:
- •Метод молекулярных орбиталей
- •Примеры решения типовых задач.
- •1.4. Энергетика химических реакций.
- •Примеры решения типовых задач
- •1.5. Химическая кинетика и равновесие
- •Примеры решения типовых задач.
- •Растворы
- •Способы выражения концентрации растворов
- •1.6.1. Ионно-молекулярные (ионные) реакции обмена
- •В кислой среде и.
- •Гидролиз соли, образованной сильной кислотой и слабым основанием.
- •Гидролиз соли, образованной слабой кислотой и слабым основанием.
- •1.6.2. Жесткость природных вод и ее устранение
- •Примеры решения типовых задач.
- •Задача 1. Сколько граммов содержится в воды, если жесткость, обусловленная присутствием этой соли, равна ?
- •1.7. Окислительно-восстановительные реакции
- •Примеры решения типовых задач.
- •Задача 1. Составьте уравнение окислительно-восстановительной реакции между перманганатом калия и сульфитом натрия в среде серной кислоты.
- •Переходим к молекулярной форме уравнения:
- •1.8. Электрохимические процессы
- •Определить абсолютные значения электродных потенциалов невозможно. Их можно только сравнивать.
- •1.8.2. Электролиз
- •Примеры электролиза растворов электролитов с нерастворимыми анодами.
- •Примеры электролиза растворов электролитов с растворимыми анодами.
- •Законы Фарадея. Выход продукта по току
- •Для расчетов используют математическое выражение обобщенного закона Фарадея:
- •Примеры решения типовых задач.
- •1.9. Коррозия и защита металлов и сплавов от коррозии
- •Кинетика коррозионного процесса
- •Методы защиты металлов от коррозии
- •Примеры решения типовых задач
- •1.10. Комплексные соединения
- •Методы получения комплексных соединений.
- •Примеры решения типовых задач.
- •1.11. Задачи к контрольной работе №1
- •1.12. Задачи к контрольной работе №2
- •Определите рН 0,001 м раствора кон, считая диссоциацию полной.
- •Подберите по два уравнения в молекулярном виде к каждому из кратких ионных уравнений:
- •При сливании растворов иобразуется осадок гидроксида хрома (III). Объясните причину этого явления и напишите соответствующие уравнения в молекулярном и ионном виде.
- •Водородный показатель (рН) 0,003н раствора гипохлорита калия равен 9,5. Вычислите степень гидролиза этой соли и напишите уравнения реакций гидролиза в молекулярном и ионном виде.
- •Определите степень гидролиза (для первой ступени) и рН в 0,001м растворе и. Напишите уравнения реакций в молекулярном и ионном виде.
- •II. Варианты контрольной работы № 1
- •Варианты контрольной работы № 2
- •III. Приложение
- •IV. Содержание
- •Основные понятия химии и единицы их измерения………..………..6
III. Приложение
Таблица 1. Термодинамические константы некоторых веществ
|
Вещество |
|
|
|
|
Al (к) |
0 |
0 |
28,31 |
|
Al2O3 (к) |
– 1675,0 |
– 1576,4 |
50,94 |
|
BaCO3 (к) |
– 1202,0 |
– 1138,8 |
112,1 |
|
BeCO3 (к) |
– 981,57 |
– 944,75 |
199,4 |
|
C (алмаз) |
1,897 |
2,866 |
2,38 |
|
С (графит) |
0 |
0 |
5,74 |
|
CO (г) |
– 110,5 |
– 137,27 |
197,4 |
|
CO2 (г) |
– 393,51 |
– 394,38 |
213,6 |
|
COCl2 (г) |
– 223,0 |
–210,5 |
289,2 |
|
CS2 (г) |
– 115,3 |
65,1 |
237,8 |
|
CS2 (ж) |
– 87,8 |
63,6 |
151,0 |
|
C2H2 (г) |
226,75 |
209,2 |
200,8 |
|
C2H4 (г) |
52,28 |
68,12 |
219,4 |
|
CH4 (г) |
– 74,85 |
– 50,79 |
186,19 |
|
C2H6 (г) |
– 84,67 |
– 32,89 |
229,5 |
|
C6H6 (ж) |
49,04 |
124,50 |
173,2 |
|
CH3 OH (ж) |
– 238,7 |
– 166,31 |
126,7 |
|
C2H5 OH (ж) |
– 227,6 |
– 174,77 |
160,7 |
|
Ca (к) |
0 |
0 |
41,62 |
|
CaО (к) |
– 635,1 |
– 604,2 |
39,7 |
|
Ca(OH)2 (к) |
– 986,2 |
– 896,76 |
83,4 |
|
CaCО3 (к) |
– 1206,0 |
– 1128,8 |
92,9 |
|
Cl2 (г) |
0 |
0 |
223,0 |
|
HCl (г) |
– 92,30 |
– 95,27 |
186,7 |
|
HCl (ж) |
– 167,5 |
– 131,2 |
55,2 |
|
Cu (к) |
0 |
0 |
33,3 |
|
Cu2O (к) |
– 167,36 |
– 146,36 |
93,93 |
|
CuO (к) |
– 165,3 |
– 127,19 |
42,64 |
|
Cu2S (к) |
– 82,01 |
– 86,19 |
119,24 |
|
Fe (к) |
0 |
0 |
27,15 |
|
FeO (к) |
– 263,68 |
– 244,35 |
58,79 |
|
FeCl2 (к) |
– 341,0 |
– 302,08 |
119,66 |
|
Fe2O3 (к) |
– 821,32 |
740,99 |
89,96 |
|
Fe3O4 (к) |
– 1117,1 |
– 1015,5 |
146,2 |
|
Ge (к) |
0 |
0 |
31,09 |
|
GeO (к) |
– 305,4 |
– 276,1 |
50,2 |
|
GeO2 (к) |
– 539,74 |
– 531,4 |
52,30 |
|
H2 (г) |
0 |
0 |
130,6 |
|
H2O (г) |
– 241,84 |
– 228,8 |
188,74 |
|
H2O (ж) |
285,84 |
– 237,5 |
69,96 |
|
N2 (г) |
0 |
0 |
191,5 |
|
N2 О (г) |
81,55 |
103,6 |
220,0 |
|
NО (г) |
90,37 |
86,69 |
210,62 |
|
NО2 (г) |
33,89 |
51,84 |
240,45 |
|
NН3 (г) |
– 46,19 |
– 16,64 |
192,5 |
|
NН4Cl (к) |
– 315,39 |
– 343,64 |
94,56 |
|
NН4OH (ж) |
– 366,69 |
– 263,8 |
179,9 |
|
NaOH (к) |
– 426,6 |
– 377,0 |
64,18 |
|
NaCl (к) |
– 410,9 |
– 384,0 |
72,36 |
|
O2 (г) |
0 |
0 |
205,03 |
|
Pb (к) |
0 |
0 |
64,9 |
|
PbO (к) |
– 217,86 |
– 188,49 |
67,4 |
|
PbO2 (к) |
– 276,6 |
– 218,99 |
76,44 |
|
SO2 (г) |
– 296,9 |
– 300,37 |
248,1 |
|
H2S (г) |
– 20,15 |
– 33,02 |
205,64 |
|
H2S (ж) |
– 39,33 |
– 27,36 |
122,2 |
|
Sn (к) |
0 |
0 |
51,55 |
|
SnO (к) |
– 286,0 |
– 257,32 |
56,74 |
|
SnO2 (к) |
– 580,8 |
– 519,65 |
52,34 |
|
Ti (к) |
0 |
0 |
30,6 |
|
TiO2 (к) |
– 938,6 |
– 852,2 |
49,92 |
Таблица 2. Константы диссоциации некоторых слабых электролитов
в
водных растворах,
![]()
|
Электролит |
Кд |
| |
|
HNO2
|
|
4.0·10 – 4 |
3.40 |
|
NH4OH
|
|
1.8·10 – 5 |
4.75 |
|
H2SiO3 |
K1
|
2.2·10 – 10 |
9.66 |
|
K2
|
1.6·10 – 12 |
11.80 | |
|
H2SO4 |
K2
|
1.2·10 – 2 |
1.92 |
|
H2SO3 |
K1
|
1.6·10 – 2 |
1.80 |
|
K2
|
6.3·10 – 8 |
7.21 | |
|
H2S |
K1
|
6.0·10 – 8 |
7.22 |
|
K2
|
1.0·10 – 14 |
14.0 | |
|
H2CO3 |
K1
|
4.5·10 – 7 |
6.35 |
|
K2
|
4.7·10 – 11 |
10.33 | |
|
CH3COOH |
|
1.8·10 – 5 |
4.75 |
|
H3PO4 |
K1
|
7.5·10 – 3 |
2.12 |
|
K2
|
6.3·10 – 8 |
7.20 | |
|
K3
|
1.3·10 – 12 |
11.89 | |
|
HF |
|
6.6·10 – 4 |
3.18 |
|
HCN |
|
7.9·10 – 10 |
9.10 |
Таблица 3. Степень диссоциации кислот, щелочей и солей
в
водных растворах,
![]() .
.
-
Электролит и его ионы
α %
1Н
0,1Н
Кислоты

78
91

82
92

51
58

-
0,07
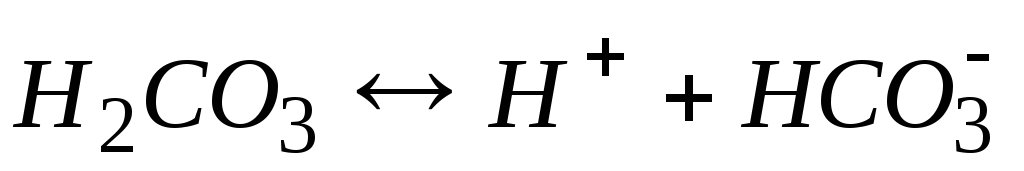
-
0,17

0,4
1,3

6
26

-
20

-
0,01
Основания

73
84

77
89

-
77

0,4
1,3
Соли

67
84

64
83

53
71

25
38
Таблица
4. Стандартные
восстановительные потенциалы,![]() при
при![]() .
.
-
Процесс
 ,
В
,
В1

+2,87
2
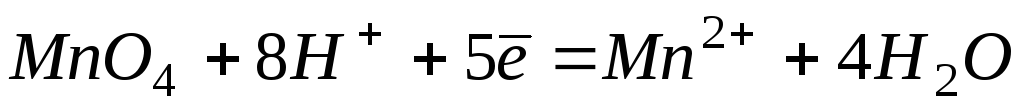
+1,51
3

+1,50
4

+1,36
5

+1,33
6

+1,23
7

+1,23
8

+1,07
9

+0,96
10

+0,87
11

+0,815
12

+0,80
13

+0,77
14

+0,63
15

+0,60
16

+0,56
17

+0,54
18

+0,36
19

+0,31
20

+0,26
21

+0,17
22
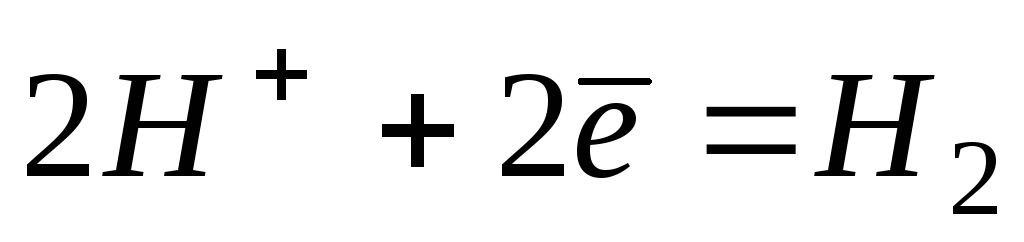
0,000
23
 (pH=9)
(pH=9)-0,413 (-0,53)
24
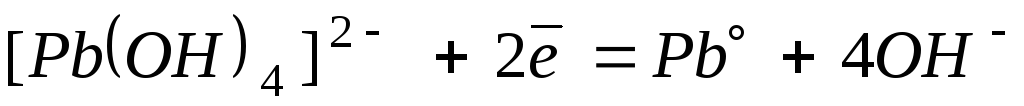
-0,54
25

-0,83
26

-0,86
27

-0,91
28

-1,22
29

-2,35
30

-2,55
Таблица 4. Ряд напряжений металлов.
Нормальные (стандартные) электродные потенциалы, Е°(В) при 25°С.
-
Электрод
Электродный процесс
Е°

← окислительная активность иона возрастает ←

→ восстановительная активность атома возрастает →
-3,02


-2,84

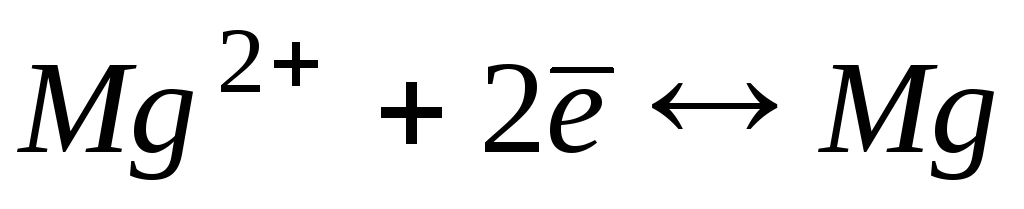
-2,38


-1,66


-1,05


-0,76


-0,74


-0,44


-0,40
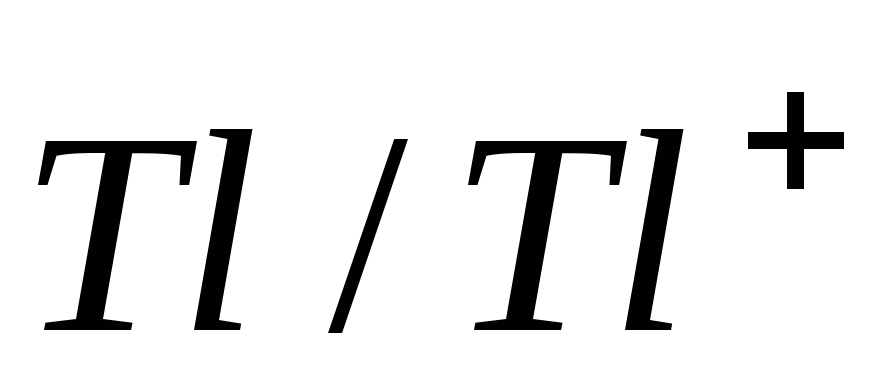

-0,33


-0,27

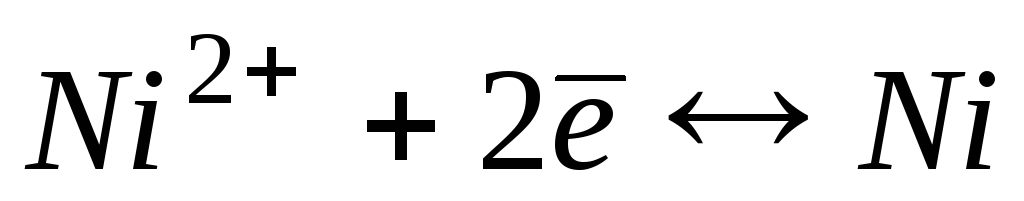
-0,23

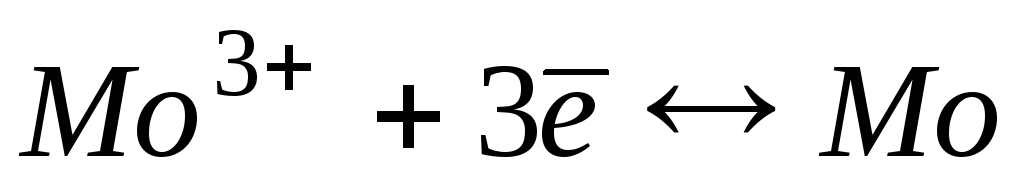
-0,20


-0,14


-0,13


-0,05


±0,00


+0,20


+0,23


+0,34


+0,80


+0,85


+1,50
Таблица 5. Константы устойчивости некоторых комплексов
-
Аммиакаты и др.
Гидроксокомплексы
Комплекс
lgβn
Комплекс
lgβn
Ag(NH3)2 +
7,24
Al(OH)4–
33,00
Cd(NH3)4 2+
6,56
Be(OH)3–
15,00
Cd(NH3)6 2+
5,13
Cr(OH)4–
30,00
Co(NH3)6 2+
5,13
Cu(OH)4–
18,50
Co(NH3)6 3+
32,51
Fe(OH)4–
38,00
Cu(NH3)4 2+
12,67
Sn(OH)4–
25,13
Fe(NH3)2 2+
2,20
Zn(OH)4–
14,66
Ni(NH3)4 2+
7,95
Цианиды
Ni(NH3)6 2+
8,73
Ag(CN)2–
21,00
Zn(NH3)6 2+
9,46
Co(CN)64–
19,00
Cu(NH3)2+
10,87
Co(CN)63–
64,00
HI4 2–
30,20
Cu(CN)62–
30,30
Fe(SCN)6 3–
25,00
Fe(CN)64–
35,00
Ag(S2O3)3 5–
13,50
Fe(CN)63–
42,00
Таблица 6. Растворимость солей, кислот и оснований в воде
|
Анионы |
H+ |
|
K+ |
Na+ |
Ag+ |
Hg+ |
Hg2+ |
Ba2+ |
Ca2+ |
Mg2+ |
Zn2+ |
Mn2+ |
Sn2+ |
Pb2+ |
Cu2+ |
Fe2+ |
Al3+ |
Cr3+ |
Bi3+ |
|
OH- |
|
Р |
Р |
Р |
- |
- |
- |
Р |
М |
М |
Н |
Н |
Н |
М |
Н |
Н |
Н |
Н |
Н |
|
|
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
- |
Р |
Р |
Р |
Р |
Р |
Р |
|
F- |
Р |
Р |
Р |
Р |
Р |
Н |
М |
М |
Н |
Н |
М |
М |
Р |
Н |
Н |
М |
Р |
Р |
Н |
|
Cl- |
Р |
Р |
Р |
Р |
Н |
Н |
Р |
Р |
Р |
Р |
Р |
Р |
- |
М |
Р |
Р |
Р |
Р |
- |
|
Br- |
Р |
Р |
Р |
Р |
Н |
Н |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
М |
Р |
Р |
Р |
Р |
- |
|
I- |
Р |
Р |
Р |
Р |
Н |
Н |
Н |
Р |
Р |
Р |
Р |
Р |
М |
Н |
- |
Р |
Р |
Р |
- |
|
S2- |
Р |
Р |
Р |
Р |
Н |
Н |
Н |
Р |
М |
Р |
Н |
Н |
Н |
Н |
Н |
Н |
- |
- |
Н |
|
|
Р |
Р |
Р |
Р |
Н |
Н |
Н |
М |
М |
Н |
М |
Н |
- |
Н |
Н |
М |
- |
- |
Н |
|
|
Р |
Р |
Р |
Р |
М |
М |
Р |
Н |
М |
Р |
Р |
Р |
Р |
М |
Р |
Р |
Р |
Р |
Р |
|
|
Р |
Р |
Р |
Р |
Н |
Н |
Н |
Н |
М |
М |
Н |
Н |
- |
Н |
Н |
Н |
- |
- |
Н |
|
|
Н |
- |
Р |
Р |
Н |
- |
- |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
- |
Н |
- |
- |
- |
|
|
Р |
Р |
Р |
Р |
Н |
Н |
Н |
Н |
Н |
М |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
|
|
Р |
Р |
Р |
Р |
Р |
М |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
|
|
Р |
Р |
Р |
Р |
Р |
М |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
М |
Р |
Р |
|
|
Н |
Р |
Р |
Р |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
Р- растворимые М - малорастворимые Н - нерастворимые
(больше 1 г в 100 г воды) (от 0,001 до 1г в 100 г воды) (меньше 0,001 г в 100 г воды

 Катионы
Катионы