
- •1. Основные термодинамические понятия (система, фаза, параметр, состояние, процесс, энергия, теплота, работа, внутренняя энергия).
- •2. I закон термодинамики, его формулировки, выражение в интегральной и дифференциальной форме.
- •3. Закон Гесса. Термохимические уравнения и их особенности. I и II следствия из закона Гесса. Стандартная энтальпия образования и энтальпия сгорания.
- •4. II закон термодинамики, его формулировки и математическая форма записи.
- •5. Расчет изменения энтропии для химической реакции и использование этой величины для определения направленности процессов в изолированных системах.
- •6. Термодинамические функции Гиббса и Гельмгольца. Способы расчета d°g и использование этой функции для определения направленности процессов в открытых системах.
- •7. Химическое равновесие. Основные его признаки. Смещение химического равновесия по принципу Ле Шателье.
- •Принцип Ле-Шателье
- •8. Химическая кинетика. Скорость химической реакции и факторы, от которых она зависит.
- •10. Влияние температуры на скорость реакции. Правило Вант-Гоффа. Уравнение Аррениуса. Энергия активации.
- •11. Влияние катализатора на скорость реакции. Гомогенный, гетерогенный и ферментативный катализ.
- •12. Электропроводность растворов. Удельная электропроводность и факторы, от которых она зависит.
- •13. Молярная электропроводность, зависимость ее от концентрации.
- •14. Подвижность ионов. Закон Кольрауша. Расчет степени и константы диссоциации.
- •15. Электродный потенциал. Формула Нернста.
- •16. Гальванические элементы: химические, концентрационные. Расчет эдс.
- •17. Электроды сравнения (водородный, хлорсеребряный, каломельный).
- •18. Индикаторные электроды (водородный, хингидронный, стеклянный).
- •19. Адсорбция на границе раздела: твердое тело газ (жидкость). Уравнение и теория Ленгмюра. Уравнение Фрейндлиха.
- •20. Адсорбция на границе раздела жидкость газ, жидкость жидкость. Уравнение Гиббса, его анализ.
- •21. Классификация дисперсных систем.
- •22. Методы получения коллоидных растворов. Методы их очистки (диализ, электродиализ). Искусственная почка.
- •24.Устойчивость коллоидных систем: кинетическая и агрегативная. Коагуляция и факторы ее вызывающие. Правило Шульце-Гарди. Коллоидная защита.
- •25. Коллигативные свойства растворов:
13. Молярная электропроводность, зависимость ее от концентрации.
Молярная электропроводность (λ, «ламбда»), т. е. электропроводность раствора, содержащего 1 моль электролита, помещенного между параллельными электродами, расположенными на расстоянии 1 м.
Молярная электропроводность связана с удельной электропроводностью следующим соотношением:
![]() ,
[Ом-1м2моль-1]
,
[Ом-1м2моль-1]
где с – молярная концентрация раствора.
Молярная
электропроводность электролитов
увеличивается с уменьшением концентрации
(т.е. увеличением разведения раствора
V = 1/С), достигая некоторого максимального
значения
![]() ,
называемого молярной электропроводностью
при бесконечном разведении.
,
называемого молярной электропроводностью
при бесконечном разведении.
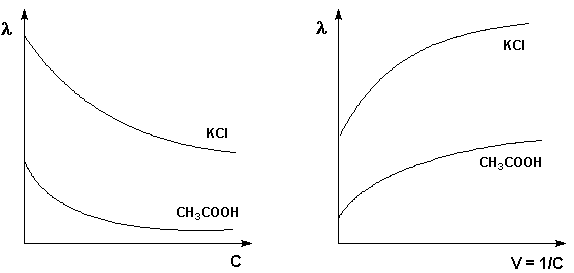
Рис.Зависимость молярнойРис. Зависимость молярной электропроводности от концентрации. электропроводности от разведения
Для слабого
электролита уменьшение молярной
электропроводности с увеличением
концентрации объясняется увеличением
степени диссоциации (![]() )
с разбавлением раствора. Для сильного
электролита с уменьшением концентрации
ослабляется взаимодействие ионов между
собой, что увеличивает скорость их
движения и, следовательно, молярную
электропроводность раствора.
)
с разбавлением раствора. Для сильного
электролита с уменьшением концентрации
ослабляется взаимодействие ионов между
собой, что увеличивает скорость их
движения и, следовательно, молярную
электропроводность раствора.
14. Подвижность ионов. Закон Кольрауша. Расчет степени и константы диссоциации.
Молярная электропроводность связана с абсолютными скоростями движения катионов и анионов U+и U–:
![]()
Закон Ф. Кольрауша:
Молярная
электропроводность бесконечно
разбавленных растворов электролитов
![]() является суммой подвижностей катиона
и аниона
является суммой подвижностей катиона
и аниона![]() и
и![]() данного
электролита:
данного
электролита:
![]()
Отсюда
![]() ,
,
![]() .
.
Электролитическая подвижность является важнейшей характеристикой иона, отражающей его участие в электропроводности раствора.
Полноту диссоциации электролита можно оценить по степени диссоциации α,
![]() .
.
Величина степени диссоциации зависит от природы растворителя и растворенного вещества, концентрации раствора и температуры. По величине степени диссоциации электролиты подразделяются на три группы: сильные (α≥ 0.7), средней силы (0.3 <α< 0.7) и слабые (α≤ 0.3). К сильным электролитам относятся почти все соли, большинство неорганических кислот и щелочей; к слабым – все органические кислоты, вода, NН4ОН, Н2S и т.д. Электролитами средней силы являются некоторые неорганические кислоты: НF, НСN, Н3PO4.
Количественной характеристикой силы электролита является константа диссоциации К. Для реакции
АВ = А++ В-,
константа диссоциации равна
![]() ,
или
,
или
![]() ,
,
где с – концентрация электролита.
15. Электродный потенциал. Формула Нернста.
При соприкосновении металлической пластинки с полярным растворителем (водой) либо раствором электролита на границе электрод – жидкость возникает двойной электрический слой (ДЭС) и возникает скачок потенциала, называемый электродным потенциалом.
Величина электродного потенциала металлического электрода зависит от температуры и активности (концентрации) иона металла в растворе, в который опущен электрод. Математически эта зависимость выражается уравнением Нернста
![]() ,
,
где z – заряд иона,
![]() –стандартный электродный
потенциал, равный потенциалу
электрода при активности иона металла,
равной 1 моль/л.
–стандартный электродный
потенциал, равный потенциалу
электрода при активности иона металла,
равной 1 моль/л.
