
- •Глава 11. Основы электрохимии и коррозии металлов..
- •11.1. Электродные потенциалы металлов
- •И эдс гальванических элементов.
- •Электродного потенциала меди:
- •Коррозия металлов.
- •Классификация коррозионных процессов.
- •Химическая коррозия металлов.
- •11.2.3. Электрохимическая коррозия.
- •11.2.3. Причины электрохимической гетерогенности поверхности металлов.
- •11.2.4. Электродные процессы при коррозии металлов.
- •11.2.5. Роль поляризации и деполяризации при коррозии металлов.
- •11.2.5. Влияние внутренних и внешних факторов на скорость коррозии
- •Защита металлов от коррозии.
- •11.1. Вопросы для самоконтроля
- •11.2. Вопросы и упражнения для самостоятельного решения.
- •Глава 12 Электролиз
- •3 2 4 3 1 Катод Анод
- •Процессы восстановления на катоде.
- •Процессы окисления на аноде
- •Рассмотрим несколько примеров процессов электролиза
- •Количественные соотношения при электролизе
- •Практическое применение электролиза
- •12.1. Вопросы для самоконтроля
- •12.2. Примеры решения типовых задач по теме
- •12.2. Задачи и упражнения
11.2.3. Причины электрохимической гетерогенности поверхности металлов.
В силу неоднородности реальных металлических материалов или состава контактирующих с ними электролитов, на металлах возникают участки, характеризующиеся различной величиной электродного потенциала. Участки, характеризующиеся более отрицательным значением потенциала, будут являться анодами, а более положительным - катодами возникающего при этом гальванического элемента.
Основными причинами, вызывающими электрохимическую гетерогенность (неоднородность) поверхности металла могут быть:
Сочетание в конструкции разных металлов с различными величинами электродных потенциалов. Металл с меньшей величиной потенциала выполняет функции анода, возникающего при этом макрогальванического элемента.
Наличие в металле неметаллических примесей и включений, выполняющих функцию катодов возникающего при этом микрогальванического элемента.
Различие химического состава электролита у отдельных участков поверхности металлической конструкции. При этом возникает и функционирует концентрационный гальванический элемент.
Различный доступ окислителя к поверхности металла. Участки, к которым доступ окислителя, например, кислорода затруднен являются анодами возникающего при этом гальванического элемента. Такой элемент носит название элемента дифференциальной аэрации.
Резкие перепады температуры в пределах металлической конструкции. Более нагретые участки обычно являются анодами возникающего в этом случае термогальванического элемента.
Наличие на поверхности металла участков с нарушенной окисной пленкой, обнаженный участок при этом является анодом.
Наличие на поверхности металлов местных деформированных участков, окалины, биоотложений, слоев сульфидов и др.
Неравномерное наложение внешнего электрического поля (электрокоррозия, коррозия под действием блуждающих токов)
11.2.4. Электродные процессы при коррозии металлов.
При коррозионном разрушении металла по электрохимическому механизму в коррозионном гальваническом элементе имеет место протекание двух пространственно разделенных, но взаимосвязанных процессов, схема которых представлена на рис. 11.4.
Анодный процесс окисления металла, который собственно и вызывает его разрушение, обусловлен переходом металла в раствор при его ионизации:
анодный процесс при коррозии металлов -
![]()
Избыток электронов с анода перетекает на катод, где связывается соответствующими окислителями, в качестве которых чаще всего выступают ионы водорода или растворенный в электролите кислород.
Если электроны, образующиеся на аноде, связываются на катоде ионами водорода, то говорят о протекании коррозионного процесса с водородной деполяризацией.Такие процессы обычно имеют место при коррозии в кислых средах:
катодный процесс ( водородная деполяризация) -
2Н+ + 2е- Н20
Если электроны, образующиеся на аноде, связываются на катоде растворенными в электролите молекулами кислорода, то говорят о протекании коррозионного процесса с кислородной деполяризацией.
Катодный процесс (кислородная деполяризация) в зависимости от реакции среды может быть представлен следующими схемами:
а) в нейтральных или щелочных средах -
2Н2О + О2 + 4е- 4ОН-
б) в кислых средах -
О20 + 4Н+ 2Н2О
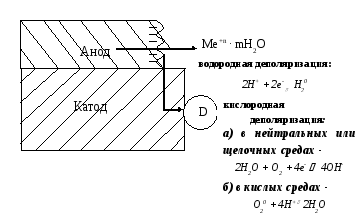
Рис. 2. Схема электродных процессов,
протекающих при электрохимической коррозии.
Для эффективной работы коррозионного гальванического элемента, как минимум, необходимо удаление ионов металла из анодного приэлектродного пространства и связывание на катоде образующихся при анодном растворении металла электронов.
Любой фактор, вызывающий затруднение протекания катодного или анодного процесса, приводит к поляризации электродов гальванического элемента. При этом потенциал анода становится менее отрицательным, потенциал катода менее положительным, т.е. потенциалы анодных и катодных участков выравниваются, а Э.Д.С. гальванического элемента уменьшается.
