
- •8.5.2 Соединения ароматического ряда
- •8.5.2.1 Моноароматические соединения
- •1. Дегидроциклизация и дегидрогенизация парафинов:
- •2. Дегидрогенизация циклоалканов:
- •1.2 Алкилирование:
- •8.5.2.2 Полициклические арены с изолированными кольцами
- •2. Реакция Вюрца:
- •3. Димеризация бензола в присутствии солей Pd:
- •1.2 Реакция с амидом натрия:
- •1.3 Взаимодействие с щелочными металлами:
- •8.5.2.3 Полициклические арены с конденсиро-ванными кольцами
- •2. Циклизация ацетилена и бензола:
- •3. Дегидроциклизация алканов:
- •1.4 Окисление:
- •1.5 Гидрирование:
- •9. Реакционные центры и основные механизмы реакций углеводородов
- •1. Генерирование электрофильной частицы
- •3. Стабилизация карбкатиона
- •9.1 Особенности протекания некоторых реакций
- •2. Региоселективность реакций присоединения к несимметричным алкенам и алкинам реагентов типа н–х
- •Современная электронная интерпретация правила Марковникова.
- •4. Стереоспецифичность реакции гидроксилирования алкенов (реакция Вагнера)
- •5. Химические особенности сопряженных диенов
- •6. Влияние заместителей на реакционную способность и ориентацию в реакциях электрофильного замещения в бензольном кольце
- •Резонансные структуры карбкатиона (3)
- •Примеры
- •9.2 Оптическая спектроскопия
- •Уф – спектр ик – спектр
- •3. Ионизация
- •4. Природа растворителя
- •Примеры
- •Конспект лекций гомофункциональные углеводороды
- •Галогенопроизводные углеводородов
- •1.1 Галогенпроизводные алифатического ряда
- •1. Реакции замещения.
- •3.2.1 Реакции магнийорганических соединений
- •3.2.1.1 Взаимодействие с соединениями, имеющими подвижный атом водорода:
- •1.1. Получение алифатических аминов
- •6. Специальные методы
- •3. Взаимодействие аминов с азотистой кислотой
- •6.1.1 Реакция окисления первичных аминов:
- •6.1.2 Реакция окисления первичного ариламина гидропероксидом трифторацетила:
- •6.2 Реакция окисления вторичных аминов:
- •6.3.2 Ацилирование третичных аминов:
- •7. Реакции с электрофильными реагентами ароматических аминов
- •8. Реакции конденсации
- •8.3 Реакции конденсации третичных аминов:
- •2. Реакции ароматических солей диазония без выделения азота
- •3. Реакции диазоалканов
- •1. Желтого типа:
- •2. Сине-зеленого типа:
- •3. Фуксиново-красного типа:
2. Циклизация ацетилена и бензола:
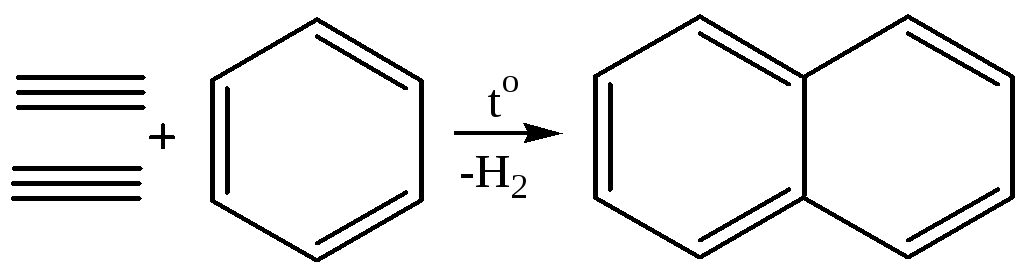
3. Дегидроциклизация алканов:
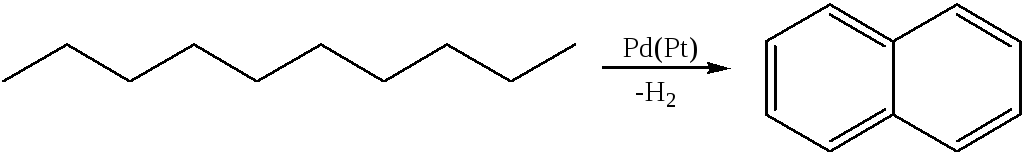
Химические свойства. По химическим свойствам нафталин является ароматическим соединением и напоминает бензол. Однако он проявляет более ненасыщенный характер и легче чем бензол вступает в реакции присоединения.
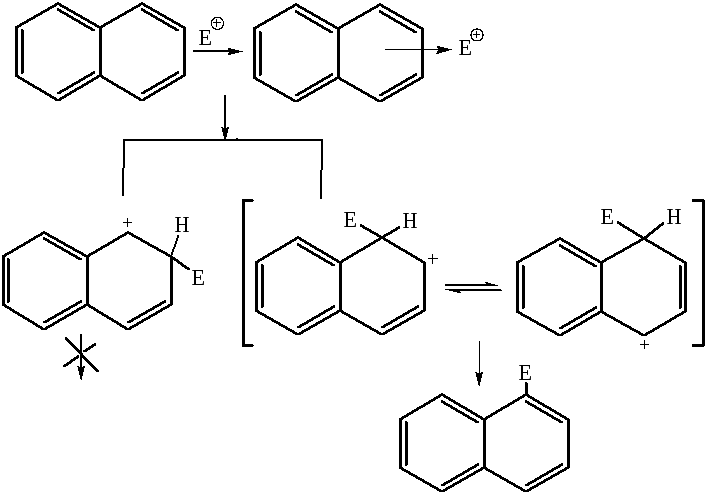
1. Реакции замещения. Реакции протекают по механизму SE2. π-Электронное облако является источником электронов, доступных для электрофильного реагента, который атакует кольцо и с очень большой скоростью образует π-комплекс. Следующей (лимитирующей) стадией является формирование σ-комплекса, в котором происходит нарушение ароматичности одного из колец. После отщепления протона от σ-комплекса происходит восстановление ароматичности нафталина. Электрофильный реагент атакует преимущественно α-положение, так как при этом образуется более устойчивый σ-комплекс с эффективной делокализацией положительного заряда (две предельные структуры). Второе кольцо в делокализации заряда не принимает участия, так как это связано с нарушением его ароматичности, что является энергетически невыгодным.
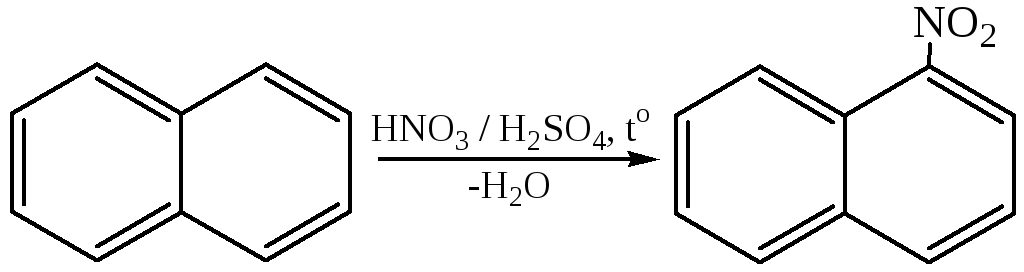
1.1 Нитрование. Реакцию проводят нитрующей смесью при температуре 60°С. Эта реакция протекает легко с образованием α-нитронафталина с небольшой примесью (3-нитронафталина (1,7–5 %):
1.2 Галогенирование.При хлорировании хлор пропускают через расплавленный нафталин при 110–120 °С в присутствии кислот Льюиса:
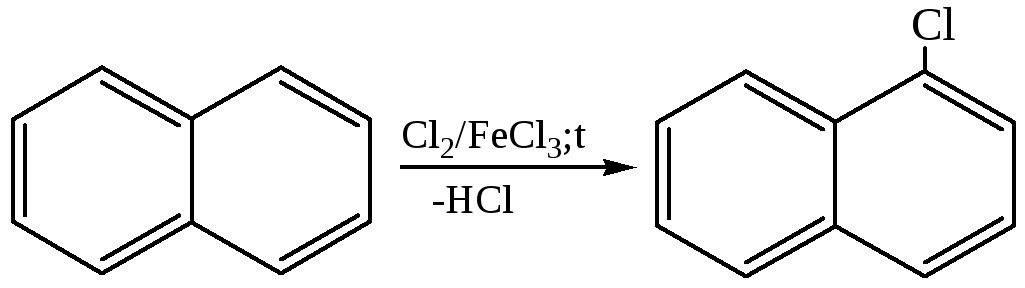
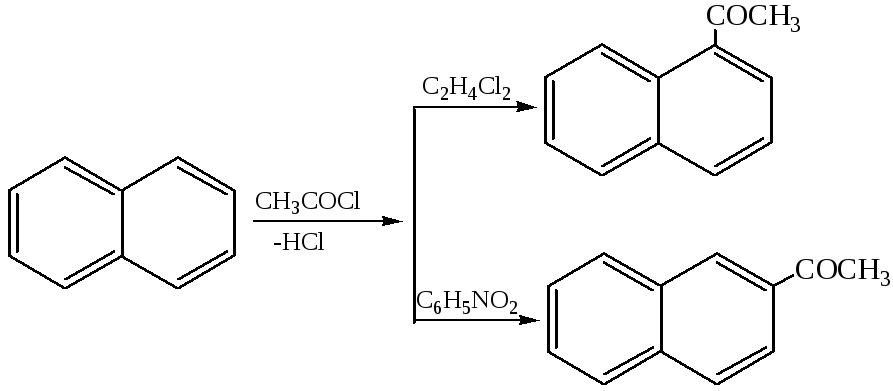
1.3 Реакции Фриделя–Крафтса:
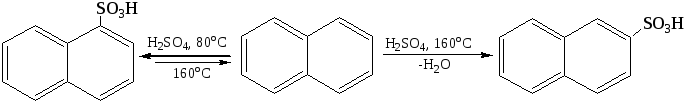
1.4 Сульфирование. В зависимости от температуры образуется α- или β-изомер:
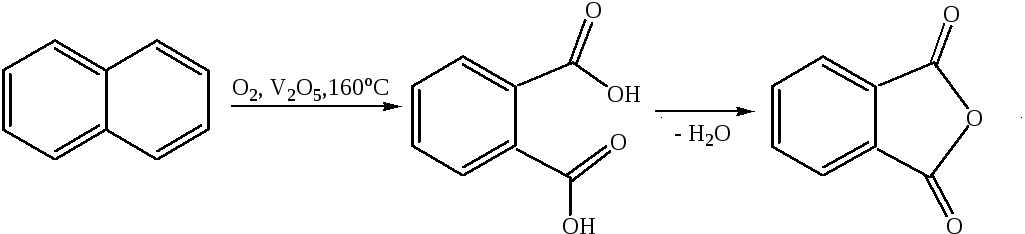
1.4 Окисление:
1.5 Гидрирование:
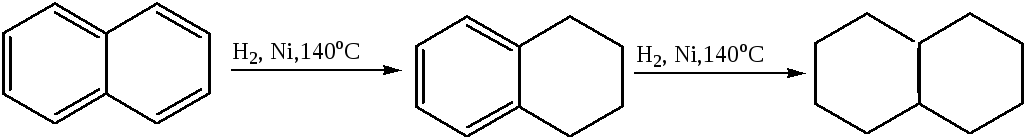
тетралин декалин
Экологические аспекты. Бифенил (дифенил). В окружающую среду он может поступать с промышленных предприятий по производству красителей, синтетических смол, фунгицидов и предприятий по термической обработке полимеров. Бифенил вызывает лейкоцитоз и анемию. Отмечены случаи поражения печени и ЦНС. Воздействуя на мембраны митохондрий, бифенил нарушает энергетический обмен в клетках. В организм он поступает через легкие и с пищей, подвергается метаболизму до гидроксибифенилов, которые образуют конъюгаты с глюкуроновой кислотой и выделяются с желчью.
Нафталин поступает в окружающую среду с коксохимического производства, а также с производств по очистке бензола, синтезу красителей, синтетических смол, изоляционных материалов и пестицидов. Из окружающей среды он удаляется в результате окисления под действием УФ и путем биодеградации под влиянием бактерий. Продуктами окисления являются нафтохинон, бензофуранон, этоксибензофуранон и некоторые другие вещества. Отравление нафталином возможно при вдыхании паров, пыли и при проникновении через кожу, при этом происходит поражение нервной системы, желудочно-кишечного тракта, почек, поверхностное помутнение роговицы. При хронических отравлениях наблюдаются изменения в крови: разрушение эритроцитов и лейкоцитов, снижение содержания гемоглобина. Хронические отравления нафталином приводят к нарушению секреторной деятельности желудочно-кишечного тракта, белковообразо-вательной и антитоксической функции печени.
Нафтолы применяются в производстве инсектицидов, в медицине, в парфюмерной промышленности. В окружающую среду они поступают с выхлопными газами автотранспорта, с предприятий по производству синтетического каучука, красителей, пестицидов и резинотехнических изделий. Есть данные, свидетельствующие о канцерогенных и мутагенных свойствах и эмбриотоксическом действии этих веществ. При отравлении 1-нафтолом возможен летальный исход. При хроническом воздействии наблюдается желтушность кожи, увеличение печени и селезенки.
Антрацен поступает в окружающую среду главным образом при перегонке каменноугольной смолы и окисляется под действием УФ и бактериальной флоры с образованием продуктов окисления, главным из которых является антрахинон. При продолжительном контакте происходит пигментация участков кожи и ее ороговение. Токсическое действие антрацена заметно усиливается на солнечном свету.
Фенантрен попадает в окружающую среду с выбросами коксохимических, алюминиевых, металлургических, нефте- и сланце-перерабатывающих предприятий, а также при работе двигателей внутреннего сгорания, отопительных и энергетических систем.
Бензо[а]пирен кристаллическое вещество бледно-желтого цвета, плохо растворимое в воде. Антропогенными источниками загрязнения окружающей среды могут являться различные промышленные предприятия, теплоэлектростанции, мелкие отопительные системы и автотранспорт. Полициклические ароматические углеводороды и бензопирен образуются при лесных пожарах и в результате вулканической деятельности. В окружающей среде бензопирен подвергается различным воздействиям, которые приводят к потере его канцерогенных свойств.
При попадании в организм полициклические углеводороды под действием ферментов образуют эпоксисоединения, которые реагируют с гуанином, препятствуя синтезу ДНК и вызывая различные нарушения, в том числе и мутации, способствуют развитию раковых заболеваний.
