- •8.5.2 Соединения ароматического ряда
- •8.5.2.1 Моноароматические соединения
- •1. Дегидроциклизация и дегидрогенизация парафинов:
- •2. Дегидрогенизация циклоалканов:
- •1.2 Алкилирование:
- •8.5.2.2 Полициклические арены с изолированными кольцами
- •2. Реакция Вюрца:
- •3. Димеризация бензола в присутствии солей Pd:
- •1.2 Реакция с амидом натрия:
- •1.3 Взаимодействие с щелочными металлами:
- •8.5.2.3 Полициклические арены с конденсиро-ванными кольцами
- •2. Циклизация ацетилена и бензола:
- •3. Дегидроциклизация алканов:
- •1.4 Окисление:
- •1.5 Гидрирование:
- •9. Реакционные центры и основные механизмы реакций углеводородов
- •1. Генерирование электрофильной частицы
- •3. Стабилизация карбкатиона
- •9.1 Особенности протекания некоторых реакций
- •2. Региоселективность реакций присоединения к несимметричным алкенам и алкинам реагентов типа н–х
- •Современная электронная интерпретация правила Марковникова.
- •4. Стереоспецифичность реакции гидроксилирования алкенов (реакция Вагнера)
- •5. Химические особенности сопряженных диенов
- •6. Влияние заместителей на реакционную способность и ориентацию в реакциях электрофильного замещения в бензольном кольце
- •Резонансные структуры карбкатиона (3)
- •Примеры
- •9.2 Оптическая спектроскопия
- •Уф – спектр ик – спектр
- •3. Ионизация
- •4. Природа растворителя
- •Примеры
- •Конспект лекций гомофункциональные углеводороды
- •Галогенопроизводные углеводородов
- •1.1 Галогенпроизводные алифатического ряда
- •1. Реакции замещения.
- •3.2.1 Реакции магнийорганических соединений
- •3.2.1.1 Взаимодействие с соединениями, имеющими подвижный атом водорода:
- •1.1. Получение алифатических аминов
- •6. Специальные методы
- •3. Взаимодействие аминов с азотистой кислотой
- •6.1.1 Реакция окисления первичных аминов:
- •6.1.2 Реакция окисления первичного ариламина гидропероксидом трифторацетила:
- •6.2 Реакция окисления вторичных аминов:
- •6.3.2 Ацилирование третичных аминов:
- •7. Реакции с электрофильными реагентами ароматических аминов
- •8. Реакции конденсации
- •8.3 Реакции конденсации третичных аминов:
- •2. Реакции ароматических солей диазония без выделения азота
- •3. Реакции диазоалканов
- •1. Желтого типа:
- •2. Сине-зеленого типа:
- •3. Фуксиново-красного типа:
3.2.1 Реакции магнийорганических соединений
3.2.1.1 Взаимодействие с соединениями, имеющими подвижный атом водорода:
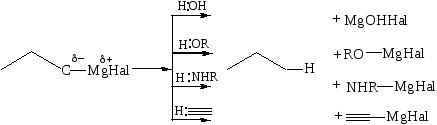
Если в реакции используют CH3MgI, образуется метан. Измеряя объем выделившегося метана, можно количественно определить соединения с активным водородом (спирты, амины, карбоновые кислоты и др.) – метод Чугаева–Церевитинова–Тереньтьева.
3.2.1.2 Окисление реактивов Гриньяра. При взаимодействии реактивов Гриньяра с кислородом образуются спирты:
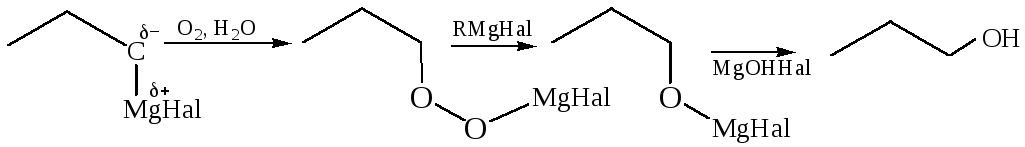
Окисление магнийорганических соединений молекулярным кислородом при низких температурах дает возможность получить гидропероксиды:
![]()
3.2.1.3 Присоединение к полярным кратным связям. Наиболее важны реакции присоединения реактивов Гриньяра к карбонильной группе, учитывая характер полярности реагента и субстрата, очевидно, что во всех этих реакциях Mg перемещается от C к более электроотрицательному O и в продукте присоединения возникает новая С–С связь:
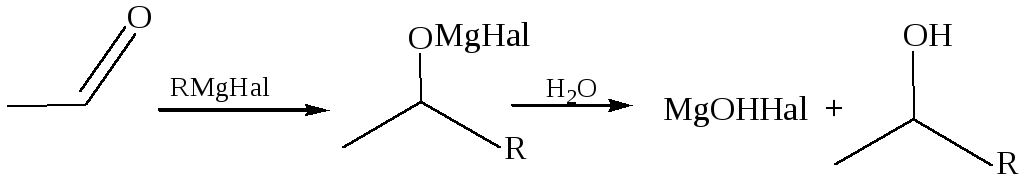
В реакциях образуются смешанные магниевые соли, из которых конечные продукты выделяются путем гидролиза либо в кислой среде, либо насыщенным раствором хлорида аммония. В синтезах Гриньяра с использованием альдегидов, кетонов, сложных эфиров образуются спирты, а при использовании диоксида углерода – карбоновые кислоты.
4. Реакции восстановления осуществляются в присутствии обычных катализаторов гидрирования или нагреванием с HI:
![]()
![]()
Основные представители. Растворители. Относительная химическая инертность полигалогеналканов, гидрофобность, пониженные температуры кипения, легкость регенерации, негорючесть делают их удобными растворителями неполярных и слабополярных веществ – смол, жиров, восков, лаков, каучуков, битумов, серы и др. Широкое применение нашли метиленхлорид, хлороформ, четыреххлористый углерод, 1,2-дихлорэтан, тетрахлорэтилен, трихлорэтилен, хлорбензол. Химическая инертность и низкая токсичность тетрахлорэтилена трихлорэтилена делают их важнейшими растворителями для химической чистки одежды.
Хладоагенты, распылители. В отличие от аммиака, стандартого рабочего тела холодильных и кондиционирующих устройств, фреоны инертны, нетоксичны, не имеют запаха, негорючи, поэтому они нашли широкое применение. Важнейшим фреоном является фреон 12 (дифтордихлорметан), имеющий Ткип. –30 °С.
Антипирены (противопожарные средства). Негорючесть полигалогенуглеводородов используется для защиты от возгорания древесины, тканей, пластмасс и др. Пропитка горючих материалом антипиренами препятствует их возгоранию, которое влечет за собой выделение горючих газов, уменьшение концентрации которых и выделение антипиренами негорючих газов повышают устойчивость материалов к горению. Такими антипиренами могут служить ССl4, полихлоралканы, гексабромбензол и др.
Полупродукты органического синтеза. Самым крупнотоннажным полупродуктом органического синтеза является винилхлорид, который легко полимеризуется с образованием поливинилхлорида (ПВХ), использующися для электроизоляции проводов, кабелей, в производстве листов, труб, пленок, волокон, искусственной кожи, линолеума, ковровых покрытий и т. д. Тетрафторэтилен легко образует политетрафторэтилен (фторопласт-4, тефлон) с температурой эксплуатации от –269 °С до +260 °С. Фторопласт-4 применяют в производстве электроизоляционных пленок и труб, подшипников, уплотнителей, прокладок, поршневых колец, авиационных шлангов, труб, протезов органов человека и т. д. Аллилхлорид применяют для получения глицерина. Хлорбензол – исходное сырье в промышленных методах получения фенола, пикриновой кислоты, лекарственных средств, инсектицидов. Хлористый этил используют для синтеза тетраэтилсвинца – антидетонационной присадки к бензинам.
Спектр физиологической активности галогенуглеводородов чрезвычайно разнообразен, причем выраженная зависимость физиологической активности от строения углеводородного радикала, типа и числа атомов галогена в молекуле не выявлена. Галогенуглеводороды нашли свое применение как анестизирующие, слезоточивые средства, инсектициды, гербициды и т. д.
АМИНЫ
Амины – органические производные аммиака, образующиеся в результате замещения атомов водорода в аммиаке алкильными или арильными группами. Замещенные соли аммония являются производными иона аммония.
Классификация. В зависимости от числа водородных атомов, замещённых в аммиаке на алкильные остатки, различают:
первичные амины R–NH2;
вторичные амины R2–NH;
третичные амины R3–N.
В зависимости от природы углеводородных радикалов различают:
алифатические;
ациклические;
ароматические;
алкилароматические;
гетероциклические.
В зависимости от типа атома углерода, соединенного с аминогруппой, различают:
алкил- и циклоалкиламин C(sp3) – NH2;
енамины и ариламины C(sp2) – NH2;
инамины C(sp) – NH2.
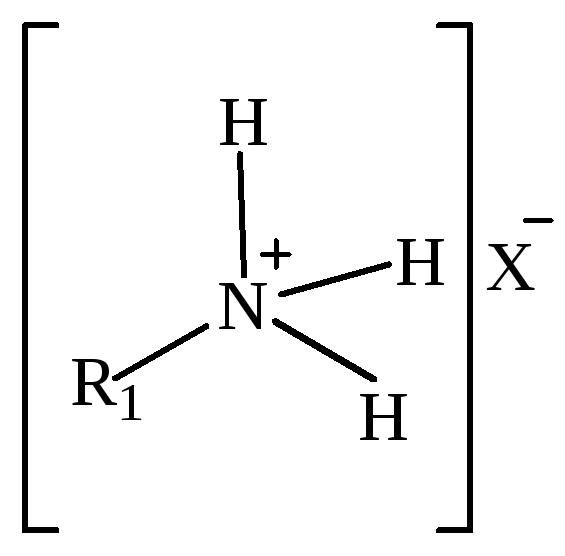
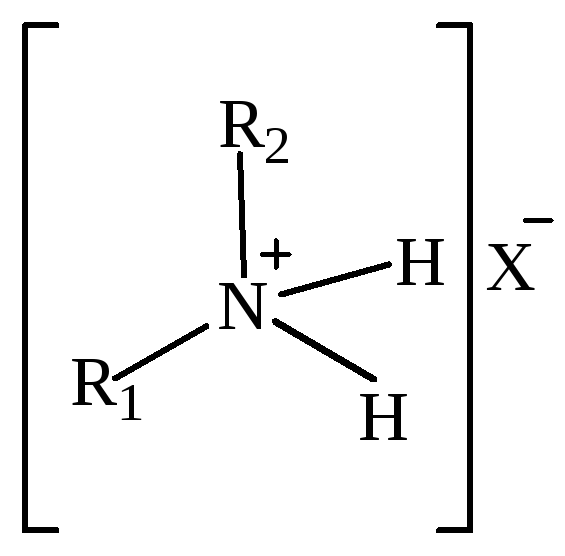
В зависимости от степени замещения соли аммония подразделяют (табл. 3):
монозамещенные;
дизамещенные;
трехзамещенные;
четырехзамещенные.
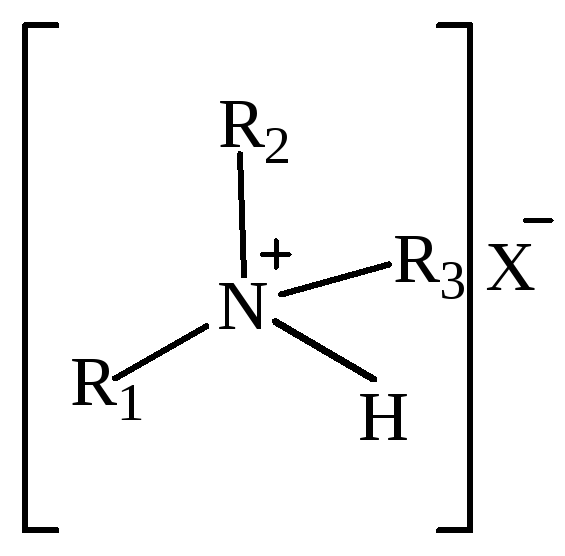
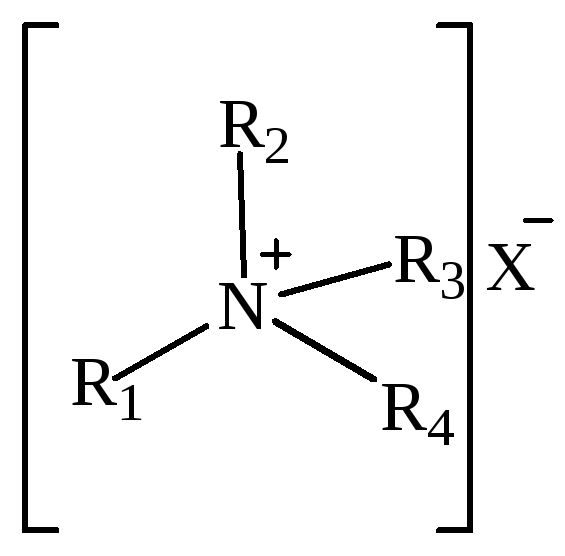
Таблица 3 – Классификация солей аммония в зависимости от степени замещения.
-
Монозамещенные соли аммония
Дизамещенные соли аммония
Трехзамещенные соли аммония
Четырехзамещенные соли аммония
Номенклатура. Для названия аминов используют следующие номенклатуры (табл. 4):
тривиальная;
рациональная;
систематическая.
По систематической номенклатуре названия:
– первичных алифатических и циклических аминов образуются прибавлением окончания -амин к названию алкильных заместителей, связанных с атомом азота. Группы –NH2, –NHR, –NR2 называют амино-, N-алкиламино- и N, N – диалкиламиногруппами соответственно;
– циклические амины называют, используя номенклатуру гетероциклических соединений или добавляя к названию двухвалентного углеводородного остатка суффикс -имин.
Таблица 4 – Примеры названий аминов
|
Соединение |
Тривиальная |
Рациональная |
Систематическая |
|
CH3–NH2 |
– |
метиламин |
аминометан |
|
CH3CH2–NH2 |
– |
этиламин |
аминоэтан |
|
CH3CH2CH2–NH2 |
– |
пропиламин |
1-аминопропан |
|
(CH3)2CH–NH2 |
– |
изопропиламин |
2-аминопропил |
|
(CH3)2NH |
– |
диметиламин |
метиламинометан |
|
(C2H5)2NH |
– |
диэтиламин |
этиламиноэтан |
|
(CH3)3N |
– |
триметиламин |
Диметиламино-метан |
|
(C2H5)3N |
– |
триэтиламин |
диэтиламиноэтан |
|
|
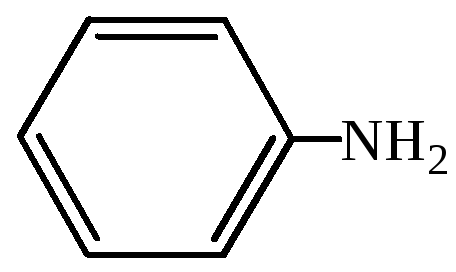
анилин |
фениламин |
аминобензол |
|
|
путресцин |
1,4-бутандиамин |
1,4-диаминобутан |
|
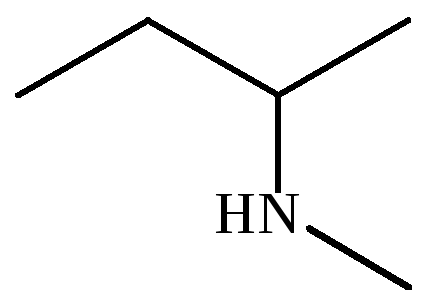
|
– |
– |
N-метил-вторбутиламин |
|
|
кадаверин |
1,5-пентандиамин |
1,5-диаминопентан |
|
|
– |
N,N- диметилбутиламин |
– |
|
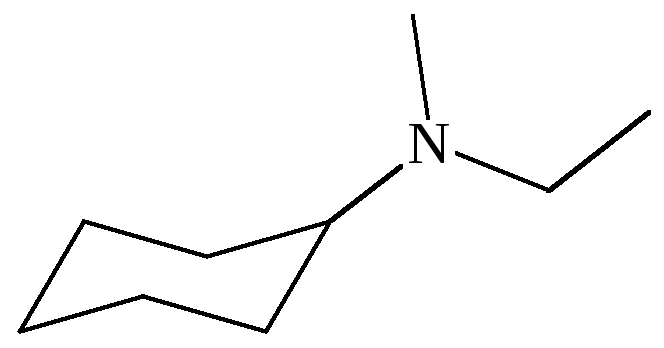
|
– |
N-метил-N-этилциклогексил-амин |
– |
Изомерия. Для аминов характерны следующие виды изомерии:
Структурная:
изомерия углеродного скелета;
изомерия положения функциональной группы;
метамерия.
Пространственная:
оптическая.
Способы получения:
1. Алкилирование аммиака и аминов (Гофман 1850 г)