
- •8.5.2 Соединения ароматического ряда
- •8.5.2.1 Моноароматические соединения
- •1. Дегидроциклизация и дегидрогенизация парафинов:
- •2. Дегидрогенизация циклоалканов:
- •1.2 Алкилирование:
- •8.5.2.2 Полициклические арены с изолированными кольцами
- •2. Реакция Вюрца:
- •3. Димеризация бензола в присутствии солей Pd:
- •1.2 Реакция с амидом натрия:
- •1.3 Взаимодействие с щелочными металлами:
- •8.5.2.3 Полициклические арены с конденсиро-ванными кольцами
- •2. Циклизация ацетилена и бензола:
- •3. Дегидроциклизация алканов:
- •1.4 Окисление:
- •1.5 Гидрирование:
- •9. Реакционные центры и основные механизмы реакций углеводородов
- •1. Генерирование электрофильной частицы
- •3. Стабилизация карбкатиона
- •9.1 Особенности протекания некоторых реакций
- •2. Региоселективность реакций присоединения к несимметричным алкенам и алкинам реагентов типа н–х
- •Современная электронная интерпретация правила Марковникова.
- •4. Стереоспецифичность реакции гидроксилирования алкенов (реакция Вагнера)
- •5. Химические особенности сопряженных диенов
- •6. Влияние заместителей на реакционную способность и ориентацию в реакциях электрофильного замещения в бензольном кольце
- •Резонансные структуры карбкатиона (3)
- •Примеры
- •9.2 Оптическая спектроскопия
- •Уф – спектр ик – спектр
- •3. Ионизация
- •4. Природа растворителя
- •Примеры
- •Конспект лекций гомофункциональные углеводороды
- •Галогенопроизводные углеводородов
- •1.1 Галогенпроизводные алифатического ряда
- •1. Реакции замещения.
- •3.2.1 Реакции магнийорганических соединений
- •3.2.1.1 Взаимодействие с соединениями, имеющими подвижный атом водорода:
- •1.1. Получение алифатических аминов
- •6. Специальные методы
- •3. Взаимодействие аминов с азотистой кислотой
- •6.1.1 Реакция окисления первичных аминов:
- •6.1.2 Реакция окисления первичного ариламина гидропероксидом трифторацетила:
- •6.2 Реакция окисления вторичных аминов:
- •6.3.2 Ацилирование третичных аминов:
- •7. Реакции с электрофильными реагентами ароматических аминов
- •8. Реакции конденсации
- •8.3 Реакции конденсации третичных аминов:
- •2. Реакции ароматических солей диазония без выделения азота
- •3. Реакции диазоалканов
- •1. Желтого типа:
- •2. Сине-зеленого типа:
- •3. Фуксиново-красного типа:
9.2 Оптическая спектроскопия
Оптическая спектроскопия – основана на избирательном поглощении веществом электромагнитного излучения в диапазоне длин волн 10-6 см – 10 см.
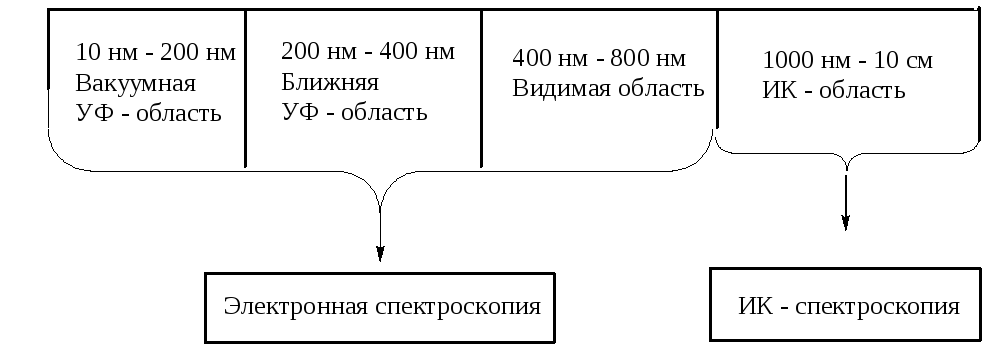
Рисунок 22 – Область электромагнитного спектра, используемая в оптической спектроскопии.
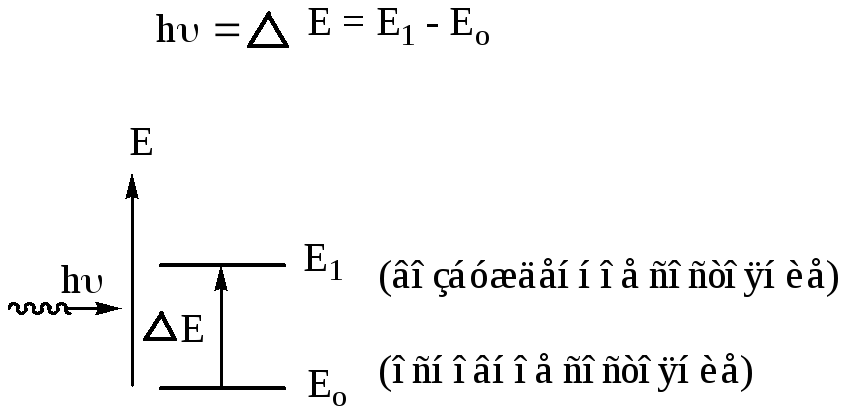
Причина избирательного поглощения. Причина избирательного поглощения веществом определенных лучей заключается в квантованности внутренней энергии молекулы, которая складывается из энергий электронного, колебательного и вращательного состояний.
![]()
При действии на молекулу определенного кванта света электроны или молекулы переходят из основного состояния с низшей энергией Е0 в возбужденное состояние на дозволенный энергетический уровень Е1. Этот переход реализуется только в том случае, если квант поглощенного света hυ соответствует разности энергии возбужденного и основного состояния.
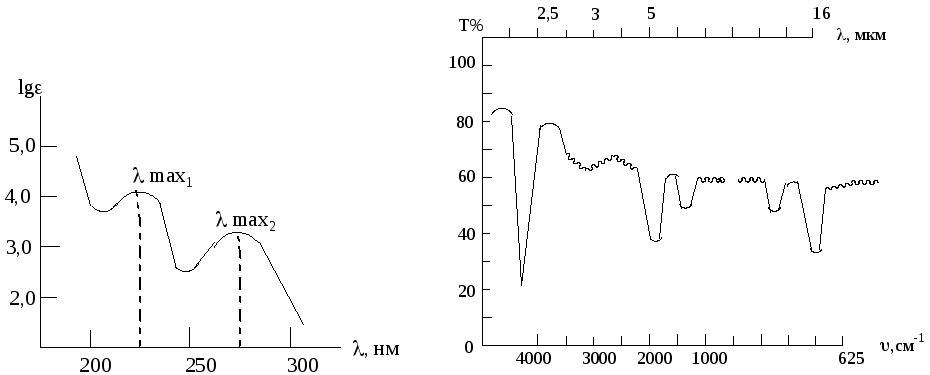
Спектр поглощения (спектральная кривая поглощения) – кривая зависимости интенсивности погашения (А) или пропускания (Т) от длины волны (λ) или волнового числа.
![]()
Для построения адсорбционных кривых на оси абсцисс откладывают длины волн λ или волновые числа ΰ, на оси ординат – фактор интенсивности (в электронной спектроскопии А-погашение, в ИК-спектроскопии Т% - процент пропускания).
Уф – спектр ик – спектр
В оптической спектроскопии применяется закон Бера–Бугера–Ламберта, связывающий величину погашения излучения и количество поглощающего вещества.
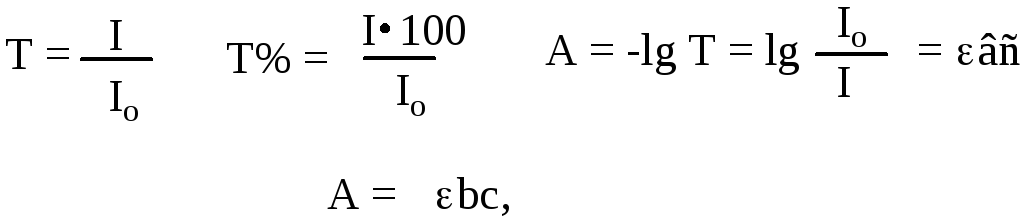
где А – погашение, ε – молярный коэффициент погашения (экстинция), b – длина оптического пути в сантиметрах (толщина кюветы), с – концентрация в моль/л.
Электронная спектроскопия. Поглощение электромагнитного излучения в видимой и УФ- областях связано с переходом электронов связывающих σ- и π-орбиталей, а также n-электронов несвязывающих гибридных и р-орбиталей на соответствующие разрыхляющие орбитали.
ВЗМО – высшая занятая молекулярная орбиталь.
НСМО– низшая свободная молекулярная орбиталь.
Хромофор – структурный фрагмент молекулы, обусловливающий избирательное поглощение света с характеристическими величинами λ и ε.
Ауксохром – заместитель в структуре хромофора, который обеспечивает батохромное смещение и гиперхромный эффект.
Убрать рамки в эл перех
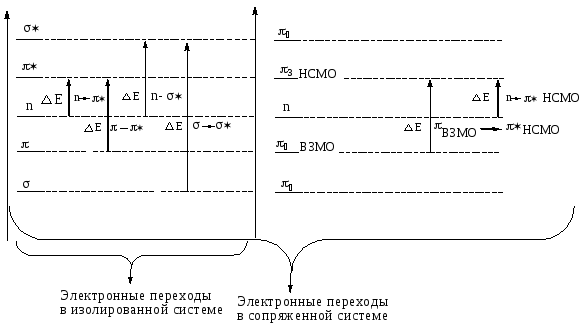
σσ* >ππ* ≥ nσ* >nπ* >πВЗМОπ*НСМО> n π*НСМО
Рисунок 24 –Типы электронных переходов.
Батохромное смещение – смещение полосы поглощения в сторону длинных волн.
Гипсохромное смещение – смещение в сторону коротких волн.
Гиперхромный эффект заместителя – повышение интенсивности полосы поглощения.
Гипохромный эффект – уменьшение интенсивности полосы поглощения.
Факторы, влияющие на положение и интенсивность полос поглощения
1. Сопряжение хромоформных групп (батохромное смещение с гиперхромным эффектом).
2. Наличие ЭД и ЭАзаместителей на концах хромофора, которые усиливают смещение σ-, n- и π-электронов, поляризуют молекулу, увеличивают цепь сопряжения, снижают энергию соответствующих электронных переходов, вызывают батохромный сдвиг с гиперхромным эффектом.
