
- •Эволюция атомизма: от философской концепции к научным моделям
- •Определение атомизма
- •Первые атомисты
- •Различие между натурфилософиями
- •Основные концепции атомизма
- •Атомизм Нового времени
- •Атомистическая теория Дальтона
- •«Новая система химической философии»
- •Первая модель атома
- •Планетарная модель атома Резерфорда
- •Выводы по атомизму
- •Список используемых источников

Эволюция атомизма: от философской концепции к научным моделям
Выполнили: студенты группы 439-4 Соловцов Г.В.
Фомин М.

Определение атомизма
Атомизм, или атомистика —
натурфилософская и физическая теория, согласно которой чувственно воспринимаемые (материальные) вещи состоят из химически неделимых частиц — атомов.
Возникла в древнегреческой философии. Дальнейшее развитие получила в философии и науке Нового времени.
Первые атомисты
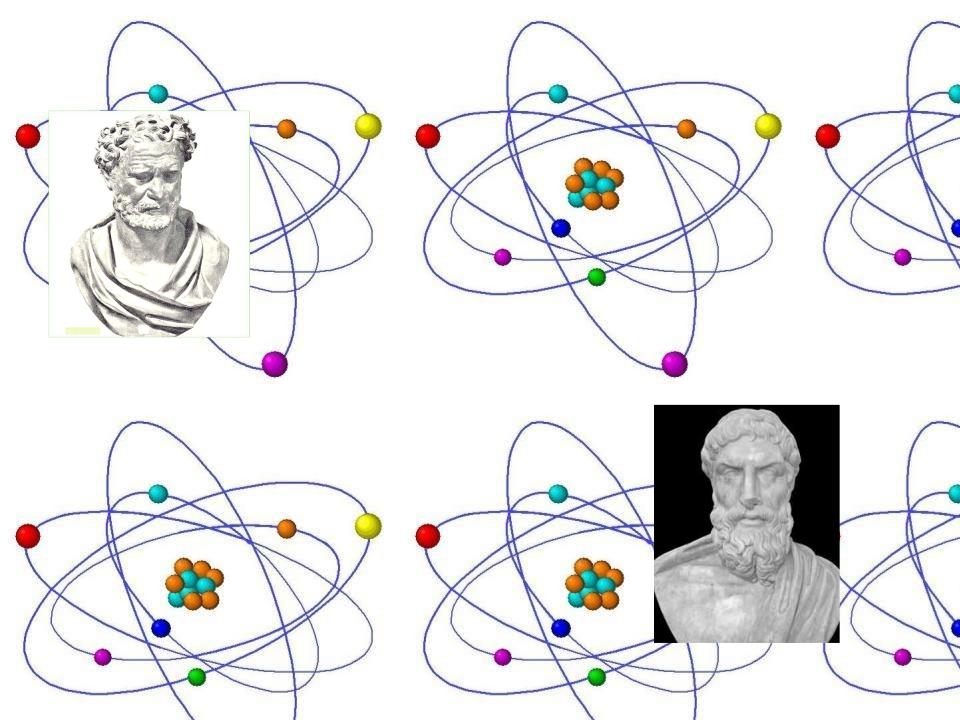
Идея атомистического строения материи появилась благодаря атомистам, Демокриту и Левкиппу. Согласно Демокриту, движение атомов не является случайным, оно причинно обусловлено (детерминизм).
Демокрит (ок. 460 до н. э. - ок. 370 до н. э.) —
древнегреческий философ
Индетерминистское понимание движения атомов было высказано Эпикуром, который придал атомам свойство случайного отклонения от траектории, связав его с тем, что миром правит случайность, а не судьба.
Эпикур (342/341 до н. э. - 271/270 до н. э.) —
древнегреческий философ
Различие между натурфилософиями
Демокрита и Эпикура.
Различие между натурфилософией Демокрита и натурфилософией Эпикура —
докторская диссертация К. Маркса. Актуальность диссертации заключалась в том, что Демокрит являлся таким же классиком древней философии, как Гегель — новейшей философии, Эпикур — последователь Демокрита, творчески развивший его учение, аналогично последователям Гегеля в новейшую эпоху.
Маркс даёт высокую оценку философии великих греческих атомистов Демокрита и Эпикура. В учении Эпикура о самопроизвольном отклонении атомов Маркс выявил элементы диалектики, рассматривая его как диалектический принцип самодвижения.
Маркс высказывается за активную роль философии в процессе изменения неразумного мира, отстаивает принцип диалектического единства философии и жизни.
В диссертации Маркс делает вывод, что вера в богов возникает на первой ступени в развитии человеческого сознания. Её порождает примитивный уровень мышления, не способного ещё понять и объяснить мир окружающих явлений и приписывающего ему поэтому сверхъестественные, иррациональные свойства.
«для кого мир неразумен, кто поэтому сам неразумен, для того бог существует».
Основные концепции атомизма
Основные, наиболее существенные положения их концепции сохраняют свою ценность, и состоят в следующем:
1. Первоначала мира – это атомы и пустота. Атомы постоянно двигаются в пустоте, соединяются и разъединяются. При их соединении образуются вещи разного качества и вида, потому что, и качество, и вид вещей зависят от того, как и какого качества атомы образуют их, сцепившись между собой.
2. Атомы неделимы, неизменны, вечны и
непроницаемы. Они невидимы по причине своей малости. Все атомы отличаются друг от друга формой и величиной.
3.При сцеплении атомов между собой тела образуются, а при расцеплении – распадаются.
4.Все сцепления и расцепления атомов обусловлены некоей мировой необходимостью, и в этих процессах нет ничего случайного, как нет ничего случайного и в том, какими образуются из атомов вещи, поскольку результат этого также есть проявление необходимости, заложенной в физических свойствах атома и в механических процессах их соединения.

Атомизм Нового времени
Идея об атомном строении материи так и оставалась лишь философскими мыслями вплоть до XVIII – начала XIX веков, когда сформировались основы химии как науки. Химики первыми и обнаружили, что многие вещества в процессе реакций распадаются на более простые компоненты. Например, вода распадается на водород и кислород. Однако некоторые вещества разложению на составляющие при помощи химических реакций не поддаются. Такие вещества назвали химическими элементами. К началу XIX века было установлено, что в процессе химических реакций количественное соотношение веществ, участвующих в данной реакции, не изменяется.

Атомистическая теория Дальтона
Первым ученым, добившимся определенных успехов в новом направлении развития химии, стал английский химик Д. Дальтон, чье имя тесным образом связано с атомистической теорией. В начале XIX века ученый совершает открытия в сфере нескольких экспериментальных закономерностей: закон парциальных давлений, закон о растворимости в жидкостях газов, закон кратных отношений.
В 1803 году Дальтон создает первую таблицу относительных атомных весов некоторых соединений и элементов, выбирая точкой отсчета при этом атомный вес водорода (принимая его равным единице). С целью обозначения атомов элементов Дальтон начинает применять символы в форме окружностей с разнообразными фигурами внутри.
Джон Дальтон (6 сентября 1766 — 27 июля 1844)
— английский физик и химик

«Новая система химической философии»
В 1808 году он приступил к публикации своего фундаментального двухтомного труда «Новая система химической философии», радикально повлиявшего на дальнейшее развитие химии. В этой работе Дальтон предположил, что осмыслить и интерпретировать последние достижения экспериментальной химии можно только приняв, что каждому химическому элементу в этих опытах соответствует уникальный для него атом, и что именно смешение и объединение в различных пропорциях этих атомов приводит к образованию наблюдаемых в природе химических веществ.
Например, вода, по Дальтону, состоит из сочетания двух атомов водорода и одного атома кислорода. Тот факт, что все атомы одного вида неразличимы между собой, удачно объяснял, почему при химических реакциях они всегда обнаруживаются в неизменных пропорциях. Так, в случае с водой, два атома водорода всегда одни и те же, где бы мы ни взяли эту воду, и всегда находятся в одной и той же связи с единственным атомом кислорода.
Первая модель атома
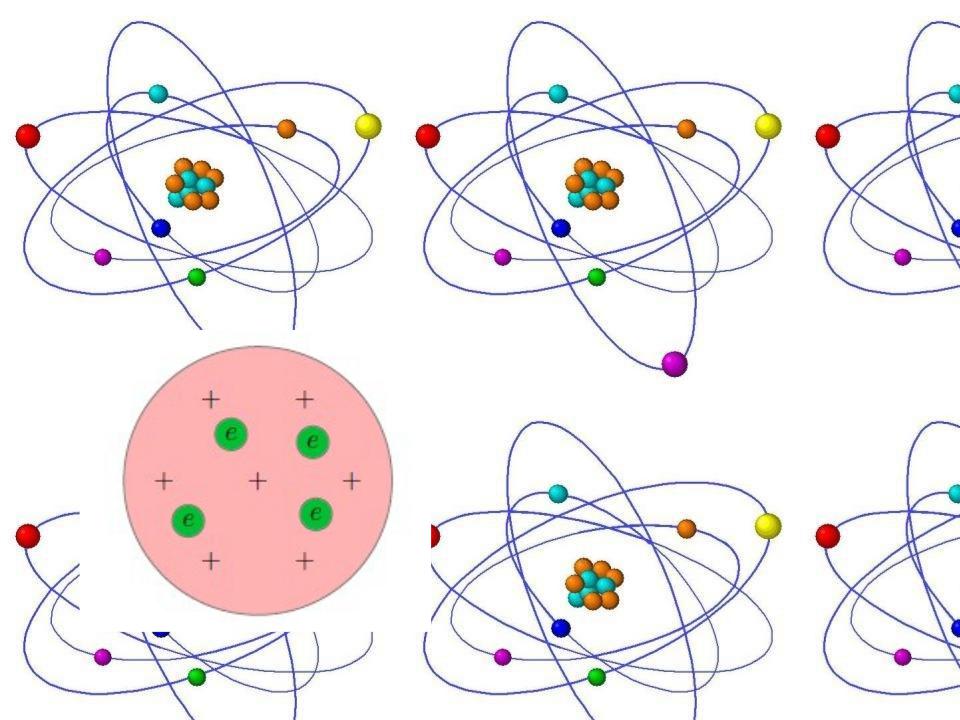
Первую модель строения атома придумал английский физик Джозеф Джон Томсон. В конечном счёте она оказалась неверной, но сыграла важную роль, будучи стимулом последующих экспериментальных исследований Резерфорда. Физики называли модель Томсона «пудинг с изюмом».
Суммарный заряд электронов в точности равен положительному заряду шара, поэтому атом в целом электрически нейтрален.
Излучение атомов объясняется колебаниями электронов около положений равновесия (как вы помните, любой ускоренно движущийся заряд излучает электромагнитные волны). Однако вся совокупность экспериментальных данных по атомным спектрам не укладывалась в модель Томсона. Например, для некоторых химических элементов были подобраны формулы, хорошо описывающие их спектры, но эти формулы из модели Томсона никак не следовали.
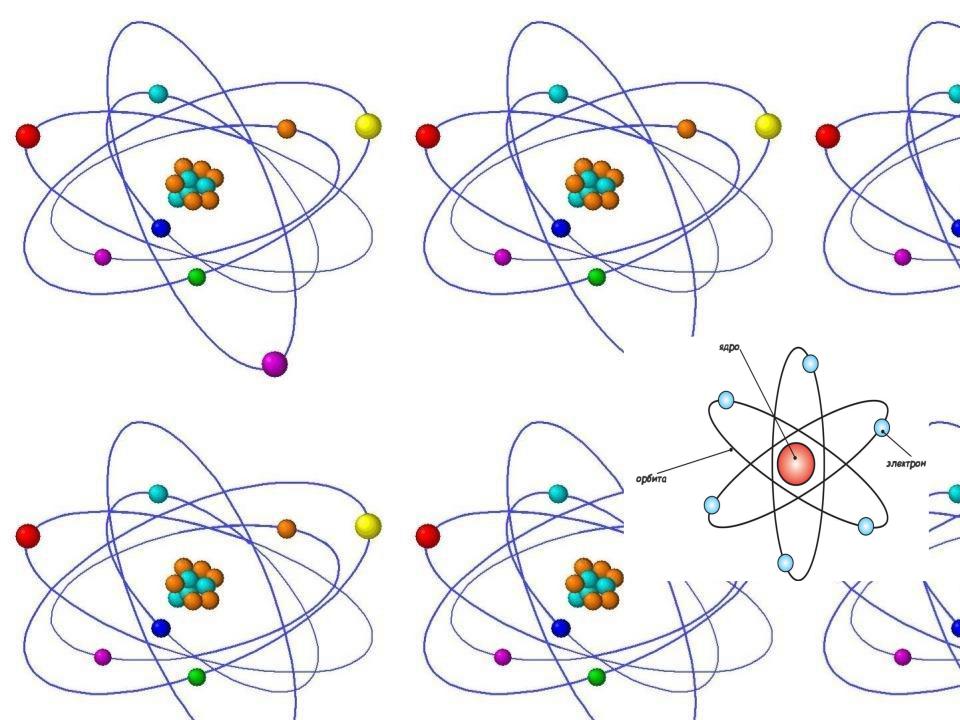
Планетарная модель атома Резерфорда
В 1911 году исследования в сфере атомов продолжает Э. Резерфорд. В рамках своих экспериментов, при исследовании активности альфа-частиц в газах, он обнаруживает присутствие в атоме определенных частиц, которые при этом являются положительно заряженными. Резерфорду удалось увидеть, что в момент прохождения лучей через газ (тонкую металлическую пластину) наблюдается резкое отклонение определенного количества частиц от траектории их движения.
Таким образом, благодаря опытам, ученый смог создать совершенно новую теорию в этой данной области. Ученый пришел к выводу, что такое поведение можно объяснить фактом столкновения с положительно заряженными частицами. Эти эксперименты помогли физику в создании модели строения атома Резерфорда. Модель Резерфорда описывает атом в формате ядра, размещенного в центре, и вокруг которого перемещаются электроны. Ядро при этом обладает положительным зарядом, а электроны – отрицательным.
