
3 курс / Фармакология / Alyautdin_Farmakologia_bolshaya_sinyaya_kniga
.pdf
Глава 22. Средства, увеличивающие сократимость миокарда. Средства, применяемые… 503
●тошноту;
●рвоту;
●диарею;
●расстройства зрения (в том числе ксантопсия — изменение цветоощущения в желтом и зеленом спектрах);
●расстройства психики (возбуждение, галлюцинации);
●нарушения сна;
●головные боли.
Поскольку сердечные гликозиды — средства растительного происхождения, в процессе производства лекарственных препаратов проводят многократную биологическую стандартизацию как растительного сырья, так и препаратов. Это обусловлено тем, что растительное сырье содержит ферменты, превращающие гликозиды друг в друга (например, первичные «генуинные» гликозиды превращаются в более стойкие вторичные). Таким образом, активность разных гликозидов из одного и того же растительного сырья может существенно различаться. При биостандартизации проводят оценку активности сырья или препарата в сравнении со стандартным препаратом. Обычно активность препаратов определяют в опытах на лягушках и выражают в «лягушачьих ЕД». Одна лягушачья ЕД (ЛЕД) соответствует минимальной дозе стандартного препарата, в которой он вызывает остановку сердца в систоле у большинства подопытных лягушек. Так, 1 г листьев наперстянки должен содержать 50–66 ЛЕД; 1 г семян строфанта — 2000 ЛЕД; 1 г дигитоксина — 8000–10 000 ЛЕД; 1 г целанида♠ — 14 000–16 000 ЛЕД; а 1 г строфантина — 44 000–56 000 ЛЕД. Реже для стандартизации используют кошачьи и голубиные ЕД.
Дигоксин (ланикор♠) — гликозид наперстянки шерстистой (Digitalis Lanata). Среди сердечных гликозидов его наиболее широко применяют в клинической практике. Препарат хорошо всасывается из ЖКТ (степень и скорость всасывания из таблеток, выпускаемых различными фирмами, варьирует). Биодоступность дигоксина при введении внутрь составляет 60–85%, связь с белками плазмы крови — 25–30%. Метаболизируется дигоксин только в небольшой степени и в неизмененном виде (70–80% от принятой дозы) выводится почками; t½ 32–48 ч. У больных с хронической почечной недостаточностью почечный клиренс дигоксина снижается (необходимо уменьшение дозы). Дигоксин назначают внутрь при хронической сердечной недостаточности и тахисистолической форме мерцательной аритмии, а также внутривенно при острой сердечной недостаточности. Кардиотонический эффект при приеме внутрь развивается через 1–2 ч и достигает максимума в течение 8 ч. При внутривенном введении действие наступает через 20–30 мин и достигает максимума через 3 ч.
504 |
Часть II. Частная фармакология |
Действие после прекращения приема препарата при нормальной функции почек продолжается 2–7 дней. Ввиду длительного t½ и способности связываться с белками плазмы при применении дигоксина существует риск материальной кумуляции и интоксикации.
Ацетилдигоксин В (новодигал♠) — ацетилированное производное дигоксина. По фармакодинамике и основным фармакокинетическим параметрам мало отличается от дигоксина. Всасывается в тонкой кишке. В процессе прохождения через кишечную стенку практически полностью деацетилизируется, достигает системного кровотока уже в виде дигоксина. Ацетильная группа выполняет функцию переносчика и увеличивает резорбцию препарата.
Ланатозид С (целанид♠) — первичный (генуинный) гликозид из листьев наперстянки шерстистой (Digitalis Lanata), сходен с дигоксином. При введении внутрь имеет меньшую, чем дигоксин, биодоступность (30–40%). Связывается с белками плазмы крови на 20–25%. В ходе метаболических изменений ланатозида образуется дигоксин. Выводится почками в неизмененном виде, в виде дигоксина и метаболитов, t½ составляет 28–36 ч. Применяют по тем же показаниям, что и дигоксин. Оказывает более «мягкий» эффект (лучше переносится пожилыми больными).
Дигитоксин — гликозид, содержащийся в листьях наперстянки пурпуровой (Digitalis purpurea). До недавнего времени его широко применяли в клинической практике. Представляет собой липофильное неполярное соединение, поэтому полностью всасывается из ЖКТ (биодоступность 95–100%). С белками плазмы крови связывается на 90–97%. При приеме внутрь латентный период составляет 2–4 ч, максимальный эффект развивается через 8–12 ч, продолжительность действия после однократно введенной дозы — 14–21 дней. Дигитоксин метаболизируется в печени и в виде метаболитов выводится с мочой. Кроме того, частично экскретируется с желчью в кишечник, где подвергается энтерогепатической рециркуляции (снова реабсорбируется и поступает в печень); t½ составляет 4–7 дней. Применяют внутрь при хронической сердечной недостаточности и наджелудочковых тахиаритмиях. Вследствие перечисленных выше фармакокинетических особенностей (высокая степень связывания с белками плазмы, медленный метаболизм, длительная циркуляция в системном кровотоке) препарат обладает выраженной способностью к материальной кумуляции. В связи с этим при применении дигитоксина риск возникновения интоксикации гораздо выше, чем при применении других гликозидов наперстянки.
Уабаин (строфантин Г♠) — гликозид из семян строфанта гладкого (Strophantus gratus) и строфанта Комбе (Strophantus Kombe), полярное со-

Глава 22. Средства, увеличивающие сократимость миокарда. Средства, применяемые… 505
единение, практически не всасывается из ЖКТ, в связи с чем его вводят внутривенно. Имеет короткий латентный период (действие проявляется через 2–20 мин, достигая максимума через 30–120 мин, и продолжается 1–3 дней). Связь с белками плазмы составляет около 40%, практически не метаболизируется в организме и выводится почками в неизмененном виде. Препарат применяют при острой сердечной недостаточности (или при хронической сердечной недостаточности III—IV функционального классов) и тахисистолической мерцательной аритмии в качестве средства скорой помощи. Вводят внутривенно медленно в растворе глюкозы♠. Ввиду относительно непродолжительной циркуляции в системном кровотоке уабаин меньше, чем гликозиды наперстянки, кумулирует и создает риск возникновения интоксикации.
Коргликон♠ — препарат, содержащий ряд гликозидов из листьев ландыша (Сonvallaria majalis). По характеру действия и фармакокинетическим свойствам близок к строфантину♠. Оказывает несколько более продолжительное действие. Применяют при острой сердечной недостаточности. Вводят внутривенно медленно (в растворе глюкозы).
Вследствие выраженной способности сердечных гликозидов к материальной кумуляции и небольшой широты их терапевтического действия при применении этой группы кардиотоников высок риск интоксикации.
Гликозидная интоксикация проявляется кардиальными и экстракардиальными нарушениями. К кардиальным проявлениям относят желудочковую экстрасистолию и атриовентрикулярную блокаду. Желудочковые экстрасистолы возникают в результате повышения автоматизма, вызываемого гипокалийгистией и гиперкальцийгистией. Частота их возникновения увеличивается при гипокалиемии и гипомагниемии, которые может вызвать применение петлевых и тиазидных диуретиков. Желудочковые экстрасистолы могут протекать по принципу бигеминии (экстрасистола после каждого нормального сердечного сокращения) или тригеминии (экстрасистола после каждых двух нормальных сокращений сердца). Атриовентрикулярная блокада (частичная или полная) — результат отрицательного дромотропного действия, обусловленного усилением вагусных влияний на сердце. Наиболее частая причина смерти при интоксикации сердечными гликозидами — фибрилляция желудочков (беспорядочные несинхронные сокращения отдельных пучков мышечных волокон с частотой 450–600 в минуту, быстро приводящие к асистолии — остановке сердца).
Наиболее эффективные средства при интоксикации гликозидами наперстянки — препараты антител к дигоксину. При желудочковых экстрасистолиях применяют блокаторы натриевых каналов класса IB (фенитоин, лидокаин), поскольку они действуют избирательно на желудочки,
506 |
Часть II. Частная фармакология |
снижая автоматизм и не снижая сократимость, атриовентрикулярную проводимость. При атриовентрикулярной блокаде применяют атропин, который блокирует М2-холинорецепторы сердца, препятствуя тормозному действию блуждающего нерва на атриовентрикулярную проводимость. Для восполнения дефицита ионов калия и магния применяют калия хлорид и комбинированные препараты калия и магния — панангин♠ и аспаркам♠. Ионы магния активируют К+-,Na+-АТФазу, способствуя транспорту ионов калия в кардиомиоциты.
Для связывания ионов кальция в системном кровотоке внутривенно вводят динатриевую соль этилендиаминтетрауксусной кислоты (трилон Б♠). Для восстановления активности К+-,Na+-АТФазы применяют донатор сульфгидрильных групп унитиол♠, который благодаря наличию сульфгидрильных (тиоловых) групп связывается дисульфидными мостиками с гликозидом, освобождая тем самым тиоловые группы АТФазы (это приводит к восстановлению ее транспортной функции).
22.1.2. Кардиотонические средства негликозидной структуры
Эта группа средств появилась в клинической практике в 80-е годы прошлого века. В течение некоторого времени на эту группу возлагались надежды как на группу препаратов, способную заменить сердечные гликозиды (с этой целью были созданы негликозидные кардиотоники для приема внутрь — дофаминомиметик ибопамин, ингибитор фосфодиэстеразы-III милринон♠). Однако в тех дозах, в которых применяют негликозидные кардиотоники, их побочные и токсические эффекты выражены ярче и проявляются чаще, чем у сердечных гликозидов. При длительном применении негликозидные кардиотоники повышают летальность. В связи с этим в настоящее время группа кардиотонических средств негликозидной структуры применяется в качестве средств скорой помощи (кратковременно) при острой (декомпенсированной) сердечной недостаточности. По механизму действия их классифицируют на 3 группы.
●Агонисты β1-адренорецепторов:
—β1-адреномиметики — добутамин;
—дофаминомиметики — допамин.
●Ингибиторы фосфодиэстеразы III типа — милринон♠.
●Сенситайзеры кальция — левосимендан.
Добутамин (добутрекс♠) — β1-адреномиметик (рис. 22.3). Стимулируя β1-адренорецепторы миокарда, активирует GS-белки, которые увеличивают активность аденилатциклазы (см. рис. 22.1). В результате увеличивается образование цАМФ из АТФ. Накапливающийся в кардиомиоцитах цАМФ

Глава 22. Средства, увеличивающие сократимость миокарда. Средства, применяемые… 507
активирует цАМФ-зависимые протеин- |
|
киназы, способствующие открытию каль- |
|
циевых каналов. Это повышает вход Са2+ |
|
в кардиомиоциты и усиливает десекве- |
|
страцию Са2+ из саркоплазматического |
|
ретикулума. Увеличивается сила сердеч- |
|
ных сокращений (при этом ЧСС, авто- |
|
матизм и проводимость увеличиваются |
|
в меньшей степени). Добутамин вводят |
|
внутривенно капельно (или с использова- |
Рис. 22.3. Химическая структура |
нием инфузионного насоса) со скоростью |
добутамина |
2,5–10 (но не более 40) мкг/кг/мин. Доза |
|
искорость инфузии зависят от степени гемодинамических расстройств. Препарат обладает быстрым и коротким действием (начинает действовать через 1–2 мин, а максимальный эффект развивается через 10 мин). Метаболизируется с образованием 3-О-добутамина и быстро выводится через
почки (t½ 2 мин). Кроме того, добутамин увеличивает коронарный кровоток, повышая доставку кислорода к миокарду, а также снижает ОПСС
исосудистое сопротивление в малом круге кровообращения, не понижая существенно системное АД. Основная сфера применения — острая сердечная недостаточность или острая декомпенсация хронической сердечной недостаточности. Из побочных эффектов возможны тахикардия, аритмии (как желудочковая, так и наджелудочковая).
Допамин — дофаминомиметик, предшественник норадреналина. Его кардиотоническое действие, как и у добутамина, обусловлено стимуля-
цией β1-адренорецепторов. Однако в отличие от добутамина, мало влияющего на тонус периферических сосудов, допамин в небольших дозах расширяет сосуды почек и брыжейки (за счет стимуляции дофаминовых рецепторов), а в высоких дозах повышает тонус периферических сосудов, оказывая прессорное действие (стимуляция α-адренорецепторов). Сочетание кардиотонического и прессорного эффектов обусловливает применение допамина при острой сердечно-сосудистой недостаточности, кардиогенном (а также послеоперационном, инфекционно-токсическом, анафилактическом) шоке. Вводят допамин внутривенно капельно со скоростью 4–10 (но не более 20) мкг/кг/мин. Препарат обладает быстрым, но коротким действием (5–10 мин). Среди побочных эффектов отмечают
сужение периферических сосудов, тахикардию, аритмию, тошноту, рвоту. Милринон♠ (примакор♠) — ингибитор фосфодиэстеразы кардиомиоцитов (фосфодиэстераза-III). Угнетение фосфодиэстеразы-III приводит к увеличению внутриклеточной концентрации цАМФ и активации
508 |
Часть II. Частная фармакология |
цАМФ-зависимых протеинкиназ, открывающих кальциевые каналы. За счет этого увеличивается концентрация ионов Са2+ в кардиомиоцитах и усиливаются сокращения миокарда. За счет неизбирательного угнетения фосфодиэстеразы ангиомиоцитов милринон оказывает сосудорасширяющее действие, снижая ОПСС и постнагрузку. Препарат применяют внутривенно для кратковременной терапии острой сердечной недостаточности, резистентной к другим кардиотоникам. Вначале вводят нагрузочную дозу 50 мкг/кг (в течение 10 мин), затем — поддерживающую дозу 0,375–0,75 мкг/кг/мин. В качестве побочных эффектов отмечают аритмогенное действие, ангинальные боли, тромбоцитопению.
Левосимендан (симдакс♠) — производное пиридазинон-динитрила, относят к группе негликозидных кардиотонических средств, повышающих чувствительность миофибрилл сердца к ионам кальция (сенситайзерам) Несколько раньше был разработан пимобендан , использующийся в настоящее время только в Японии.
Эта группа отличается от описанных выше групп кардиотонических средств тем, что не увеличивает внутриклеточную концентрацию Са2+ и, таким образом, в меньшей степени способствует возникновению аритмий, обусловленных гиперкальцийгистией (поздняя постдеполяризация). Левосимендан связывается с N-концевой частью тропонина С, повышая его аффинитет к ионам Са2+. При этом ингибирование тропонина С и увеличение сократительной активности миофиламентов происходят без увеличения концентрации кальция в кардиомиоцитах. Взаимодействие левосимендана с тропонином С осуществляется только в период систолы. Таким образом, левосимендан, повышая интенсивность систолы, не препятствует полному расслаблению желудочков в диастолу. В связи с этим потребность миокарда в кислороде при применении левосимендана возрастает в меньшей степени, чем при применении других негликозидных кардиотоников. Не исключено, что левосимендан обладает способностью ингибировать фосфодиэстеразу-III, однако эта способность проявляется в дозах, значительно превышающих терапевтические. Ценное свойство левосимендана — способность активировать АТФ-зависимые калиевые каналы ангиомиоцитов. Это приводит к расширению сосудов большого круга кровообращения (снижение постнагрузки и преднагрузки на сердце), а также к расширению коронарных сосудов (увеличение оксигенации миокарда). Эти эффекты чрезвычайно важны при сердечной недостаточности. Левосимендан при введении в системный кровоток связывается с белками плазмы на 97–98%. Препарат почти полностью метаболизируется (5% составляет активный метаболит), t½ составляет около 1 ч. Левосимендан обладает быстрым и непродолжительным действием,

Глава 22. Средства, увеличивающие сократимость миокарда. Средства, применяемые… 509
в связи с чем его применяют внутривенно капельно. Вначале вводят нагрузочную дозу 24 мкг/кг в течение 10 мин, затем поддерживающую дозу 0,1 мкг/кг/мин в течение 24 ч. Среди побочных эффектов отмечают только гипотензию и головную боль.
22.2. СРЕДСТВА, ПРИМЕНЯЕМЫЕ ПРИ СЕРДЕЧНОЙ НЕДОСТАТОЧНОСТИ
Сердечная недостаточность обусловлена нарушением насосной функции сердца и ухудшением гемодинамики периферических органов и тканей, проявляющихся явлениями застоя. При этом недостаточность насосной функции сердца может быть результатом систолической или диастолической дисфункции.
●Систолическая дисфункция (уменьшение фракции выброса левого желудочка) возникает в результате первичного уменьшения сократительной активности миокарда. Снижение сократимости при этом может быть обусловлено коронарогенными поражениями сердца (инфаркт миокарда, миокардиодистрофии), миокардитами, кардиомиопатиями.
●Диастолическая дисфункция обусловлена вторичной перегрузкой
миокарда (увеличением преднагрузки или постнагрузки на сердце) при относительно сохранной сократимости миокарда. Это можно наблюдать при клапанных пороках сердца, гипертонической болезни, артериовенозных шунтах. Позже присоединяется систолическая дисфункция.
Симптоматика сердечной недостаточности зависит от преимущественной локализации процесса. Так, недостаточность левых отделов сердца приводит к застойным явлениям в малом круге кровообращения (острая левожелудочковая недостаточность проявляется острым отеком легких), а недостаточность правых отделов сердца приводит к застойным явлениям в большом круге кровообращения и гипоксии периферических тканей. При этом у пациентов возникают акроцианоз (цианоз кожи и слизистых оболочек), гипостатические периферические отеки. Кроме того, застой в большом круге кровообращения приводит к повышению давления в легочных капиллярах и нарушению газообмена в легких. В результате возникает одышка. Распространенность сердечной недостаточности в популяции составляет 1,5–2%, с возрастом этот показатель увеличивается. Так, у людей старше 65 лет она встречается уже в 6–10% случаев.
510 |
Часть II. Частная фармакология |
По длительности течения сердечной недостаточности различают хроническую (застойную) сердечную недостаточность и острую сердечную недостаточность.
22.2.1. Средства фармакотерапии хронической застойной сердечной недостаточности
Хроническая (застойная) сердечная недостаточность обычно характеризуется прогрессирующим течением, при котором усугубляются общие застойные явления, а также возникает изменение геометрии левого желудочка, обозначаемое термином «ремоделирование» (гипертрофия стенки, дилатация камеры, регургитация через митральный клапан). Ремоделирование, в свою очередь, приводит к еще большему увеличению гемодинамической нагрузки на миокард, еще большему снижению насосной функции сердца и дальнейшему нарастанию явлений застоя.
Существуют различные классификации хронической (застойной) сердечной недостаточности. Наиболее распространена классификация по степени тяжести (функциональная) Нью-Йоркской ассоциации сердца (NYHA):
●I функциональный класс — бессимптомное течение при обычной физической нагрузке, появление симптомов при значительной нагрузке;
●II функциональный класс — появление симптомов при умеренной нагрузке;
●III функциональный класс — появление симптомов при легкой (незначительной) физической нагрузке;
●IV функциональный класс — появление симптомов в покое.
В основе прогрессирования сердечной недостаточности лежит активация нейрогуморальных систем — симпато-адреналовой, ренин- ангиотензин-альдостероновой, системы эндотелина, вазопрессина, натрийуретического пептида и др. Наиболее взаимосвязаны из них — симпато-адреналовая и ренин-ангиотензиновая системы, поскольку они оказывают друг на друга взаимное активирующее влияние (стимуляция β1-адренорецепторов юкстагломерулярного аппарата стимулирует секрецию ренина, а ангиотензины повышают тонус симпатической нервной системы) (рис. 22.4).
Застой в большом круге кровообращения снижает перфузию почечной паренхимы. Снижение давления в приносящем сосуде юкстагломерулярного аппарата приводит к усилению выделения ренина. Ренин, поступая в системный кровоток, превращает ангиотензиноген в ангио-
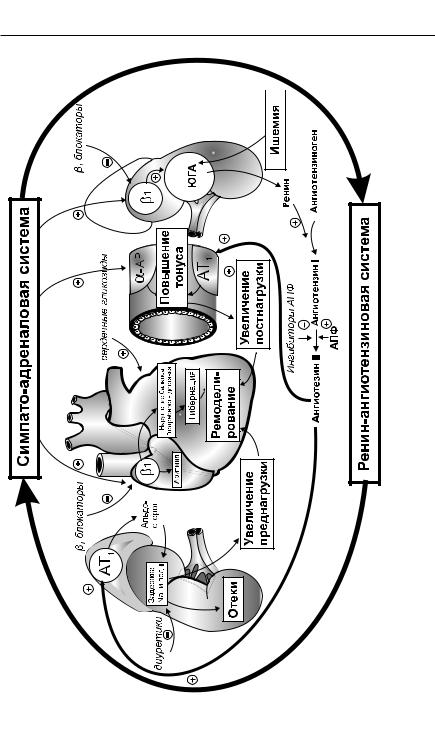
Глава 22. Средства, увеличивающие сократимость миокарда. Средства, применяемые… 511 
 леченияее
леченияее
Рис. 22.4. Механизмы прогрессирования сердечной недостаточности и некоторые препараты, применяемые для
512 |
Часть II. Частная фармакология |
тензин I, который под действием АПФ переходит в ангиотензин II. Ангиотензин II играет существенную роль в прогрессировании сердечной недостаточности. Стимулируя АТ1-рецепторы резистивных сосудов, он повышает их тонус и увеличивает постнагрузку на сердце (способствуя вторичной перегрузке сердца и его ремоделированию). Стимуляция АТ1-рецепторов коры надпочечников ангиотензином II увеличивает выделение в кровь альдостерона (вторичный гиперальдостеронизм), вызывающего задержку Na+ и воды. Это, в свою очередь, способствует возникновению отеков, увеличению преднагрузки и ремоделирования сердца. В миокарде ангиотензин II может превращаться в ангиотензин III, который стимулирует фибротические процессы и тем самым усугубляет ремоделирование. Кроме того, ангиотензин II повышает тонус симпатической нервной системы и активирует симпато-адрена- ловую систему. Это приводит к стимуляции адренореактивных структур
всердечно-сосудистой системе. Стимуляция α-адренорецепторов рези-
стивных сосудов (так же как и стимуляция АТ1-рецепторов) повышает их тонус и увеличивает постнагрузку. Стимуляция β1-адренорецепторов миокарда приводит к аритмиям, увеличению потребности миокарда
вкислороде (и, таким образом, усилению гипоксии миокарда, что содействует ремоделированию), гибернации сократительных кардиомиоцитов (уменьшение сократимости вследствие гипоксии). Стимуляция
β1-адренорецепторов юкстагломерулярного аппарата приводит к активации выделения ренина и стимуляции ренин-ангиотензин-альдосте- роновой системы.
Существенный вклад в прогрессирование хронической застойной сердечной недостаточности вносят другие регуляторные системы. Так, увеличение объема внеклеточной жидкости и уменьшение сердечного выброса приводят к нарушению функционирования так называемых сенсоров объема. Недостаточная импульсация «сенсоров высокого давления» приводит к увеличению продукции вазопрессина (суживает сосуды и задерживает
воду). Кроме того, снижается выработка натрийуретических пептидов (расширяют сосуды и выводят Na+ и воду). В результате происходят повышение тонуса сосудов и задержка воды и электролитов. Это еще больше усугубляет диастолическую перегрузку миокарда и способствует прогрессированию сердечной недостаточности.
Основная стратегия в фармакотерапии хронической застойной сердечной недостаточности — замедление прогрессирования заболевания ЛС, влияющими на разные звенья его патогенеза. Прямая стимуляция сократимости миокарда кардиотоническими средствами при этом играет далеко не ведущую роль. Средства, применяемые в комплексной терапии
