

1 Переваривание нуклеиновых кислот и нуклеотидов в желудочнокишечном тракте.
2 Источники атомов углерода и азота пуринового кольца.
Печень - основное место образования пуриновых нуклеотидов, откуда они могут поступать в ткани, не способные к их синтезу: эритроциты, ПЯЛ и частично мозг.
Источники атомов углерода и азота в пуриновом кольце:
1-из аспарагиновой кислоты
2- из формил - ТГФК
3,9- из глутамина
4,5,7 - из глицина
6- из СО2
8- из метенил – ТГФК
3 Схема биосинтеза АМФ и ГМФ de novo.
«de novo» основной путь 80-90%; локализация – печень
1. Субстраты для синтеза пурина:
СO2 + гли + глн + асн + N10-формил Н 4-фолат + N10-метенил Н4-фолат
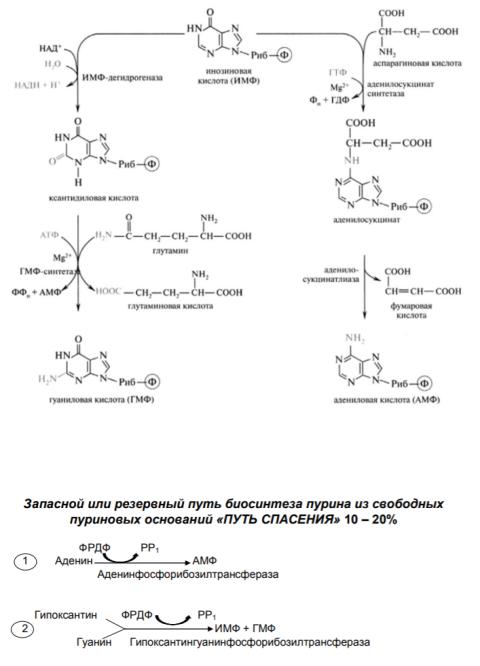
4. Резервный путь биосинтеза АМФ, ГМФ Схема синтеза ИМФ АМФ, ИМФ, ГМФ
5. Нарушения обмена пуриновых нуклеотидов в организме человека (подагра) .
Вследствие низкой (малой) растворимости мочевой кислоты, в моче присутствуют ее соли – ураты (которые более растворимы). Большинство камней в мочевыводящей системе – кристаллы мочевой кислоты.
Повышение концентрации мочевой кислоты в плазме крови приводят к гиперурикемии, следствием которой является подагра – заболевание, при котором кристаллы мочевой кислоты и уратов откладываются в суставных хрящах синовиальной оболочке, подкожной клетчатке с образованием подагрических узлов, или тофусов. Признаки подагры – острое воспаление суставов - острый подагрический артрит.
Поскольку лейкоциты фагоцитируют кристаллы уратов, то причиной воспаления является разрушение лизосомальных мембран лейкоцитов кристаллами мочевой кислоты. Освободившиеся лизосомальные ферменты выходят в цитозоль и разрушают клетки, а продукты клеточного катаболизма вызывают воспаление.
6. Схема биосинтеза пиримидиновых нуклеотидов в тканях.
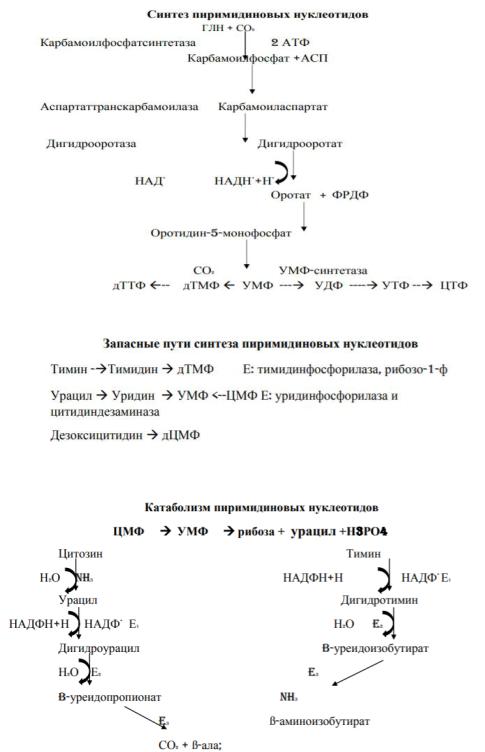
7. Распад пиримидиновых нуклеотидов в тканях.
1.Матричные биосинтезы в организме: репликация, репарация (биосинтез ДНк); транскрипция (биосинтез м-РНК, р-РНК, т-РНк). трансляция (биосинтез белка). Общая характеристика.
Репликация – синтез ДНК, где каждая из двух цепей служит матрицей для образования новой цепи. Источниками энергии являются дезоксирибонуклеозидтрифосфаты (дНТФ: дАТФ, дГТФ, дЦТФ, дТТФ).
Транскрипция – синтез РНК на ДНК-матрице, образуются первичные транскрипты – мРНК, тРНК, рРНК, комплементарны матричной цепи ДНК, имеющей направление от 3 к 5-концу. Субстратами и источниками энергии для синтеза РНК являются рибонуклеозидтрифосфаты (НТФ: УТФ, ГТФ, ЦТФ, АТФ).
Трансляция – непосредственно синтез белка. Информация записана на четырёх буквенном языке нуклеиновых кислот (ТАГЦ), переводится на язык белков, состоящий из 20 букв. Синтез белка отличается от других матричных биосинтезов (репликации, транскрипции) тем, что между мРНК и продуктом-белком нет комплиментарного соответствия.
Репарация ошибок и повреждений ДНК– восстановление ДНК, основанное на том, что ДНК - двухцепочечная молекула. Если нуклеотидная последовательность одной из двух цепей оказывается повреждённой (изменённой), информацию можно восстановить, так как вторая (комплементарная) цепь сохранена
2. Pепликация ДНК, характеристика процесса, механизм, субстраты, этапы, ферменты, биологическое значение
Репликация– это синтез, удвоение цепей ДНК, включает три основных этапа: I. Формирование репликативной вилки.
II. Синтез новых цепей ДНК.
III. Исключение праймеров и завершение формирования отстающей цепи ДНК. I. Формирование репликативной вилки.Основные ферменты:
1.ДНК – топоизомеразы разрывают 3-5-фосфодиэфирную связь одной из цепей ДНК и присоединяется
к5 в точке разрыва, образуется репликативная вилка.
2.ДНК-хеликазы – присоединяются в области разрыва двух цепей, также участвуя в образовании репликативной вилки, т.о. расплетают двойную спираль ДНК.
3.SSB (singstrandbinding) – белки, связываются с одноцеполчечными участками ДНК, предотвращая повторное комплементарное скручивание.
II. Синтез новых цепей ДНК
I этап – дочерние нити образуются на обеих нитях материнской ДНК. Основные ферменты: ДНКполимеразы, они синтезируют полинуклеотидные цепи из нуклеотидтрифосфатов (дАТФ, дГТФ, дТТФ, дЦТФ) в направлении от 5к 3-концу антипараллельно матрице, имеющей направление от 3 к 5- концу.
III этап синтеза ДНК – исключение праймеров и завершение формирования отстающей цепи ДНК.
1.В отстающей нити праймер удаляется эндонуклеазой.
2.ДНК-полимераза β заполняет образованную «брешь», присоединяя дезоксирибонуклеотиды.
3.Присоединение дезоксирибонуклеотида путём связывания 3-ОН одного фрагмента с 5-фосфатом предыдущего фрагмента; катализирует ДНК-лигаза. Это процесс, когда из множества фрагментов Оказаки образуется нить ДНК.
4.Результатом является образование дочерних цепей комплементарных и антипараллельных нитям материнской ДНК.
5. Молекулы ДНК человека имеют очень большие размеры, поэтому инициация синтеза ДНК происходит в точках инициации репликации ДНК – ориджинах репликации. Синтез ДНК начинается в области ориджина, идет в противоположных направлениях, в каждом ориджине образуются две репликативные вилки, которые перемещаются в противоположных направлениях, пока не встретятся.
6. Единица репликации у эукариот называется репликоном. Репликон– это участок ДНК между соединенными ориджинами.
3. Репарация днк, характеристика, субстраты, этапы, ферменты, биологическое значение.
Репарация ошибок и повреждений ДНК– восстановление ДНК, основанное на том, что ДНК - двухцепочечная молекула. Если нуклеотидная последовательность одной из двух цепей оказывается повреждённой (изменённой), информацию можно восстановить, так как вторая (комплементарная) цепь сохранена.
Процесс репарации происходит в несколько этапов: 1. Выявление нарушений комплементарности цепей ДНК. 2. Устранение некомплементарного нуклеотида или только основания 3. Восстановление целостности цепи по принципу комплементарности.
Количество этапов и ферментов, участвующих в его устранении, варьирует в зависимости от типа повреждения. Очень редко происходят повреждения, затрагивающие обе цепи ДНК, т.е. нарушения структуры нуклеотидов комплементарной пары. Такие повреждения в половых клетках не репарируются, так как для осуществления сложной репарации с участием гомологичной рекомбинации требуется наличие диплоидного набора хромосом. Все виды повреждений ДНК условно можно разделить на два вида: спонтанные и индуцируемые.
I. Спонтанные повреждения ДНК происходят спонтанно (без участия каких-либо повреждающих факторов, например в результате ошибок репликации, дезаминирования нуклеотидов, депуринизации).
Точность репликации ДНК очень велика, но примерно один раз на 105 - 106 нуклеотидных остатков происходят ошибки спаривания, тогда вместо пары нуклеотидов А-Т, G-С в дочернюю цепь ДНК оказываются включёнными нуклеотиды, некомплементарные нуклеотидам матричной цепи. Однако ДНК-полимеразы δ, ε способны после присоединения очередного нуклеотида в растущую цепь ДНК делать шаг назад (в направлении от 3'- к 5'- концу) и вырезать последний нуклеотид, если он некомплементарен нуклеотиду в матричной цепи ДНК. Этот процесс исправления ошибок спаривания (или коррекция) иногда не срабатывает, и тогда в ДНК по окончании репликации остаются некомплементарные пары, тем более, что ДНК-полимераза а лишена корректирующего механизма и «ошибается» чаще, чем другие полимеразы.
II. Индуцируемые повреждения возникают в ДНК в результате воздействия разнообразных мутагенных факторов как радиационной, так и химической природы.
Образование димеров пиримидиновых оснований
Под действием УФО двойная связь между С5 и С6 атомами углерода в составе пиримидиновых оснований (тимине и цитозине) может разрываться. Атомы углерода остаются связанными одной связью. Расстояние между параллельными плоскостями оснований полинуклеотидной цепи, в которых произошёл разрыв, равно примерно 3,4 . Это расстояние позволяет освободившимся валентностям между С-С атомами пиримидиновых оснований, расположенных последовательно в цепи ДНК, сформировать циклобутановое кольцо. В зависимости от того, какие основания соединены в димер, их называют димерамитимина, цитозина или тиминцитозиновымидимерами.
Удаление пиримидиновых димеров происходит под действием фотолиазы. Фермент расщепляет вновь образовавшиеся связи между соседними пиримидиновыми основаниями и восстанавливает нативную структуру. В фотолиазе есть участок, либо сам поглощающий фотоны (в синей части спектра), либо связывающийся с кофакторами, адсорбирующими свет. Таким образом, свет активирует фотолиазу, которая распознаёт димеры в облучённой ДНК, присоединяется к ним и разрывает возникшие между пиримидиновыми кольцами связи. После этого фермент отделяется от ДНК.
4. Транскрипция, биосинтезы м-РНК, р-РНК, т-РНК. Этапы, ферменты, субстраты, биологическое значение. Регуляция транскрипции. Биологическое значение.
I. Транскрипция – это биосинтез РНК на ДНК-матрице, образуются первичные транскрипты мРНК, тРНК, рРНК, комплиментарные матричной цепи ДНК.
Субстраты и источники энергии: нуклеозидтрифосфаты (АТФ, ГТФ, ЦТФ, УТФ).
Ферменты – РНК-полимеразы (I, II, III).
II. В транскрипции участвуют следующие сайты ДНК:
1.Промотор – сайт ДНК, в которой РНК – полимераза связывается с матрицей (ДНК) и начинает синтез РНК.
2.Сайт терминации – это участок ДНК, на котором завершается синтез РНК.
3. Транскриптон – участок ДНК, ограниченный промотором и сайтом терминации.
III. Стадии транскрипции:
1стадия – инициация (т.е. активация промотора): сайт ДНК (промотор) связывается с РНК-полимеразой с помощью ТАТА-фактора (специфическая последовательность нуклеотидов промотра сайта ДНК для посадки РНК-полимеразы). РНК-полимераза на этом этапе обеспечивает локальное расплетение двойной спирали.
2стадия – элонгация. По мере продвижения РНК-полимеразы по цепи ДНК в направлении 3 → 5 впереди нее происходит расхождение, а позади – восстановление двойной спирали.
3стадия – терминация – когда РНК-полимераза достигает сайта терминации (завершение синтеза), транскрипция прекращается. Факторы терминации облегчают отделение первичного транкрипта от матрицы. Образуются пре-мРНК, претРНК, прерРНК – это образование из пре РНК – мРНК, тРНК, рРНК.
5. Генетический код и его свойства.
Синтез белка отличается от других матричных биосинтезов тем, что между матрицей (мРНК) и продуктом – белком нет комплементарного соответствия, т.к. матрица ДНК построена из 4 нуклеотидов, а полипептидная цепь из 20 аминокислот, т.е. четырех буквенный язык нуклеиновых кислот переводится на язык белков из 20 букв.
Генетический код – это способ записи информации об аминокислотной последовательности белков с помощью последовательности нуклеотидов в ДНК и РНК. Его характеризуют следующие свойства: триплетность и наличие терминирующих кодонов, специфичность, вырожденность, универсальность, однонаправленность, колинеарность.
Триплетность и наличие терминирующих кодонов – кодовое число равно 3: 3 нуклеотидных остатка (триплет) кодируют 1 аминокислоту. Терминирующие триплеты – UAA, UAG, UGA не кодируют аминокислот, а являются сигналами к прекращению синтеза белка.
Специфичность – каждый триплет кодирует только 1 аминокислоту.
Вырожденность – 1 аминокислоту могут кодировать несколько триплетов (от 2 до 6).
Универсальность – почти у всех видов организмов биологический код одинаков.
Однонаправленность– информация, записанная в зрелой мРНК в виде линейной последовательности кодонов (триплетов) считывается в направлении от 5- к 3-концу.
Колинеарность–последовательность кодонов в зрелой мРНК соответствует последовательности аминокислот в синтезированном белке.
6. Подготовка аминокислот к биосинтезу белка: характеристика и функции адаптационных молекул, синтез аминоацил-т-PHK Субстратная специфичность
Аминокислоты синтезируются из промежуточных соединений, образующихся в процессах гликолиза и цикла лимонной кислоты (цикла Кребса). Предшественниками всех аминокислот в организме являются пять соединений: 3-фосфоглицерат, фосфоенолпируват, пируват, оксалоацетат и а-кетоглутарат. Эти соединения вместе с двумя моносахаридами пентозофосфатного пути служат предшественниками всех аминокислот в бактериях и растениях.
Фундаментальное значение для биосинтеза всех аминокислот во всех организмах имеет реакция образования глутаминовой кислоты (глутамата) из аммиака и а-кетоглутаровой кислоты (а- кетоглутарата) под действием фермента глутаматдегидрогеназы:
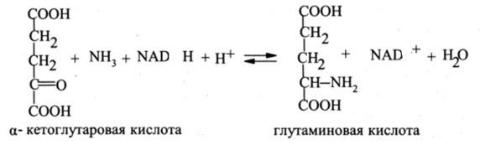
Трансаминирование а-кетокислот с использованием глутаминовой кислоты в качестве донора аминогруппы представляет собой основной путь введения а-аминогруппы при биосинтезе большинства других аминокислот.
9. Этапы трансляции (биосинтеза белка): инициация, элонгация, терминация. Субстраты, ферменты, факторы, энергия
Трансляция (синтез белка)– это механизм перевода генетической информации в фенотипические признаки.
1 этап – инициация – характеризуется тем, что 40 S рибосома связывается с 60 S рибосомой, образуя 80 S рибосому – рибосому эукариот с 2 активными центрами: Р – пептидильный, в котором находится меттРНК (метионин-тРНК) и А – аминоацильный центр, в область которого поступает первый смысловой кодон (мРНК).
2 этап – элонгация – включает три стадии:
1 стадия – это связывание аминоацил-тРНК (аатРНК) с другим участком связывания аа-тРНК на рибосоме, называемом А-участком при участии фактора элонгации EF1.
2 стадия – это пептидилтрансферазная реакция. Образуется дипептидил-тРНК. Метионин тРНК (меттРНК) переносится на α- аминогруппу аминокислоты (валина), находящейся в А-центре в составе аминоацил-тРНК (аа-тРНК), образуется дипептидил-тРНК. Пептидилтрансферазную активность проявляет рРНК большой субъединицы рибосомы.
3 стадия – перемещение рибосомы по мРНК. Пептидил тРНК перемещается из А участка в Р-участок, и одновременно рибосома перемещается к следующему аа-тРНК. Затем новая аминоацил-тРНК связывается со свободным А участком и начинается новый цикл реакции (используется энергия ГТФ), используется фактор элонгации EF2. Иными словами – дипептидил тРНК (мет-вал-тРНК) из А центра попадает в Р-центр, а в А центре оказывается следующий кодон.
3 этап - терминация– заключительный этап синтеза белка. Включение в А-центр стоп кодона (UAG, UGA, UAA) – это сигналы терминации, которые в молекуле тРНК считываются фактором освобождения. Образование функционально активных белков – происходит в результате посттрансляционных модификаций полипептидных цепей.
10. Посттрансляционные изменения белков.
Многие белки синтезируются в неактивном виде (предшественники) и после схождения с рибосом подвергаются постсинтетическим структурным модификациям. Эти конформационные и структурные изменения полипептидных цепей получили название посттрансляционных изменений. Они включают удаление части полипептидной цепи (частичный протеолиз), ковалентное присоединение одного или нескольких низкомолекулярных лигандов, связывание между собой субъединиц олигомерного белка, приобретение белком нативной конформации (фолдинг).
При частичном протеолизе, например, неактивные предшественники секретируемых ферментов – зимогены – образуют активный фермент после расщепления по определенным участкам молекулы. Наглядным примером последовательного протеолиза служит и образование активных форм инсулина или глюкагона из препрогормонов.
В ходе ковалентных модификаций структурные белки и ферменты могут активироваться или инактивироваться в результате присоединения различных химических групп: фосфатных, ацильных, метильных, олигосахаридных и др. Многочисленным модификациям подвергаются боковые радикалы некоторых аминокислот: в тиреоглобулине йодируются остатки тирозина, в факторах свертывания крови карбоксилируются остатки глутамата, в цепях тропоколлагена гидроксилируются остатки пролина и лизина.
У некоторых белков на N-конце имеются короткие последовательности гидрофобных аминокислотных остатков, которые называют сигнальными последовательностями. Эти участки играют важную роль в транспорте белков через мембраны. В процессе переноса через мембрану сигнальная последовательность отщепляется сигнальной пептидазой. В итоге белок приобретает функциональную активность, оказавшись в соответствующей органелле или вне клетки.
Существование посттрансляционной модификации расширяет возможности клеток в регуляции метаболизма. Изменения количества или активности ферментов, участвующих в модификации белков, приводят к снижению или увеличению концентрации последних, что отражается на скорости соответствующих процессов.
1. Биологическое значение апоптоза. Роль белков р53 и ВСL-2 как регуляторов апоптоза.
Биологическое значение апоптоза:
1.Нормализация развития организма в период эмбриогенеза. Врожденные дефекты возникают из-за недостаточности апоптоза.
2.Предотвращение размножения мутирующих клеток.
3.Регуляция иммунной системы.
4.Предотвращение старения организма.
В процессе апоптоза усыхает до1/3 объема клеток, это следствие активация белков, факторов транскрипции и генных факторов. Процесс затрагивает одиночные клетки, и не распространяется на целые участки, сохраняя их. Апоптоз имеет ключевое значение для завершения развития организма, планомерно заменяя старые клетки новыми. Выделяют гормонозависимую апоптотическую гибель. Например, регрессия молочной железы после прекращения лактации. Сигналом к активации белков является ионизирующее излучение, АФК, Cрадикалы, недостаток факторов роста, фактор некроза опухоли (ФНО), антитела. Ускорение апоптоза происходит при ВИЧ-инфекциях.
P53 белок является регулятором генной стабильности, вызывая арест митотического цикла и апоптоз во многих нетрансформированных и неопластических клеточных системах
при активации Р-53 он способен независимо друг от друга инициировать две программы развития событий: временную остановку (арест) клеточного цикла в фазе G1 с помощью белка Р-21, либо стимуляцию апоптоза через активацию проапоптотических генов семейства Всl 2 Проапоптотическое действие белка Р-53 реализуется также и на уровне митохондрий – через подавление экспрессии антиапоптотического белка Всl 2, куда он поступает из ядра клетки.
2. Фазы апоптоза. Биохимические маркеры.
Фазы апоптоза
1.сигнальная (индукторная);
2.эффекторная;
3.деградационная (фаза экзекуции или деструкции)
Сигнальная фаза
Инициация апоптоза может происходить посредством внешних (внеклеточных) или внутриклеточных факторов. Например, в результате гипоксии, гипероксии, субнекротического поражения химическими
или физическими агентами, перекрёстного связывания соответствующих рецепторов, нарушения сигналов клеточного цикла, удаления факторов роста и метаболизма и т.д. Несмотря на разнообразие инициирующих факторов, выделяются два основных пути передачи сигнала апоптоза: рецепторзависимый (внешний) сигнальный путь с участием рецепторов гибели клетки и митохондриальный (собственный) путь.
Эффекторная фаза
В течение эффекторной фазы различные инициирующие пути конвертируются в один (или несколько) общий путь апоптоза. Как правило, происходит активация каскада белков-эффекторов и регулирующих их белков-модуляторов. Основными эффекторами апоптоза являются каспазы. В процессе активации они запускают каспазный каскад: сложно переплетённые цепочки взаимодействий инициирующих и эффекторных каспаз.
Деградационная фаза
Итогом программируемой клеточной гибели вне зависимости от изначального инициирующего воздействия является деградация клетки путём фрагментации на отдельные апоптотические тельца, ограниченные плазматической мембраной. Фрагменты погибшей клетки обычно очень быстро (в среднем за 90 минут) фагоцитируются макрофагами либо соседними клетками, минуя развитие воспалительной реакции.
3. Характеристика путей сигнальной фазы апоптоза: рецептторзависимый путь.
Выделяют два основных пути передачи сигнала апоптоза:
а) рецептор-зависимыйсигнальныйпуть (участие рецепторов гибели клетки);
б) митохондриальныйпуть.
Рецептор-зависимыйсигнальныйпуть предназначен для включения апоптоза. Передача сигнала апоптоза идет при участии рецепторов гибели клетки – смерти. Внеклеточныйлиганд взаимодеиствует̆ с рецепторами клеточнойгибели на поверхности клеточноймембраны
Рецепторы клеточнойгибели (смерти) – это трансмембранные белки (80 аминокислот в цитоплазматическом домене). Эта аминокислотная последовательность называется доменом смерти-DD, она необходима для передачи сигнала апоптоза (трансформация). Внеклеточные участки рецепторов смерти взаимодеиствуют̆ с тримерами лигандов (ФНО, СD95L, Apo2L, Apo3L). Взаимодеиствиӗ
рецептора и лиганда приводит к образованию кластеров рецепторных молекул и связыванию их с адапторами (каркас), образуя тримерныйкомплекс.
Тримеры лигандов в результате взаимодеиствия̆ тримеризуют рецепторы смерти (т.е. «сшивают» 3 молекулы рецептора).
Адаптер, ассоциированныйс рецептором смерти вступает во взаимодеиствиӗ с эффекторами – еще пока неактивными предшественниками протеаз из семеиствӑ инициирующих каспаз с прокаспазами. В результате из цепочки взаимодеиствия̆ «лиганд - рецептор - адаптер - эффектор» формируется агрегаты, в которых происходит активация каспаз. Эти агрегаты называются апоптосомами, апоптозными шаперонами или сигнальными комплексами, инициирующими смерть. Посредством рецепторов смерти могут быть активированы 3 инициирующие каспазы (-2, -8, -10). Активированные инициирующие каспазы далее участвуют в активации эффекторных каспаз – «казнящие каспазы».
4. Митохондриальный сигнальный путь
Митохондриальныйсигнальныйпуть (входит в сигнальную фазу) апоптоза реализуется в результате выхода апоптогенных беков из межмембранного пространства митохондрийв цитоплазму клетки. Высвобождение апоптогенных белков, предположительно, может осуществляться двумя путями: за счет разрыва митохондриальноймембраны или же путем открытия высокопроницаемых каналов на внешней мембране митохондрии.̆ Разрыв внешнеймембраны митохондрийобъясняется увеличением объема
(набуханием) митохондриального матрикса. Данныйпроцесс связываются с раскрытием пор митохондриальноймембраны, приводящим к снижению мембранного потенциала и набуханию митохондрийв следствие осмотического дисбаланса (поры диаметром 2,6 – 2,9 нм способны пропускать низкомолекулярные вещества массойдо1,5 кДа). Раскрытие пор стимулируют следующие факторы: неорганическийфосфат; каспазы; SH-реагенты; истощение клеток восстановленным глутатионом; образование активных форм кислорода; разобщение окислительного фосфорилирования
протонофорными соединениями; увеличение содержания Са2+ в цитоплазме; воздеиствиӗ церамида; истощение митохондриального пула АТФ и др.
В качестве альтернативного пути выхода апоптогенных белков из межмембранного пространства митохондрийрассматривается вариант образования белкового канала во внешнеймитохондриальной мембране. Цитохром с в цитоплазме клетки участвует в формировании апоптосомы вместе с белком
Apаf-1 (от англ. аpoptosis protease activating factor-1 – «фактор активации протеаз апоптоза»).
Предварительно, Apаf-1 претерпевает конформационные изменения в результате (частичныйпротеолиз) реакций, протекающейс затратойАТФ. Предполагается, что трансформированныйApаf-1 приобретает способность связывать цитохром с.
5. Эффекторная фаза. Каспазный каскад.
В течении эффекторнойфазы различные инициирующие пути конвертируются в один (или несколько) общийпуть апоптоза. Как правило, происходит активация каскада белков-эффекторов и регулирующих их белковмодуляторов. Основными эффекторами апоптоза являются каспазы. В процессе активации они запускают каспазныйкаскад: сложно переплетенныё цепочки взаимодеиствий ̆инициирующих и эффекторных каспаз.
Каспазныйкаскад – это последовательность активации каспазы путем̈ протеолитического расщепления прокаспазы на большую и малую субъединицы с их последующейассоциациеи.̆ Каспазы представляют собойцистеиновые протеазы, которые расщепляют аминокислотные последовательности после остатка аспарагиновойкислоты. Каспазы образуются за счет̈ активации прокаспаз (молекулярная масса 32—56 кДа), в составе которых выделяют 3 домена: регуляторныйN-концевойдомен (продомен), большую (17—21 кДа) и малую (10—13 кДа) субъединицы. Активация происходит путем̈ протеолитического процессинга: все три домена расщепляются, отделяется продомен, а оставшиеся большая и малая субъединицы ассоциируются, образуя гетеродимер. Два гетеродимера в дальнеишем̆ формируют тетрамер — полноценную каспазу с двумя каталитическими участками.
Инициаторные каспазы активируют эффекторные каспазы, которые в свою очередь провоцируют и непосредственно участвуют в трансформации клетки. Функциональные взаимодеиствия̆ между инициирующими и эффекторными каспазами, например, каспаза-2 может существовать в форме двух изомеров, один из которых инициирует, а другойподавляет апоптоз. В итоге морфологические и биохимические изменения приводят к гибели клетки по типу апоптоза.
Одна из основных функцийэффекторных каспаз заключается в прямом и опосредованном разрушении клеточных структур. Гидролизу подвергаются ядерные белки ламины, разрушается цитоскелет, расщепляются белки, регулирующие клеточную адгезию.
6. Дополнительные эффекторы апоптоза.
Помимо каспаз существуют и другие эффекторы апоптоза. Например, флавопротеин AIF, высвобождающиися̆ из межмембранного пространства митохондрии,̆ деиствует̆ по независимому от каспаз пути. Попадая в клеточное ядро, AIF вызывает конденсацию хроматина и активирует эндонуклеазы, которые участвуют во фрагментации ДНК.
7. Значение теломеров для жизнедсятельности клеток, Функции теломер. Лимит Хайфлика.
Теломеры – концевые участки хромосом, которые не несут
