
- •6. Схема биосинтеза пиримидиновых нуклеотидов в тканях.
- •7. Распад пиримидиновых нуклеотидов в тканях.
- •1.Матричные биосинтезы в организме: репликация, репарация (биосинтез дНк); транскрипция (биосинтез м-рнк, р-рнк, т-рНк). Трансляция (биосинтез белка). Общая характеристика.
- •2. Pепликация днк, характеристика процесса, механизм, субстраты, этапы, ферменты, биологическое значение
- •3. Репарация днк, характеристика, субстраты, этапы, ферменты, биологическое значение.
- •4. Транскрипция, биосинтезы м-рнк, р-рнк, т-рнк. Этапы, ферменты, субстраты, биологическое значение. Регуляция транскрипции. Биологическое значение.
- •5. Генетический код и его свойства.
- •6. Подготовка аминокислот к биосинтезу белка: характеристика и функции адаптационных молекул, синтез аминоацил-т-phk Субстратная специфичность
- •9. Этапы трансляции (биосинтеза белка): инициация, элонгация, терминация. Субстраты, ферменты, факторы, энергия
- •10. Посттрансляционные изменения белков.
- •1. Биологическое значение апоптоза. Роль белков р53 и всl-2 как регуляторов апоптоза.
- •2. Фазы апоптоза. Биохимические маркеры.
- •Сигнальная фаза
- •Эффекторная фаза
- •Деградационная фаза
- •3. Характеристика путей сигнальной фазы апоптоза: рецептторзависимый путь.
- •4. Митохондриальный сигнальный путь
- •5. Эффекторная фаза. Каспазный каскад.
- •6. Дополнительные эффекторы апоптоза.
- •7. Значение теломеров для жизнедсятельности клеток, Функции теломер. Лимит Хайфлика.
- •8. Теломераза и теломеразный комплекс.
- •9. Роль теломеразы в иммортализации.
- •10, Физические, химические и бнологические агенты, вызываюцие возникновение опухолей.
- •11.Характеристика опухолевых клеток.
- •12. Онкогены, протоонкогены, гены-супрессоры опухолей.
- •13. Механизмы неопластической трансформации. Инвазия и метастазировиние.
- •14. Понятие о пцр. Применение метода пцр в лабораторной практике.
- •15. Основные этапы проведения пцр. Понятие о репликации и амплификации.
- •16. Основные отличия раковых клеток от здоровых. Причины аномалий клеток Понятие о митозе и митогенах.
- •18. Иммунюконьюгаты, Всктор иммуноконогата. Вещества, используемые в качестве вскторов адресной доставки. Ренстторно-овосредованный эндоцитоз.
- •19. Эпидермальный фактор роста (эфр) и а-фетопротсин (афп). Преимущества эфр и афп при и использовании в качестве вскторов. Репепторы эфр и афп и и характеристика.
- •20. Тералевтические противоопухолевые компоненты иммуноконьюгатов на оспове МоА т, эфр, афп.
- •21. Фтазощианины. Понятие о антисмысловых нуклеотилах.
4. Транскрипция, биосинтезы м-рнк, р-рнк, т-рнк. Этапы, ферменты, субстраты, биологическое значение. Регуляция транскрипции. Биологическое значение.
I. Транскрипция – это биосинтез РНК на ДНК-матрице, образуются первичные транскрипты мРНК, тРНК, рРНК, комплиментарные матричной цепи ДНК.
Субстраты и источники энергии: нуклеозидтрифосфаты (АТФ, ГТФ, ЦТФ, УТФ).
Ферменты – РНК-полимеразы (I, II, III).
II. В транскрипции участвуют следующие сайты ДНК:
1. Промотор – сайт ДНК, в которой РНК – полимераза связывается с матрицей (ДНК) и начинает синтез РНК.
2. Сайт терминации – это участок ДНК, на котором завершается синтез РНК.
3. Транскриптон – участок ДНК, ограниченный промотором и сайтом терминации.
III. Стадии транскрипции:
1 стадия – инициация (т.е. активация промотора): сайт ДНК (промотор) связывается с РНК-полимеразой с помощью ТАТА-фактора (специфическая последовательность нуклеотидов промотра сайта ДНК для посадки РНК-полимеразы). РНК-полимераза на этом этапе обеспечивает локальное расплетение двойной спирали.
2 стадия – элонгация. По мере продвижения РНК-полимеразы по цепи ДНК в направлении 3՛ → 5՛ впереди нее происходит расхождение, а позади – восстановление двойной спирали.
3 стадия – терминация – когда РНК-полимераза достигает сайта терминации (завершение синтеза), транскрипция прекращается. Факторы терминации облегчают отделение первичного транкрипта от матрицы. Образуются пре-мРНК, претРНК, прерРНК – это образование из пре РНК – мРНК, тРНК, рРНК.
5. Генетический код и его свойства.
Синтез белка отличается от других матричных биосинтезов тем, что между матрицей (мРНК) и продуктом – белком нет комплементарного соответствия, т.к. матрица ДНК построена из 4 нуклеотидов, а полипептидная цепь из 20 аминокислот, т.е. четырех буквенный язык нуклеиновых кислот переводится на язык белков из 20 букв.
Генетический код – это способ записи информации об аминокислотной последовательности белков с помощью последовательности нуклеотидов в ДНК и РНК. Его характеризуют следующие свойства: триплетность и наличие терминирующих кодонов, специфичность, вырожденность, универсальность, однонаправленность, колинеарность.
Триплетность и наличие терминирующих кодонов – кодовое число равно 3: 3 нуклеотидных остатка (триплет) кодируют 1 аминокислоту. Терминирующие триплеты – UAA, UAG, UGA не кодируют аминокислот, а являются сигналами к прекращению синтеза белка.
Специфичность – каждый триплет кодирует только 1 аминокислоту.
Вырожденность – 1 аминокислоту могут кодировать несколько триплетов (от 2 до 6).
Универсальность – почти у всех видов организмов биологический код одинаков.
Однонаправленность– информация, записанная в зрелой мРНК в виде линейной последовательности кодонов (триплетов) считывается в направлении от 5՛- к 3՛-концу.
Колинеарность–последовательность кодонов в зрелой мРНК соответствует последовательности аминокислот в синтезированном белке.
6. Подготовка аминокислот к биосинтезу белка: характеристика и функции адаптационных молекул, синтез аминоацил-т-phk Субстратная специфичность
Аминокислоты синтезируются из промежуточных соединений, образующихся в процессах гликолиза и цикла лимонной кислоты (цикла Кребса). Предшественниками всех аминокислот в организме являются пять соединений: 3-фосфоглицерат, фосфоенолпируват, пируват, оксалоацетат и а-кетоглутарат. Эти соединения вместе с двумя моносахаридами пентозофосфатного пути служат предшественниками всех аминокислот в бактериях и растениях.
Фундаментальное значение для биосинтеза всех аминокислот во всех организмах имеет реакция образования глутаминовой кислоты (глутамата) из аммиака и а-кетоглутаровой кислоты (а-кетоглутарата) под действием фермента глутамат- дегидрогеназы:
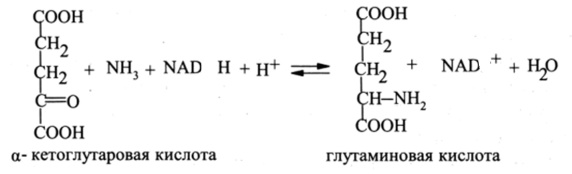
Трансаминирование а-кетокислот с использованием глутаминовой кислоты в качестве донора аминогруппы представляет собой основной путь введения а-аминогруппы при биосинтезе большинства других аминокислот.
