
- •Ферменты. Номенклатура. Классификация ферментов
- •6 Билет
- •3. Пигмент билирубин????
- •3) Молекулярные механизмы патогенеза острого панкреатита.
- •14 Билет
- •2) Функции сосудистого эндотелия, субэндотелия, тромбоцитов.
- •3) Диагностика панкреатита.
- •16 Билет.
- •3 Метаболические механизмы алкоголизма.
- •3) Моногенные заболевания.
- •3) Полиморфизм гена апобелка е, клиническое значение.
- •21 Билет
- •2. Особенности метаболизма и энергетического обмена в клетках поперечно-полосатой мускулатуры и миокарда.
- •2) Характеристика и роль фибриллярных и регуляторных белков в процессе мышечного сокращения. Механизм мышечного сокращения, этапы. Роль ионов кальция в реализации механизма мышечного сокращения.
- •2. Кальцитриол: химическая природа, этапы синтеза, механизм действия, органы-мишени, биологические эффекты. Представление о заболевании «рахит».
- •26 Билет
- •2) Адреналин- химическая природа, органы мишени, биологические эффекты.
- •3) Моноклональные антитела, препараты на их основе против опухолей.
- •27 Билет
- •1. Понятие о процессах катаболизма и анаболизма. Функции клеточного метаболизма. Стадии генерирования энергии по Кребсу.
- •2. Ферментативные системы антирадикальной защиты. Катализируемые реакции.
- •3. Вектор иммуноконъюгата. Вещества, используемые в качестве векторов адресной доставки.
- •2.Типы переваривания*. Функции жкт как пищеварительно-транспортного конвейера*. Функции слюны*. Функции жёлчных кислот*.
- •3.Эпидермальнвй фактор роста и а-фетопротеин : их использование в качестве векторов.
- •1) Биосинтез триацилглицеринов (таг): последовательность реакций, субстраты, ферменты. Особенности синтеза в печени, жировой ткани, энтероцитах. Регуляция процесса.
- •3) Понятие о рекомбинантных днк.
- •2) Неферментативные системы антирадикальной защиты и их физиологическое значение.
- •2. Действие первичных и вторичных продуктов перекисного окисления на мембраны и другие структуры.
- •3. Действие наркотиков. Дофаминовая система.
- •1. Разобщители цпэ.
- •2. Пути обезвреживания аммиака.
- •3. Теломеразная активность.
- •38 Билет
3) Полиморфизм гена апобелка е, клиническое значение.
АpoE (аллельный полиморфизм гена aполипопротеина Е) — генетический маркёр риска нарушений липидного обмена. Синтезируется в печени и головном мозге. Ген ApoE кодирует белок аполипопротеин E, участвующий в обмене липидов в крови (антиатеросклеротическое действие) и холестерина в мозге. Аполипопротеин E является компонентом хиломикронов и ЛПОНП плазмы крови, которые образуются в тонком кишечнике из всасываемых жиров и подвергаются эндоцитозу в печени, обеспечивает их рецепцию, а также обеспечивает перенос холестерина из глии в нейроны мозга.
Задача. У больного обнаружена глюкоза в моче, концентрация глюкозы в крови – 11 ммоль/л, содержание С-пептида – ниже нормы. С-пептид освобождается при образовании активной формы инсулина. Снижение содержания С-пептида говорит о снижении синтеза инсулина, т.е., сахарном диабете I типа.
21 Билет
1. Схема переваривания пищевых липидов в ЖКТ: этапы, субстраты, ферменты, роль продуктов гидролиза, роль жёлчных кислот.
Липиды пищи: ТГ-триглицерид, холестерол, фосфолипиды. ДГ-диглицерид, МГ-моноглицерид, ЖК-желчные кислоты.
Р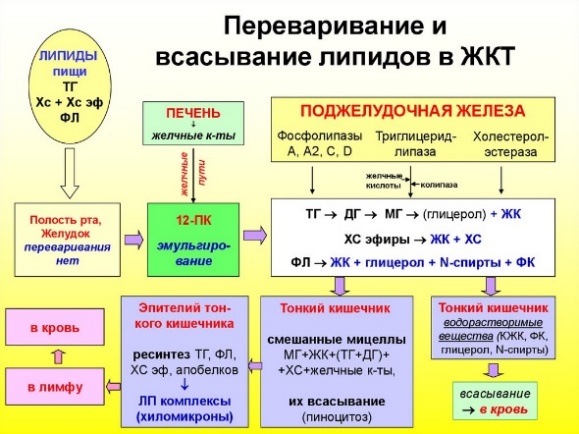 отовая
полостьжелудок12-перстная
кишкатонкий
кишечникэпителий
тонкой кишкикровьлимфа
отовая
полостьжелудок12-перстная
кишкатонкий
кишечникэпителий
тонкой кишкикровьлимфа
**Основные функции кислот заключаются в образовании мицелл, эмульгировании жиров и солюбилизации липидов в кишечнике, что повышает эффективность действия панкреатической липазы и способствует всасыванию липидов. Желчные кислоты также участвуют в регуляции синтеза холестерина, сводя к минимуму нарастание или недостаток холестерина в организме, и регуляции образования и выделения желчи.
***Стеаторея — это патологическое состояние, при котором с калом выделяется более 7 г жира в сутки. Проявляется обильным неоформленным стулом с маслянистым блеском, наличием непереваренных частиц в кале, вздутием и нелокализованной абдоминальной болью.
Первичные (изолированные) формы заболевания наблюдаются при врожденном поражении поджелудочной железы — дисплазии, гипоплазии и аплазии органа, наследственном дефиците панкреатической липазы. Причинами вторичной (симптоматической) стеатореи являются другие патологические состояния:
Болезни поджелудочной железы. Для гидролиза жиров необходимы панкреатические ферменты липаза и колипаза. Их продукция и секреция нарушается при хроническом панкреатите, объёмных образованиях поджелудочной железы, обструкции панкреатических протоков.
Заболевания желудка. Недостаточное всасывание жиров в кишечнике отмечается при снижении секреторной функции желудочного эпителия. Признаки стеатореи выявляются при хроническом гастрите с пониженной секрецией, ахилии и болезнях оперированного желудка.
Эндокринные болезни. У больных, страдающих сахарным диабетом, причиной стеатореи служит диабетическая энтеропатия и сопутствующая целиакия. Высокое содержание жировых веществ в кале также обнаруживается при полигландулярном синдроме с гипопаратиреозом.
2. Особенности метаболизма и энергетического обмена в клетках поперечно-полосатой мускулатуры и миокарда.
Мышцы являются главным местом катаболизма аминокислот с разветвленной цепью. Мышечная ткань окисляет лейцин до СО2 и превращает углеродный скелет аспартата, аспарагина, глутамата, изолейцина и валина в субстраты ЦТК. В мышцах выражен катаболизм липидов. Жирные кислоты, кетоновые тела в аэробных условиях окисляются в мышцах для получения энергии. В мышцах преобладает катаболизм углеводов. Глюкоза окисляется в аэробных или анаэробных условиях для синтеза АТФ. Из глюкозы в мышцах образуется аланин. Глюкоза, поступившая из крови и образовавшаяся в глюконеогенезе, запасается в мышцах в форме гликогена (до 1–2% от массы мышцы).
Основным источником энергии, обеспечивающим основную механическую деятельность миокарда, является АТФ. Энергетические процессы миокардиоцита протекают в митохондриях. Первичным энергетическим субстратом в мышце сердца являются жирные кислоты, глюкоза, лактат (молочная кислота), пируват (пировиноградная кислота), кетоновые тела и, в меньшей степени, аминокислоты. Эти вещества поступают в миокардиоциты из плазмы крови. Из общего числа липидов из плазмы крови в миокардиоциты путем пассивной диффузии через клеточную мембрану проникают только свободные жирные кислоты.
Креатинфосфат образуется из АТФ и креатина (который в свою очередь синтезируется из глицина, аргинина и метионина в печени и с током крови поступает в мышцы) в период расслабления мышцы, когда потребность в АТФ снижается.
Миоаденилаткиназная реакция. Миоаденилаткиназа - фермент мышц, катализирующий образование АТФ из 2-х молекул АДФ: АДФ + АДФ = АТФ + АМФ
3. Концепция «двууглеродного голода».
Деградация систем эндогенного синтеза ацетальдегида???
Задача. В эксперименте с культурой клеток обнаружено, что при активации ПОЛ повышается концентрация ионов Са2+ в цитоплазме. В норме ионы кальция могут проникнуть внутрь клетки через ионные каналы. В ходе ПОЛ в мембране образуются гидрофильные поры, что увеличивает проницаемость мембраны. Кроме того, ПОЛ может нарушить функционирование кальциевого насоса (прямым повреждением и в результате снижения синтеза АТФ).
Билет 23
1) Активные формы кислорода (АФК). Биологическое действие АФК. Ферментативные и неферментативные системы, генерирующие АФК.
*Активные формы кислорода – перекись водорода (Н2О2), озон (О3) и синглетный кислород (1О2), гипохлорит (HOCI); ионы – НО2–, пероксинитрит (ONOO–); свободные радикалы – супероксидный (О2 ), гидроксильный (НО•), пергидроксильный (НО2•), пероксильный (RO2•), алкоксильный.
**Избыток свободных радикалов при гипоксии и патологических состояниях направлен на: (1) мембраны, т.к. полиненасыщенные жирные кислоты, содержащиеся в фосфолипидах, чувствительны к свободным радикалам; (2) нуклеиновые кислоты – вызывают нарушения мультипликации, трансмиссии и репликации генетической информации в хромосомах; (3) белки, содержащие сульфгидридные группы (например, Ca-АТФ-аза). Свободные радикалы способствуют образованию сшивок в белках, деградации их и аминокислот (альбумины, липопротеиды).
NO-: регулирует тонус сосудов, ингибирует адгезию и агрегацию тромбоцитов. Пероксиды, супероксидный анион-радикал, гипогалогениты: микробицидное дей-е (антимикробная защитагрудного молока, фагоцитоз), индукция клеточной пролиферации (лимфоциты), метаболизм Fe2+. HO2•, HO•, OH-: включают программу апоптоза заряженной клетки.
***Ферментативная антикосидантная система:
Супероксиддисмутаза(СОД) превращает супероксидные анионы в перекись водорода: 2О∙2 + 2H+ → H2O2+ O2.
Каталаза- геминовый фермент, катализирует реакцию разрушения перекиси водорода: 2Н2О2 → H2O+ O2. Находится в основном в пероксисомах, где образуется наибольшее количество перекиси водорода, а также в лейкоцитах, где она защищает клетки от последствий «респираторного взрыва» и в эритроцитах, где она защищает гем гемоглобина от окисления.
Глутатионпероксидаза— обеспечивает разрушение перекиси водорода и гидропероксидов липидов при окислении глутатиона (у-глутамилцистеинилглицин): Н2О2+ 2 GSH → 2 Н2О + G-S-S-G. Глутатионпероксидаза в качестве кофермента содержит селен. Глутатионредуктаза восстанавливает окисленный глутатион с участием НАДФН2: GS-SG + НАДФН2 → 2 GSH + НАДФ+.
Недостаток глутатиона в клетках, например эритроцитах, который может быть обусловлен действием токсических веществ, например ионами тяжелых металлов или наследственным недостатком глутатионредуктазы приводит к активации перекисного окисления; это, в частности, наблюдается при некоторых видах гемолитических анемий.
Фосфолипаза в мембране отщепляет от фосфолипидов окисленные жирные кислоты, содержащие гидроперекисную группу (LOOH), тем самым разрушаются гидроперекиси липидов, предотвращается разветвление цепей окисления липидов в мембранах.
Неферментативная антиоксидантная система.
"Липидные антиоксиданты" - производные фенола, способны инактивировать свободные радикалы в гидрофобном слое мембран и предотвращать развитие ПОЛ. К ним относится α-токоферол (витамин Е), убихинон (коэнзим Q), тироксин.
Витамин С ингибирует СРО с помощью двух различных механизмов: 1) восстанавливает в мембранах клеток токоферолхинон до витамина Е; 2) взаимодействует с активными формами кислорода — О∙2, Н2О2, НО∙и инактивирует их.
β-Каротин, предшественник витамина А, также обладает антиоксидантным действием и ингибирует ПОЛ. 2) Этапы катаболизма жирных кислот: реакции, ферменты. Энергетический эффект полного окисления С16:0. Регуляция процесса β-окисления ВЖК
*Катаболизм жирных кислот в живых организмах протекает в три стадии:
1)
β-окисление ‒ специфический путь
окисления свободных жирных кислот,
заканчивающийся образованием ацетил-СоА.
Происходит в матриксе митохондрий в
аэробных условиях. Каждый цикл включает
реакции дегидрирования, гидратация,
дегидрирование, отщепление ацетил-КоА.
Продукты каждого цикла β-окисления –
ФАДН2, НАДН2 и ацетил-КоА. Регуляция:
карнитинацилтрансфераза I,
с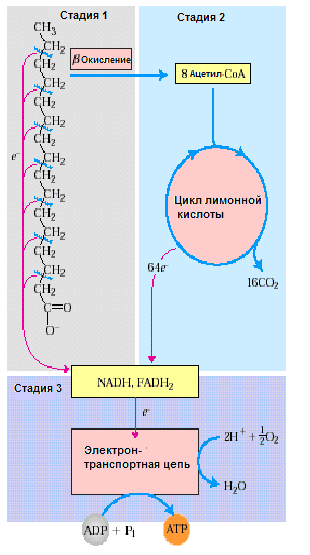 пособ
регуляции – аллостерическое ингибирование
(ингибитор малонил-КоА).
пособ
регуляции – аллостерическое ингибирование
(ингибитор малонил-КоА).
Ок-нию жирных к-т предшествует: активация ВЖК в цитоплазме; транспорт ее через мембрану в матрикс митохондрий.
Цикл бета-ок-ния состоит из 4 р-й:
1.Р-я дегидрирования (ф-нт ацил-КОА-дегидрогеназа) происходит отщепление 2х атомов водорода с образ транс-еноил-КОА и вос-ный ФАДН2.
2.Р-я гидратации (ф-нт гидратаза) образ L-3-гидроксиацил-КОА.
3.Р-я дегидрирования (ф-нт 3-гидроксиацил-КОА-дегидрогеназа, кофермент – НАД+) в ходе р-и образ 3-кетоацил-КОА.
4. Тиолитическое расщепление (ф-нт тиолаза) 3-кетоацил-КОА расщепляется на ацетил-SКОА и укороченный ацил-SКОА.
2) цикл лимонной кислоты, в котором осуществляется расщепление ацетильных остатков, образовавшихся при β-окислении ЖК;
3) окислительное фосфорилирование в дыхательной цепи с образованием АТФ за счет энергии NADH и FADН2.
Энергетический эффект полного окисления С16:0 в ходе 4 последовательных этапов образ:
1.бета-ок-ние: 35 АТФ
2.ЦТК: 12 АТФ
3.ок-ное фосфорилирование: 96 АТФ Итого: 35+96 – 1 = 130 АТФ (1 АТФ на активацию ВЖК)
Регуляция бета-окисления осуществляется на этапе транспорта жирных к-т через мембрану митохондрии (регуляторный фермент карнитинацилтрансфераза-1). Для нервной ткани характерно альфа-ок-ние ВЖК. Тк при этом ок-нии от углеводородной цепи отщепляется по одному атому углерода в виде СО2.
3) Сущность молекулярной адаптации к хроническому действию наркотических веществ. Задача.
Результат анализа мочи: суточный объём – 1,3 л, цвет – «тёмного пива», прозрачность – неполная, плотность – 1058 кг/м3, реакция – слабокислая, осадок – нет, белок – следы, глюкоза – нет, кетоновые тела – нет, эритроциты – нет, лейко- циты – 3-6×', уробилин – следы, билирубин – большое количество, жёлчные кислоты – (+). Да, характерные для подпечёночной (обтурационной) желтухи.
Билет 23-2
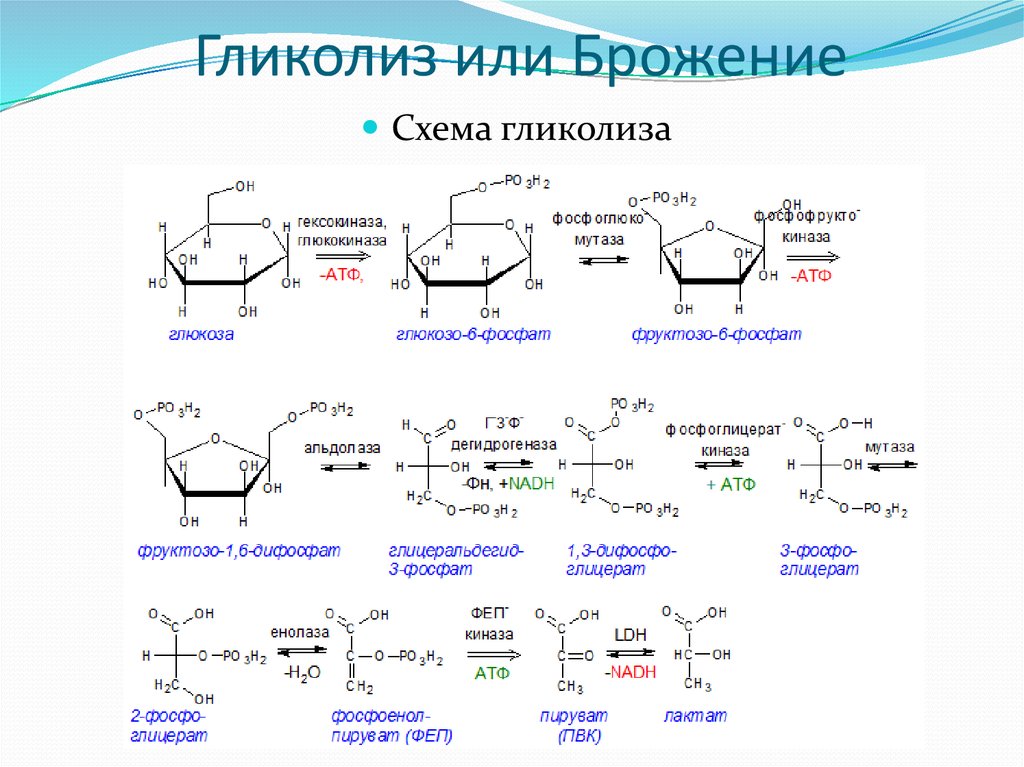
Анаэробный распад глюкозы (анаэробный гликолиз). Судьба продуктов гликолиза в анаэробных условиях. Биологическое значение анаэробного распада глюкозы. Цикл Кори.
*Анаэробным гликолизом называют процесс расщепления глюкозы с образованием в качестве конечного продукта лактата. Этот процесс протекает без использования кислорода и поэтому не зависит от работы митохондриальной дыхательной цепи. АТФ образуется за счёт реакций субстратного фосфорилирования. Суммарное уравнение процесса: С6Н1206 + 2 Н3Р04 + 2 АДФ = 2 С3Н6О3 + 2 АТФ + 2 Н2O.
 Основное
физиологическое назначение катаболизма
глюкозы заключается в использовании
энергии, освобождающейся в этом процессе
для синтеза АТФ. Энергия, выделяющаяся
в процессе полного распада глюкозы до
СО2
и Н2О,
составляет 2880 кДж/моль.
Основное
физиологическое назначение катаболизма
глюкозы заключается в использовании
энергии, освобождающейся в этом процессе
для синтеза АТФ. Энергия, выделяющаяся
в процессе полного распада глюкозы до
СО2
и Н2О,
составляет 2880 кДж/моль.
Первый этап гликолиза – подготовительный, здесь происходит затрата энергии АТФ, активация глюкозы и образование из нее триозофосфатов. 1-5 реакции.
Второй этап гликолиза – это освобождение энергии, содержащейся в глицеральдегидфосфате, и запасание ее в форме АТФ. 6-11 реакции.
Последняя реакция бескислородного окисления глюкозы, одиннадцатая – образование молочной кислоты из пирувата под действием лактатдегидрогеназы. Важно то, что эта реакция осуществляется только в анаэробных условиях. Эта реакция необходима клетке, так как НАДН, образующийся в 6-й реакции, в отсутствие кислорода не может окисляться в митохондриях.
**Судьба лактата образовавшегося при анаэробном гликолизе. Накопившийся в ходе гликолиза лактат при поступлении кислорода в клетку начинает постепенно превращаться обратно в ПВК. Часть этого пирувата вступает в реакции окислительного декарбоксилирования и ЦТК. АТФ, образующаяся при этом, используется для синтеза из оставшегося количества ПВК глюкозы или гликогена (в условиях покоя). Процесс синтеза глюкозы или гликогена из лактата называется обращением гликолиза. Образование углеводов (например, глюкозы) из веществ, имеющих не углеводное происхождение называют глюконеогенезом.
*** Многие клетки организма способны к анаэробному окислению глюкозы. Для эритроцитов он является единственным источником энергии. Клетки скелетной мускулатуры за счет бескислородного расщепления глюкозы способны выполнять мощную, быструю, интенсивную работу, как, например, бег на короткие дистанции, напряжение в силовых видах спорта. Вне физических нагрузок бескислородное окисление глюкозы в клетках усиливается при гипоксии – при различного рода анемиях, при нарушении кровообращения в тканях независимо от причины.
