
- •Ферменты. Номенклатура. Классификация ферментов
- •6 Билет
- •3. Пигмент билирубин????
- •3) Молекулярные механизмы патогенеза острого панкреатита.
- •14 Билет
- •2) Функции сосудистого эндотелия, субэндотелия, тромбоцитов.
- •3) Диагностика панкреатита.
- •16 Билет.
- •3 Метаболические механизмы алкоголизма.
- •3) Моногенные заболевания.
- •3) Полиморфизм гена апобелка е, клиническое значение.
- •21 Билет
- •2. Особенности метаболизма и энергетического обмена в клетках поперечно-полосатой мускулатуры и миокарда.
- •2) Характеристика и роль фибриллярных и регуляторных белков в процессе мышечного сокращения. Механизм мышечного сокращения, этапы. Роль ионов кальция в реализации механизма мышечного сокращения.
- •2. Кальцитриол: химическая природа, этапы синтеза, механизм действия, органы-мишени, биологические эффекты. Представление о заболевании «рахит».
- •26 Билет
- •2) Адреналин- химическая природа, органы мишени, биологические эффекты.
- •3) Моноклональные антитела, препараты на их основе против опухолей.
- •27 Билет
- •1. Понятие о процессах катаболизма и анаболизма. Функции клеточного метаболизма. Стадии генерирования энергии по Кребсу.
- •2. Ферментативные системы антирадикальной защиты. Катализируемые реакции.
- •3. Вектор иммуноконъюгата. Вещества, используемые в качестве векторов адресной доставки.
- •2.Типы переваривания*. Функции жкт как пищеварительно-транспортного конвейера*. Функции слюны*. Функции жёлчных кислот*.
- •3.Эпидермальнвй фактор роста и а-фетопротеин : их использование в качестве векторов.
- •1) Биосинтез триацилглицеринов (таг): последовательность реакций, субстраты, ферменты. Особенности синтеза в печени, жировой ткани, энтероцитах. Регуляция процесса.
- •3) Понятие о рекомбинантных днк.
- •2) Неферментативные системы антирадикальной защиты и их физиологическое значение.
- •2. Действие первичных и вторичных продуктов перекисного окисления на мембраны и другие структуры.
- •3. Действие наркотиков. Дофаминовая система.
- •1. Разобщители цпэ.
- •2. Пути обезвреживания аммиака.
- •3. Теломеразная активность.
- •38 Билет
2) Характеристика и роль фибриллярных и регуляторных белков в процессе мышечного сокращения. Механизм мышечного сокращения, этапы. Роль ионов кальция в реализации механизма мышечного сокращения.
Согласно теории скольжения нитей, мышечное сокращение происходит благодаря скользящему движению актиновых и миозиновых филламентов друг относительно друга. Механизм скольжения нитей включает несколько последовательных событий.
Головки миозина присоединяются к центрам связывания актинового филламента. \\ Взаимодействие миозина с актином приводит к конформационным перестройкам молекулы миозина. Головки приобретают АТФазную активность и поворачиваются на 120°. За счет поворота головок нити актина и миозина передвигаются на «один шаг» друг относительно друга. \\ Рассоединение актина и миозина и восстановление конформации головки происходит в результате присоединения к головке миозина молекулы АТФ и ее гидролиза в присутствии Са2+. \\\ Цикл «связывание – изменение конформации – рассоединение – восстановление конформации» происходит много раз, в результате чего актиновые и миозиновые филламенты смещаются друг относительно друга, Z -диски саркомеров сближаются, и миофибрилла укорачивается.
Ионы кальция принимают участие в энергетическом контроле мышечной деятельности путём регуляции запасов АТФ. Связываясь с тропонином тонких нитей открывает их активн.ц. Меняет заряд на АТФ, активирует АТФазу.
3) ПЦР: биомедицинское значение.
Метод основан на многократном избирательном копировании определённого участка нуклеиновой кислоты ДНК при помощи ферментов в искусственных условиях (in vitro).
Позволяет добиться значительного увеличения малых концентраций определённых фрагментов нуклеиновой кислоты (ДНК или РНК) в биологическом материале (пробе). Используется для диагностики заболеваний (наследственных, инфекционных), для установления отцовства, для клонирования генов, выделения новых генов, позволяет производить множество других манипуляций с нуклеиновыми кислотами (введение мутаций, сращивание фрагментов ДНК).
Задача.
Пациенту с жёлчнокаменной болезнью назначили препарат хенодезоксихолевой кислоты. С чем связано такое назначение? При каком составе жёлчных камней применение этого препарата будет наиболее эффективным?
Ответ:
Хенодезоксихолевая кислота – первичная желчная кислота, образующейся в гепатоцитах печени при окислении холестерина. В норме хенодезоксихолевая кислота составляет 20– 30% общего пула желчных кислот. Объём продукции хенодезоксихолевой кислоты у взрослого здорового человека 0,2-0,3 г/сут. В жёлчном пузыре хенодезоксихолевая кислота присутствуют главным образом в виде конъюгатов — парных соединений с глицином и таурином, называемых, соответственно, гликохенодезоксихолевой и таурохенодезоксихолевой кислотами.
Билет 24
1) Биологическое значение и структуры кетоновых тел. Синтез кетоновых тел в печени; регуляция синтеза. Представление о кетонемии, кетонурии и кетоацидозе.
*
Э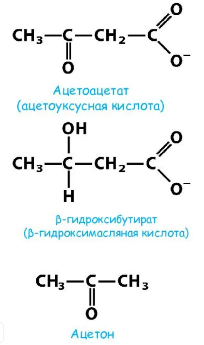 нергетическое
значение: скелетные и сердечные мышцы,
мозг и другие внепеченочные ткани
окисляют кетоновые тела. Синтетическое:
к. тела необходимы для образования
миелиновых оболочек нервов и белого
вещества головного мозга.
нергетическое
значение: скелетные и сердечные мышцы,
мозг и другие внепеченочные ткани
окисляют кетоновые тела. Синтетическое:
к. тела необходимы для образования
миелиновых оболочек нервов и белого
вещества головного мозга.
**
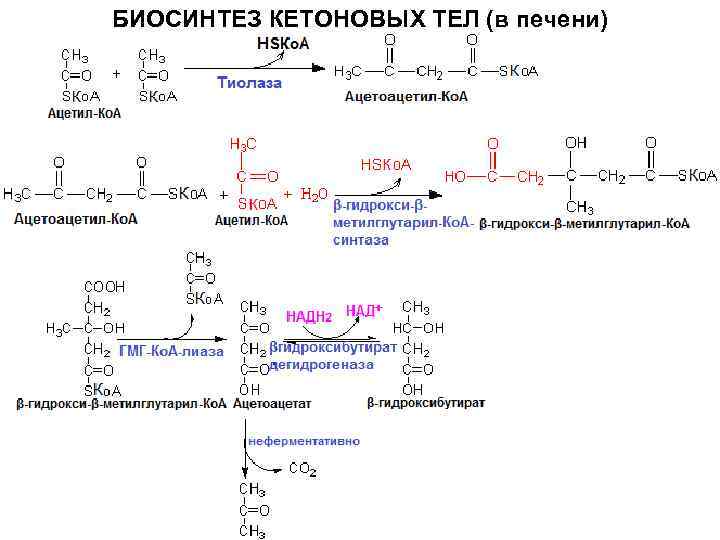 Регуляция
синтеза кетоновых тел. ГМГ-КоА-синтаза
– регуляторный фермент. Способы
регуляции: Индукция синтеза фермента
под действием глюкагона и адреналина.
Аллостерическая регуляция: ингибируется
высокими HS-KoA;
если поступление ЖК в клетки печени
повышается, то HS-KoA
связывается с ними, ГМГ-КоА-синтетаза
активна; если поступление ЖК снижается,
то повышение HS-KoA
ингибирует фермент.
Регуляция
синтеза кетоновых тел. ГМГ-КоА-синтаза
– регуляторный фермент. Способы
регуляции: Индукция синтеза фермента
под действием глюкагона и адреналина.
Аллостерическая регуляция: ингибируется
высокими HS-KoA;
если поступление ЖК в клетки печени
повышается, то HS-KoA
связывается с ними, ГМГ-КоА-синтетаза
активна; если поступление ЖК снижается,
то повышение HS-KoA
ингибирует фермент.
*** Кетонемия – повышение концентрации кетоновых тел в крови выше нормы (более 2,5мг%). Причины: увеличение концентрации ацетил-Коа (усиленное расщепление липидов); уменьшение концентрации оксалоацетата (при отсутствии углеводов или нарушении их использования оксалоацетат расходуется на образование глюкозы). Наблюдается при: голодании, сахарном диабете.
Кетонурия — выявление в моче кетоновых тел. Появляются в моче при нарушении обена (углеводов, жиров, белков), ктр сопровождается увеличением кетогенеза в тканях и накопление кетоновых тел в крови. Наблюдается при: сахарный диабет, углеводное голодание, истощение, тяежлые токсикозы, желудочно-кишечные расстройства.
Кетоацидоз – значительное повышение кетоновых тел в крови и нарушение кислотно-щелочного равновесия. Наблюдаются при: воспалительных процессах, обострениях хронических заболеваний, инфекционных болезней, хирургические вмешательства, травмы, нарушения режима лечения, неисправность в системах введения инсулина, эмоциональные стрессовые ситуации, беременность. Ведущую роль в патогенезе кетоацидоза играет абсолютная инсулиновая недостаточность, приводящая к снижению утилизации глюкозы инсулинзависимыми тканями и, соответственно гипергликемии, и тяжелому энергетическому голоду в них. 2. Биохимические механизмы адаптации к голоданию, типы голодания. Фазы полного голодания. Изменение гормонального статуса и метаболизма при голодании Виды голодания: 1) абсолютное [при отсустствии пищи и воды]; 2) полное [прекращение получение пищи, но с приёмом воды]; 3) неполное [количественное недоедание, равномерный дефицит БЖУ в рационе]; 4) частичное [качественное недоедание, недостаточное потребление одного или нескольких необходимых пищ.вещ-в].
Ферментная адаптация при полном голодании: падает активность больш-ва ферментов (глюкокиназы, гексокиназы, НАДФ-зависимых ферментов), что ведет к снижению интенсивности углеводного обмена. Резко снижается секреция ферментов в пищев.тракте, подавляется активность пепсина, гастриксина, амилазы, липазы (вследствие чего атрофируются пищеварительные железы) – полное выключение функции пищеварения, ферментная дезадаптация. Для реабилитации ЖКТ нужен длительный период времени, важным компонентом явл. его ферментная реадаптация.
Фазы полного голодания.
Первая фаза следует за постабсорбтивным периодом и продолжается примерно сутки. За это время исчерпываются запасы гликогена. Концентрация инсулина в крови уменьшена в 10 – 15 раз по сравнению с периодом пищеварения, а концентрации глюкагона и кортизола повышены. Это приводит к увеличению скорости мобилизации жиров и скорости глюконеогенеза из аминокислот и глицерола. Концентрация глюкозы в крови находится на уровне нижней границы нормы за счет глюконеогенеза.
Вторая фаза длится примерно неделю. В это период продолжается мобилизация липидов из жировой ткани, в крови повышается концентрация жирных кислот примерно в 2 раза по сравнению с абсорбтивным периодом. Кроме того, активируется синтез кетоновых тел в печени, что приводит к кетонемии. В результате декарбоксилирования избытков ацетоацетата из него образуется ацетон, который не используется организмом и выводится через легкие. Это приводит к появлению запаха ацетона изо рта и от кожи голодающего человека (на 3-й – 4-й день голодания). В этой фазе энергетические потребности мышц и органов удовлетворяются за счет жирных кислот и кетоновых тел. Так как концентрация инсулина в крови при голодании очень низкая, то глюкоза в мышечные клетки не попадает. В этих условиях потребителями глюкозы становятся только инсулинонезависимые клетки, в первую очередь, клетки головного мозга. При этом часть его энергетических потребностей обеспечивается кетоновыми телами. За счет распада тканевых белков продолжается глюконеогенез. К концу первой недели голодания потребление кислорода уменьшается на 40%, что приводит к снижению интенсивности обмена веществ.
Третья фаза голодания продолжается несколько недель. Скорость распада белков стабилизируется на уровне 20 г/сутки. При этом образуется примерно 5 г мочевины в сутки, в то время как при обычном питании – 20 – 25 г мочевины в сутки.
Во все фазы голодания будет отрицательный азотистый баланс, так как поступление азота отсутствует. Поскольку постепенно скорость распада белков будет уменьшаться, это приведет и к уменьшению скорости глюконеогенеза. В этой фазе главным источником энергии для головного мозга являются кетоновые тела. По мере увеличения продолжительности голодания нарастает атрофия тканей: через 4 – 8 недель голодания масса сердечной мышцы и мозга уменьшаются на 3 – 4%, скелетных мышц – на 1/3, а печени – вдвое. 3. Танкираза: роль в образовании активной теломеразы. Танкираза – фермент, связанный с белком теломерного комплекса 1. Активность танкиразы характерна для раковых клеток. Действие танкиразы аналогично действию дифтерийного
токсина, т.е. нарушение функции белков путем их АТФ-рибозилирования.
Задача:
У больного наблюдается желтушность кожных покровов и склер, головокружение. Селезёнка увеличена. Анализ крови: эритроциты – 2,6×1012/л; ретикулоциты – 18%; общий билирубин – 65 мкмоль/л; прямая фракция – 2 мкмоль/л.
У пациента совокупности приведённых признаков повышен распад эритроцитов (гемолиз), что привело к избыточному образованию неконъюгированного билирубина, вызвавшего желтушную окраску кожи и слизистых оболочек. Состояние называется гемолитическая желтуха. Причиной гемолитической желтухи может быть любой фактор, приводящий к гемолизу: наследственные дефекты структуры и ферментного аппарата эритроцитов, отравления гемолитическими ядами, переливание несовместимой крови и т.д.
Билет 25
Схема синтеза глицерофосфолипидов. Представление о роли лецитина в функционировании сурфактанта легкого.
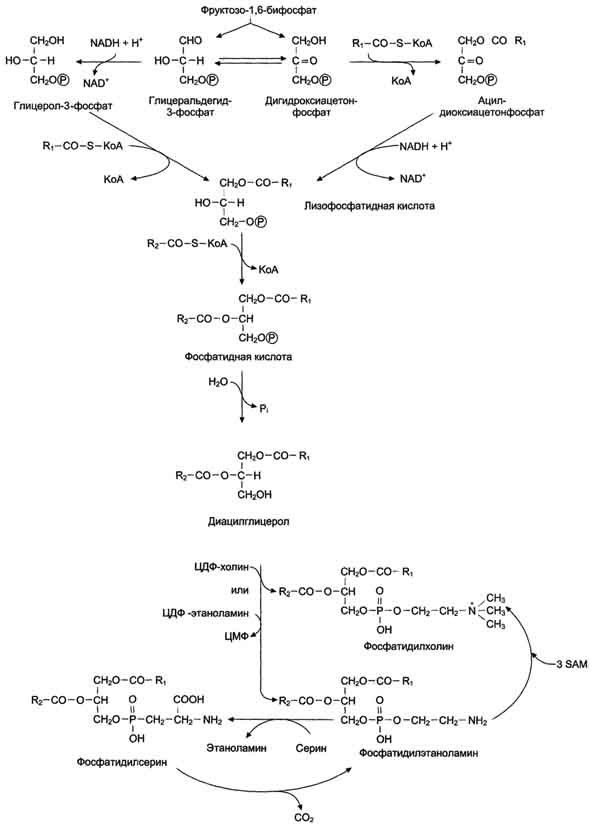
Фосфолипиды лецитина являются «строительным материалом» для лёгочного сурфактанта — смеси веществ, выстилающих изнутри лёгочные альвеолы. Сурфактант обеспечивает нормальный газообмен в лёгких: кислород попадает в кровь, а углекислый газ удаляется из крови. Нарушение этого процесса ведёт к гипоксии организма, и лецитин способен предотвратить её развитие.
