
- •1. Пептиды. Определение. Классификация. Кислотно-основные свойства пептидов.
- •2. Химические свойства пептидов.
- •3. Биологически активные пептиды.
- •4.Белки. Определение. Классификация.
- •5. Функции белков.
- •6. Особенности структурных организации белков.
- •7. Третичная структура белка: химические связи, структура, пример белка.
- •8. Четвертичная структура белка: химические связи, строение, пример белка
- •4. Липопротеины: укажите простетическую группу, приведите примеры.
- •9. Вторичная структура белка: химические связи, строение.
- •10. Нуклеопротеины: укажите простетическую группу, приведите примеры.
6. Особенности структурных организации белков.
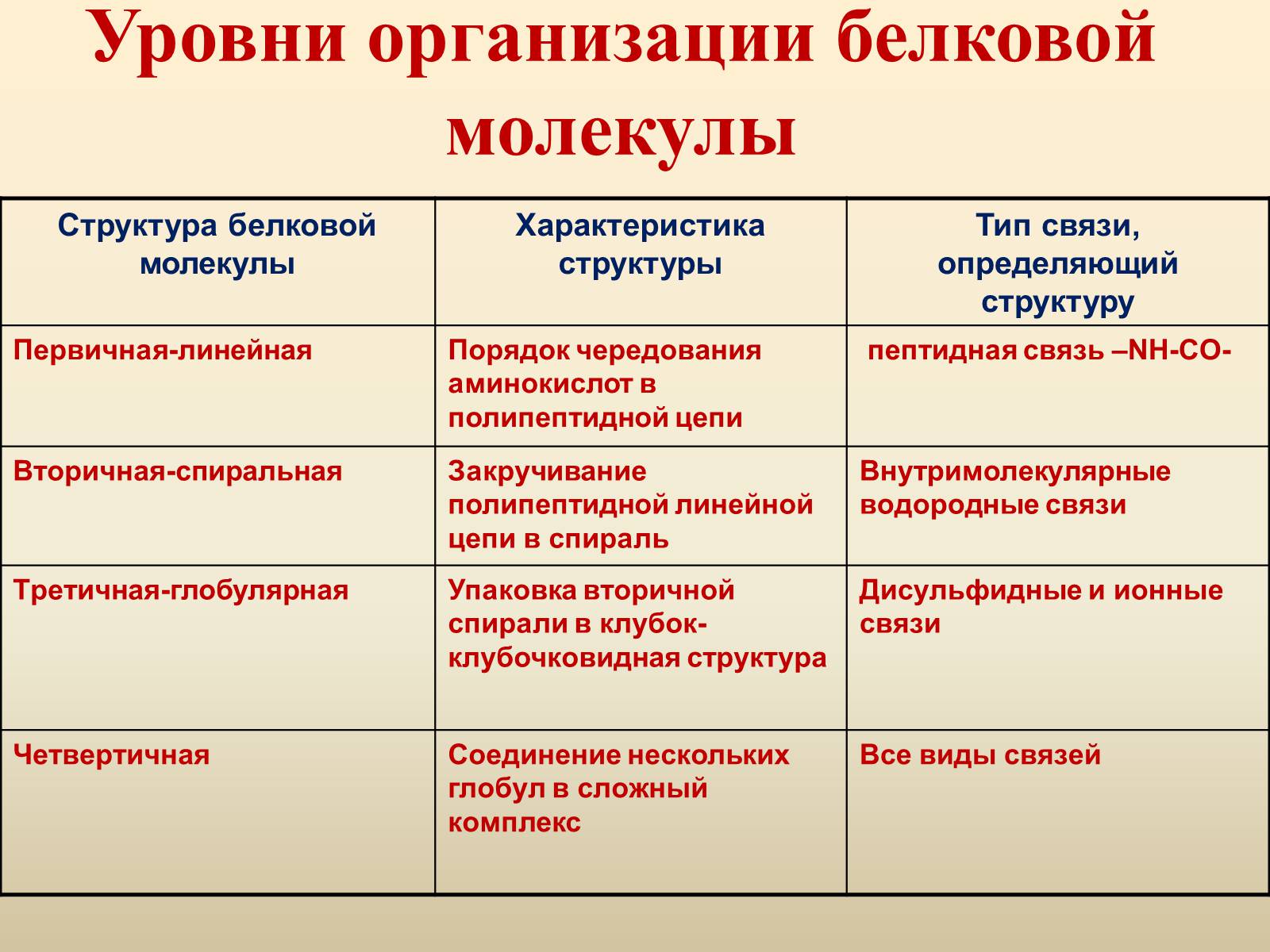


7. Третичная структура белка: химические связи, структура, пример белка.

Третичная структура (или трёхмерная структура) — пространственное строение (включая конформацию) всей молекулы белка или другой макромолекулы, состоящей из единственной цепи.
Третичной структурой белка называется способ укладки полипептидной цепи в пространстве. По форме третичной структуры белки делятся в основном на глобулярные и фибриллярные. Глобулярные белки чаще всего имеют эллипсовидную форму, а фибриллярные (нитевидные) белки — вытянутую (форма палочки, веретена).
Однако конфигурация третичной структуры белков еще не дает основания думать, что фибриллярные белки имеют только β-структуру, а глобулярные α-спиральные. Есть фибриллярные белки, имеющие спиральную, а не слоисто-складчатую вторичную структуру. Например, α-кератин и парамиозин (белок запирательной мышцы моллюсков), тропомиозины (белки скелетных мышц) относятся к фибриллярным белкам (имеют палочковидную форму), а вторичная структура у них — α-спираль; напротив, в глобулярных белках может быть большое количество β-структур.
Спирализация линейной полипептидной цепи уменьшает ее размеры примерно в 4 раза; а укладка в третичную структуру делает ее в десятки раз более компактной, чем исходная цепь.
Третичная структура в значительной степени определяется первичной структурой. Усилия по предсказанию третичной структуры белка, основываясь на его первичной структуре, известны как задача предсказания структуры белка. Окружающая среда, в которой белок сворачивается, существенно влияет на его конечную форму, но обычно непосредственно не принимается во внимание текущими методами предсказания. Большинство таких методов полагаются на сравнения с уже известными структурами, и таким образом учитывают влияние окружающей среды косвенно.
В стабилизации третичной структуры белка принимают участие:
ковалентные связи (между двумя остатками цистеина — дисульфидные мостики);
ионные связи между противоположно заряженными боковыми группами аминокислотных остатков;
водородные связи;
гидрофильно-гидрофобные взаимодействия. При взаимодействии с окружающими молекулами воды белковая молекула «стремится» свернуться так, чтобы неполярные боковые группы аминокислот оказались изолированы от водного раствора; на поверхности молекулы оказываются полярные гидрофильные боковые группы.
Связи, стабилизирующие третичную структуру:
1.Ковалентные дисульфидные связи. Возникают между R цистеина.
Цис-S-S-Цис
Связь неполярная (т.к э.о двух S одинаковая)Г
2.Водородные связи.
Возникают между R ак. Например: между гиcтидин-N………..НО-серин.
3.Ионные связи.
Возникают в результате электростатического взаимодействия противоположно-заряженных
радикалов. Напиример:-лизин-NH3……….ООС-глутаминовая кислота.
4.Гидрофобные связи
Возникают в результате взаимодействия между собой гидрофобных радикалов .
Аминокислоты :лей, иле, вал, фен, мет.
Первым белком, третичная структура которого была выяснена Дж. Кендрью на основании рентгеноструктурного анализа, оказался мио-глобин кашалота. Это сравнительно небольшой белок с мол. м. 16700, содержащий 153 аминокислотных остатка (полностью выяснена первичная структура), представленный одной полипептидной цепью. Основная функция миоглобина – перенос кислорода в мышцах. Полипептидная цепь мио-глобина представлена в виде изогнутой трубки, компактно уложенной вокруг гема (небелковый компонент, содержащий железо)

