
Занятие №9
Тема: «КЛАССИФИКАЦИЯ И СВОЙСТВА КАРБОНОВЫХ КИСЛОТ,
ТИОЭФИРОВ КАРБОНОВЫХ КИСЛОТ»
Вопросы к занятию
1.Классификации карбоновых кислот: по основности, насыщенности, наличию функциональной группы, числу атомов углерода в цепи.
2.Химические свойства карбоновых кислот, реакции характерные для карбоксильной группы: образование солей, амидов, ангидридов,сложных эфиров. Биологически важная реакция декарбоксилирования.
3.Дикарбоновые кислоты насыщенные и ненасыщенные: малоновая, щавелевая, янтарная, глутаровая, фумаровая и малеиновая. Структуры и функции в организме.
4.Гидрокси- и оксо-карбоновые кислоты: пировиноградная, молочная, яблочная, щавелевоуксусная, ацетоуксусная и β-гидроксимасляная, α- кетоглутаровая, лимонная. Структуры и функции в организме.
5.Образованиеи значение тиоэфиров карбоновых кислот: ацетил-SКоА, ацил-SКоА.
Выполнить письменно:
I. Вариант
1.Приведите примеры гидроксикислот, названия, структурные формулы
2.Напишите уравнение реакции изомеризации лимонной кислоты
3.Напишите уравнение реакции окисления масляной кислоты
4.Напишите уравнение реакции образования лимонной кислоты из ацетил-SКоА и оксаллоацетаат; укажите тип и механизм. 5.Биологичекая роль предельных и непредельных карбоновых кислот. Примеры.
II. Вариант
1.Приведите примеры кетокислот, названия, структурные формулы
2.Напишите уравнение реакции дегидратации -гидроксимасляной кислоты
3.Напишите уравнение реакции образования ацетил-SКоА
4.Напишите уравнение реакции дегирирования янтарной кислоты (сукцината), укажите тип и механизм.
5.Биологичекая роль оксокислот. Примеры.
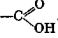
III. Вариант
1. Приведите примеры трикарбоновых кислот, названия, структурные формулы
2.Напишите уравнение реакции дегидрирования молочной кислоты
3.Напишите уравнение реакции декарбоксилирования малоновой кислоты
4.Напишите уравнение реакции гидратации фумаровой кислоты; укажите тип и механизм.
5.Биологичекая роль гидроксокислот. Примеры.
Литература:
1. Н.А. Тюкавкина, Ю.И. Бауков, С.Э.Зурабян «Биоорганичекая химия» М. «ГЕОТАР-Медиа» 2015 416 С
Часть 2 Глава 4-5 стр. 71-122
2. Бабков А.В., Нестерова О.В.
«Химия в медицине» М. «Юрайт» 2018г Глава 12 стр. 293-298, 300-302 3. Попков В.А, Берлянд А.С.
«Общая и биоорганическая химия» М. Академия 368 С.
Глава 9 стр. 289-295
Карбоновыми кислотами называют производные углеводородов, содержащие одну или несколько карбоксильных групп.
Число карбоксильных групп характеризует основность кислоты.
В зависимости от количества карбоксильных групп карбоновые кислоты подразделяются на одноосновные карбоновые кислоты или монокарбоновые (содержат одну карбоксильную группу), двухосновные или дикарбоновые (содержат две карбоксильные группы) и трикарбоновые.
По природе радикала, связанного с карбоксильной группой, карбоновые кислоты делятся на предельные, непредельные и ароматические. Предельные и непредельные кислоты объединяют под общим названием кислоты алифатического или жирного ряда.
Монокарбоновые кислоты
Гомологический ряд и номенклатура
Гомологический ряд одноосновных предельных карбоновых кислот начинается с муравьиной кислоты 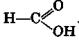
Общая формула предельных карбоновых кислот:
Номенклатура ИЮПАК разрешает сохранять для многих кислот их тривиальные названия, которые
обычно указывают на природный источник, из которого была выделена та или иная кислота, например, муравьиная, уксусная, масляная, валериановая и т.д.
Для более сложных случаев названия кислот производят от названия углеводородов с тем же числом атомов углерода, что и в молекуле кислоты, с добавлением окончания -овая и слова кислота. Муравьиная кислота Н—СООН называется метановой кислотой, уксусная кислота СН3—СООН — этановой кислотой и т. д.
Электронное строение карбоксильной группы
Обычная для карбонила поляризация двойной связи С=0 сильно возрастает за счет дополнительного стягивания свободной электронной пары с соседнего атома кислорода гидроксильной группы:
Следствием этого является значительное ослабление связи О—Н в гидроксиле и легкость отщепления атома водорода от него в виде протона (Н+). Появление пониженной электронной плотности (δ+) на центральном углеродном атоме карбоксила приводит также к стягиванию σ-электронов соседней связи С—С к карбоксильной группе и появлению (как у альдегидов и кетонов) пониженной электронной плотности (δ +) на α-углеродном атоме кислоты.
ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА
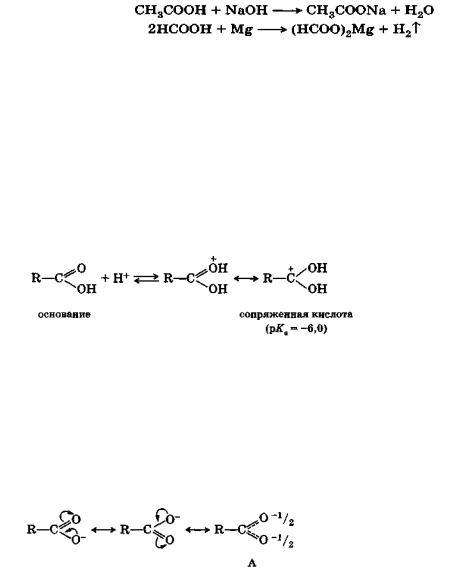
Все карбоновые кислоты обладают кислой реакцией (обнаруживается индикаторами) и образуют соли с гидроксидами, оксидами и карбонатами металлов и с активными металлами:
Карбоновые кислоты в большинстве случаев в водном растворе диссоциированы лишь в малой степени и являются слабыми кислотами, значительно уступая таким кислотам, как соляная, азотная и серная.
В безводных минеральных кислотах карбоновые кислоты протонируются по кислороду с образованием карбкатионов:
Сдвиг электронной плотности в молекуле недиссоциированной карбоновой кислоты, о котором говорилось выше, понижает электронную плотность на гидроксильном атоме кислорода и повышает ее на карбонильном. Этот сдвиг еще больше увеличивается в анионе кислоты:
Результатом сдвига является полное выравнивание зарядов в анионе, который фактически существует в форме А - резонанс карбоксилат-аниона.
Первые четыре представителя ряда карбоновых кислот — подвижные жидкости, смешивающиеся с водой во всех отношениях. Кислоты, в молекуле которых содержится от пяти до девяти атомов углерода (а также изомасляная кислота), — маслянистые жидкости, растворимость их в воде невелика.
Высшие кислоты (от С10) — твердые тела, практически нерастворимы в воде, при перегонке в обычных условиях они разлагаются.
Муравьиная, уксусная и пропионовая кислоты имеют острый запах; средние члены ряда обладают неприятным запахом, высшие кислоты запаха не имеют.
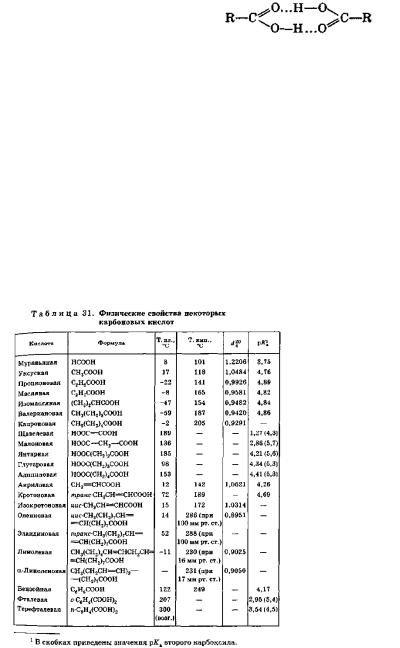
На физических свойствах карбоновых кислот сказывается значительная степень ассоциации вследствие образования водородных связей. Кислоты образуют прочные водородные связи, так как связи О—Н в них сильно поляризованы. Кроме того, карбоновые кислоты способны образовывать водородные связи с участием атома кислорода карбонильного диполя, обладающего значительной электроотрицательностью. Действительно, в твердом и жидком состоянии карбоновые кислоты существуют в основном в виде циклических димеров:
Химические свойства
Для кислот характерны три типа реакций: замещения иона водорода карбоксильной группы (образование солей); с участием гидроксильной группы (образование сложных эфиров, галогенангидридов, ангидридов кислот); замещения водорода в радикале.
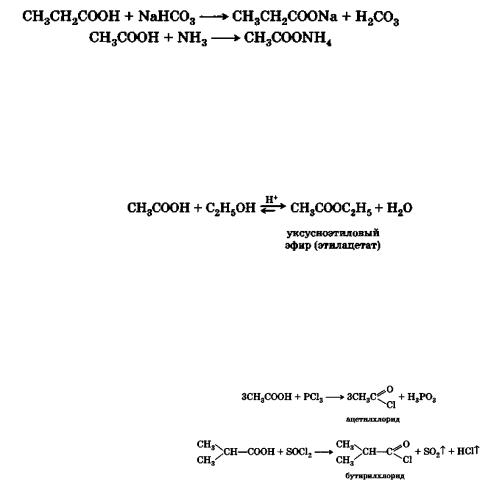
Образование солей
Карбоновые кислоты легко образуют соли при взаимодействии с металлами, их оксидами, со щелочами или основаниями, при действии аммиака или аминов:
Образование сложных эфиров
Со спиртами кислоты дают сложные эфиры:
Образование галогенангидридов
При |
действии на кислоты галогенидов фосфора или |
SОС12 |
получаются галогенангидриды кислот: |
Галогенангидриды – очень реакционноспособные вещества, которые применяются для разнообразных синтезов.
Образование ангидридов кислот
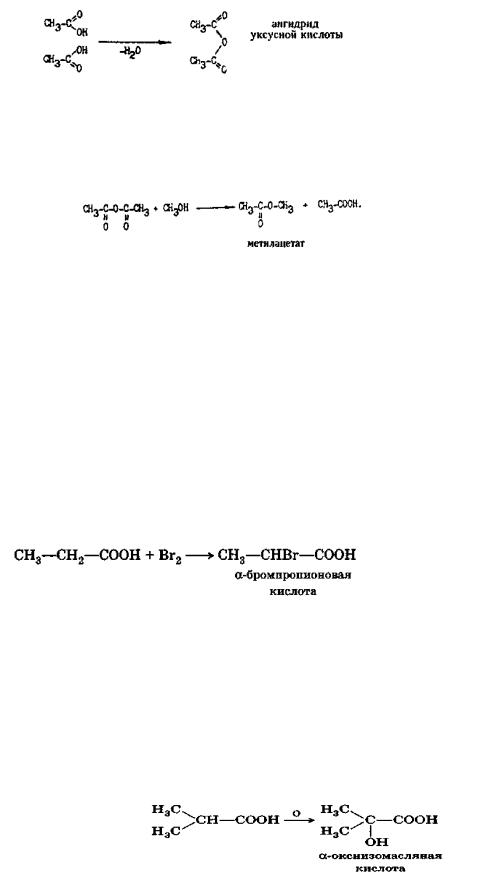
Если от двух молекул карбоновых кислот отнять одну молекулу воды (в присутствии водоотнимающих веществ Р2О5 и др.), образуется ангидрид карбоновой кислоты:
Ангидриды кислот, подобно галогенангидридам, очень реакционноснособны; они разлагаются различными соединениями с активным водородом, образуя производные кислоты и свободную кислоту:
Галогенирование карбоновых кислот
Водородные атомы углеводородных радикалов в кислотах по реакционной способности подобны атомам водорода в алканах. Исключение составляют атомы водорода, расположенные у α- углеродного атома (непосредственно связанного с карбоксилом). Так, при действии хлора и брома в присутствии переносчиков галогенов (РС13, 12 и др.) на карбоновые кислоты или на их хлорангидриды происходит замещение именно α -водородных атомов:
Действие окислителей
Одноосновные карбоновые кислоты, как правило, устойчивы к действию окислителей. Легко окисляются лишь муравьиная кислота (до СО2 и Н2О) и кислоты с третичным атомом углерода в α -положении. При окислении последних получаются α - оксикислоты:
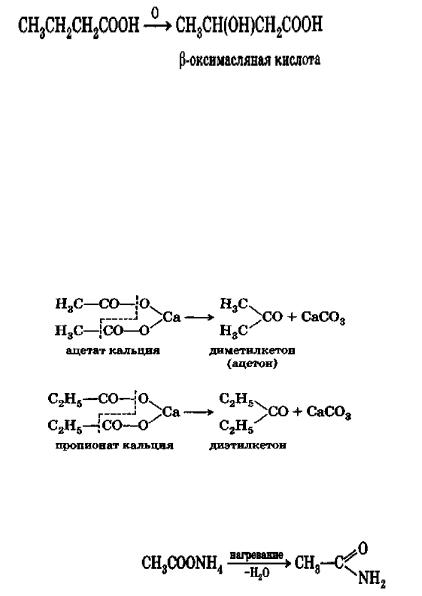
В живых организмах одноосновные карбоновые кислоты также способны окисляться, причем атом кислорода направляется всегда в β-положение. Так, например, в организме больных диабетом масляная кислота окисляется в β -оксимасляную кислоту:
Образование кетонов
Сухая перегонка кальциевых и бариевых солей карбоновых кислот (кроме муравьиной кислоты) приводит к образованию кетонов. Так, при перегонке ацетата кальция, полученного из СаСО3 и СН3СООН, образуется диметилкетон, при перегонке пропионовокислого кальция — диэтилкетон:
Образование амидов
При нагревании аммониевых солей получаются амиды:
Образование углеводородов
При сплавлении солей щелочных металлов карбоновых кислот со щелочами (пиролиз) происходит расщепление углеродной цепи и декарбоксилирование, в результате чего из углеводородного
радикала кислоты образуется соответствующий углеводород, например:
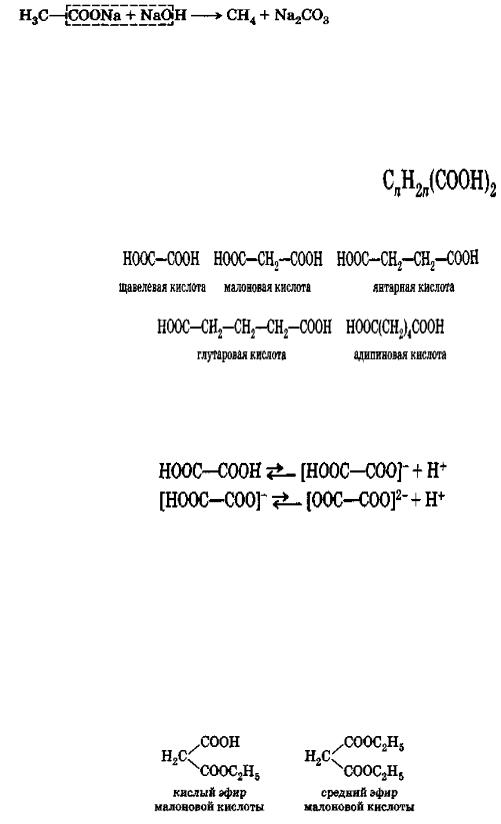
Дикарбоновые кислоты
Общая формула гомологического ряда предельных двухосновных кислот
Примерами могут служить:
Предельные
двухосновные кислоты — твердые кристаллические вещества. Двухосновные кислоты диссоциируют последовательно:
Они сильнее соответствующих одноосновных кислот. Степень диссоциации двухосновных кислот понижается с увеличением их молекулярной массы.
В молекуле двухосновных кислот содержатся две карбоксильные группы, поэтому они дают два ряда производных, например средние и кислые соли, средние и кислые сложные эфиры:
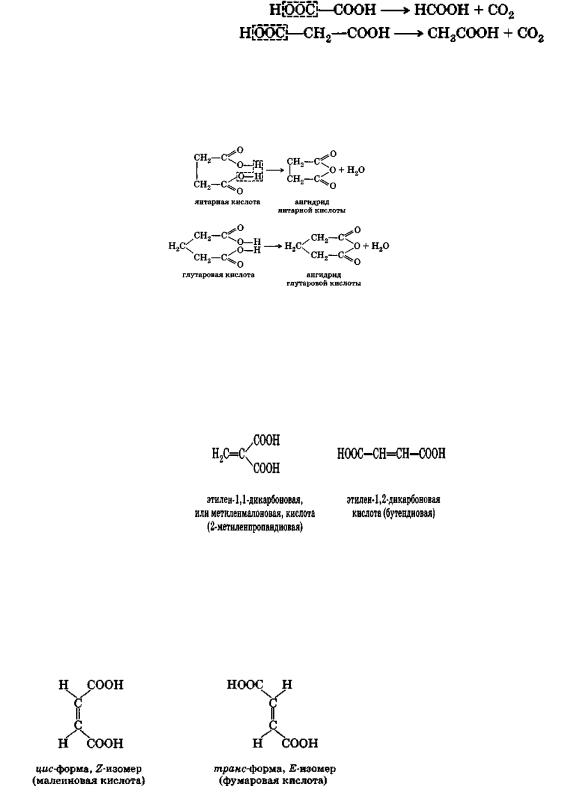
При нагревании щавелевой и малоновой кислот легко протекает декарбоксилирование:
Двухосновные кислоты с четырьмя и пятью атомами углерода в молекуле, т. е. янтарная и глутаровая кислоты, при нагревании отщепляют элементы воды и дают внутренние циклические ангидриды:
Непредельные дикарбоновые кислоты
Малеиновая и фумаровая кислоты
Простейшими из |
двухосновных |
|
кислот, |
содержащих |
|
этиленовую связь, |
являются |
два |
структурных |
изомера: |
|
Кроме того, для второй из этих кислот возможны две пространственные конфигурации:
Фумаровая кислота содержится во многих растениях: особенно часто она встречается в грибах. Малеиновая кислота в природе не найдена.
