
1 курс / Гистология / кость
.pdfщиеся в надхрящнице прехондробласты активируются, пролиферируют и дифференцируются в хондробласты, которые вырабатывают межклеточное вещество хряща, постепенно заполняющее образовавшийся дефект. Однако практически полноценная регенерация наблюдается лишь при небольших повреждениях хряща в детском возрасте. У взрослого регенерацию хрящевой ткани опережает развитие волокнистой соединительной ткани, происходящей из надхрящницы, которая быстро заполняет дефект хрящевой ткани, со временем превращаясь из рыхлой волокнистой ткани в плотную (рубец). Иногда в этом участке соединительной ткани развивается костная ткань. Такое заживление, хотя и обеспечивает связывание неповрежденных участков хряща, неполноценно и при нагрузках может привести к повторному разрыву хряща по линии рубца.
Хрящ как объект трансплантации и тканевой инженерии
В связи с низкой проницаемостью матрикса хряща для макромолекул и отсутствием сосудов он относительно инертен иммунологически и благодаря этому считается удачным объектом для трансплантации. Разработка методов трансплантации хряща ориентирована, в первую очередь, на возможность замены поврежденного суставного хряща (см. ниже), поскольку поражения суставов относятся к одним из наиболее распространенных заболеваний человека. При операциях трансплантации суставного хряща используют приемы как аутопластики (пересадки собственного хряща после его удаления из другого места и придания ему необходимой формы), так и аллопластики (использования донорской, в частности, трупной ткани). В последние годы с целью получения необходимого материала для хрящевых имплантатов широкое применение нашли методы тканевой инженерии: разработаны приемы выращивания хрящевых фрагментов нужных размеров с необходимыми механическими свойствами в искусственных строго контролируемых условиях.
КОСТНЫЕ ТКАНИ
Костные ткани образуют скелет, защищающий внутренние органы от повреждений, входящий в локомоторный аппарат и являющийся важнейшим депо минеральных веществ в организме (содержат около 1200 г Са - 99% его запасов в организме - и 530 г Р).
- 358 -
Общие принципы структурно-функциональной организации костных тканей
Костная ткань образована клетками и обызвествленным межклеточным веществом (матриксом). Примерно 67% ее массы приходится на минеральные компоненты (придающие ей высокую прочность), 33% - на органические (обеспечивающие необходимый уровень пластичности).
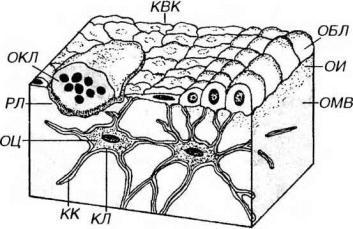
Клетки костной ткани включают остеобласты, остеоциты и остеокласты (рис. 12-6). Остеокласты происходят из стволовой клетки крови; остальные клетки развиваются в последовательности:
остеогенные клетки-предшественники -> остеобласты -> остеоциты
Рис. 12-6. Клетки костной ткани. ОБЛ - остеобласты (активные), КВК - клетки, выстилающие кость (неактивные остеобласты), КЛ - костные лакуны с телами остеоцитов (ОЦ), КК - костные канальцы, содержащие отростки ОЦ, ОКЛ - остеокласт резорбционной лакуне (РЛ), ОИ - остеоид, ОМВ - обызвествленное межклеточное вещество.
Остеогенные клетки-предшественники - малодифференцированные клетки мезенхимного происхождения, которые способны дифференцироваться в остеобласты. Они очень многочисленны в ходе развития костей у плода и имеют вид отростчатых клеток с крупным светлым ядром. Эти клетки встречаются и в соединительных тканях взрослого организма, где они имеют мелкие размеры, веретеновидную форму и слабо развитые органеллы; они могут находиться также в пе-
- 359 -
риферической крови. Их превращение в остеобласты происходит под индуцирующим воздействием ряда факторов, из которых наиболее изучена группа костных морфогенетических белков (КМБ).
Остеобласты - метки, образующие костную ткань. Они синтезируют и секретируют неминерализованное межклеточное вещество (матрикс) кости (остеоид), участвуют в его обызвествлении, регулируют поток кальция и фосфора в костную ткань и из нее. Различают активную и неактивную формы остеобластов.
Активные остеобласты - кубические или призматические клетки, связанные тонкими отростками с другими клеточными элементами - клеткамипредшественниками, соседними остеобластами и остеоцитами (см. рис. 12-6). Округлое ядро с крупным ядрышком удалено от полюса, контактирующего с поверхностью костного матрикса. Цитоплазма характеризуется выраженной базофилией; на ультраструктурном уровне ей свойственна отчетливая полярность. Она содержит мощно развитый синтетический аппарат (включающий множественные цистерны грЭПС, часто растянутые, крупный комплекс Гольджи), большое число митохондрий, пузырьков (рис. 12-7). На ее поверхности находятся многочисленные микроворсинки. Эти клетки покрывают в норме 2-8% поверхности кости.
Продукты, синтезируемые и секретируемые остеобластами в составе органического матрикса костной ткани (остеоида): коллаген I типа (90% всех образуемых ими белков), в небольшом количестве коллагены других типов - III, IV, V, XI, XIII - (5% белков), ряд неколлагеновых белков - гликопротеины матрикса (остеонектин, костный сиалопротеин, остеопонтин, остеокальцин), протеогликаны (бигликан, декорин, гиалуроновая кислота). Остеобласты продуцируют также цитокины, различные факторы роста, костные морфогенетические белки, ферменты (щелочную фосфатазу, коллагеназу), фосфопротеины (фосфорины).
Нарушение синтеза остеоида остеобластами наблюдается при ряде заболеваний. Так, выработка химически измененного коллагена остеоида (вследствие мутаций кодирующих его генов), вызывающая нарушение нормального процесса формирования костной ткани, обнаруживается при ряде врожденных заболеваний, проявляющихся ломкостью костей, например, различных формах несовершенного остеогенеза (osteogenesis imperfecta). Дефицит витамина С (цинга) у детей характеризуется нарушением формирования и роста костей вследствие дефекта синтеза коллагена н гликозаминогликанов. По этой же причине при цинге затрудняется заживление переломов костей.
- 360 -

Рис. 12-7. Ультраструктурная организация остеобласта (ОБЛ) и остеоцита (ОЦ). ОБЛ вырабатывают неминерализованное межклеточное вещество - остеоид (ОИ) и обеспечивают его минерализацию с образованием обызвествленного межклеточного вещества (ОМВ). МВ - микроворсинки, КГ - комплекс Гольджи. ОБЛ связан с ОЦ отростками, образующими щелевое соединение. Тело ОЦ лежит в лакуне (Л) в ОМВ 8 окружении коллагеновых фибрилл (КФ), его отростки (ОО) - в костных канальцах (КК).
Минерализация органического матрикса остеобластами
осуществляется двумя основными механизмами:
(1) путем отложения кристаллов гидроксиапатита из перенасыщенной внеклеточной жидкости вдоль фибрилл коллагена. Секретируемые остеобластами неколлагеновые белки контролируют ход минерализации. В частности, костный сиалопротеин и остеонектин усиливают связывание минеральных веществ и регулируют рост кристаллов гидроксиапатита. Особую роль в процессах формирования начального ядра отложения кристаллов (нуклеации) приписывают некоторым протеогликанам, занимающим зоны зазоров между молекулами тропоколлагена в коллагеновых фибриллах. Эти протеогликаны связывают кальций, удерживая его в зонах зазоров; в дальнейшем они разрушаются фермен-
- 361 -
тами, а с коллагеном в области зазоров связываются фосфопротеины. Их фосфат реагирует с ионами кальция, образуя первые кристаллы минералов. Процесс протекает с участием щелочной фосфатазы, обеспечивающей дефосфорилирование и локальное повышение концентраций фосфатных ионов. Это способствует образованию новых кальциевофосфатных преципитатов в области зон зазора, быстро трансформирующихся в первые кристаллы гидроксиапатита, которые растут в промежутках между коллагеновыми фибриллами.
(2) посредством секреции особых матричных пузырьков - мелких (100-200
нм) округлых мембранных структур, которые образуются и выделяются в матрикс остеобластами. Эти пузырьки содержат высокие концентрации фосфата кальция и щелочной фосфатазы, им свойственна высокая активность других мембранных ферментов и липидов. Микросреда внутри матричных пузырьков способствует отложению первых кристаллов гидроксиапатита. В этом процессе важную роль приписывают щелочная фосфатазе, отщепляющей фосфат, связанный с органическими веществами, который далее участвует в образовании кристаллов гидроксиапатита. Разрушаясь, пузырьки служат ядрами, вокруг которых растут кристаллы гидоксиапатита. В дальнейшем очаги минерализации увеличиваются в размерах и сливаются друг с другом, превращая новообразованный остеоид в зрелый костный матрикс.
В результате минерализации 90-95% солей кальция включаются в состав коллагеновых волокон и лишь 5-10% находятся в остальной части матрикса.
Скорость минерализации остеоида может существенно варьировать. В
норме минерализация осуществляется вскоре после образования остеоида, занимая у человека примерно 15 сут. При высокой скорости обновления костной ткани выработка остеоида опережает его минерализацию и его слой отчетливо выявляется между остеобластами и минерализованным матриксом. Такая картина наблюдается, в частности, при быстром росте костей у плодов, их перестройке после переломов и при некоторых заболеваниях.
Нарушение процессов минерализации кости происходит при снижении в крови уровня кальция (вследствие недостаточного поступления с пищей, нарушения всасывания) или фосфата (обычно при усиленном выделении с мочой). Результатом угнетения минерализации является размягчение и деформация костей - остеомаляция (от греч. osteon -кость и malakos - мягеий). В период роста организма аналогичные нарушения наблюдаются при рахите - заболевании, вызванном дефицитом
- 362 -
витамина D, точнее его биологически активной формы - кальцитриола [1,25(ОН)2-D3], который стимулирует всасывание кальция и фосфата в кишке. Рахит излечивается введением витамина D с пищей, а также пребыванием на солнечном свете (поскольку витамин D синтезируется в коже под влиянием ультрафиолетовых лучей).
Кальций в кристаллах гидроксиапатита может замещаться другими элементами; наиболее опасно его замещение радиоактивными стронцием (90Sr), плутонием (259Pu) или другими продуктами расщепления урана. Эти элементы могут попадать в костную ткань из внешней среды при ее радиоактивном заражении. Включаясь в состав костной ткани и длительно в ней находясь, они вызывают сильное внутреннее облучение организма, повреждая, в первую очередь, костный мозг.
Регуляция деятельности остеобластов осуществляется гормонами и другими биологически активными веществами благодаря наличию на их плазмолемме специфических рецепторов паратгормона, витамина D, глюкокортикоидов, половых гормонов (андрогенов, эстрогенов), кальцитонина, тиреоидных гормонов, факторов роста, инсулина, простагландинов. Они реагируют также на факторы, продуцируемые остеокластами и секретируют вещества, обусловливающие их собственную активацию (аутокринные регуляторы).
Неактивные (покоящиеся) остеобласты (клетки, выстилающие кость)
образуются из активных остеобластов и в покоящейся кости покрывают 80-95% ее поверхности. Они имеют вид уплощенных клеток (толщиной 0.1-1 мкм и диаметром до 50 мкм) с веретеновидными (на срезе) ядрами (см. рис. 12-6). Органеллы редуцированы, однако рецепторы к различным гормонам и факторам роста, а также способность реагировать на них сохраняются. Между покоящимися остеобластами и поверхностью кости имеется тонкий (0.1 -0.5 мкм) слой неминерализованного матрикса - эндостальная мембрана, который защищает костную поверхность от возможной атаки остеокластов. Эндостальная мембрана отличается от остеоида своей структурной организацией, биохимическим составом, а также тем, что никогда не минерализуется. Предполагают, что покоящиеся остеобласты сохраняют связи друг с другом и с остеоцитами, образуя систему, регулирующую минеральный обмен костной ткани. Они играют важную роль в инициации перестройки костной ткани (см. ниже).
Остеобласты служат источником развития двух типов опухолей костной ткани - доброкачественной остеомы (в которой клетки сохраняют способность не только к выработке органического матрикса, но
- 363 -
и к его минерализации) и злокачественной - остеосаркомы (клетки которой больше напоминают остеогенные клетки-предшественники и утрачивают способность к минерализации матрикса).
Остеоциты - основной тип клеток зрелой костной ткани. Они образуются из остеобластов, когда те в результате своей синтетической активности и минерализации остеоида оказываются окруженными со всех сторон обызвествленным матриксом (см. рис. 12-6). При этом остеобласты утрачивают способность к делению, уменьшаются в размерах, их органеллы редуцируются, а интенсивность синтетических процессов резко падает. Уплощенные тела остеоцитов лишены полярности и находятся в узких костных полостях - лакунах, где они окружены коллагеновыми фибриллами и узкой полоской остеоида (см. рис. 12-7). Их отростки (числом до нескольких сотен) располагаются в узких костных канальцах и связывают соседние клетки благодаря щелевым соединениям между ними (через которые передаются низкомолекулярные питательные вещества и ионы).
Функция остеоцитов состоит в поддержании нормального состояния костного матрикса (и баланса Са и Р в организме). При этом они не только вырабатывают его компоненты, но, по-видимому, обладают способностью к ограниченному растворению матрикса, что приводит к увеличению объема лакун (остеоцитарный остеолиз). Это явление у здоровых людей отмечается в 3- 4% лакун; оно усиливается в несколько раз при повышенных уровнях паратгормона или недостатке витамина D. Остеоциты воспринимают механические напряжения, возникающие внутри костной ткани; они, очевидно, чувствительны и к электрическим потенциалам, образующимся в матриксе при воздействии деформирующих сил. Реагируя на эти и другие сигналы, остеоциты запускают локальный процесс перестройки костной ткани, ограниченный мелким участком скелета.
Остеокласты - многоядерные гигантские клетки (точнее говоря, симпластические структуры, образующиеся вследствие слияния моноцитов), обладающие подвижностью и осуществляющие разрушение, или резорбцию (от лат. resorptio - рассасывание) костной ткани. Так как резорбция кости сопровождается освобождением связанного с ее матриксом кальция, эти клетки играют важнейшую роль в поддержании кальциевого гомеостаза. Они располагаются в образованных ими углублениях на поверхности костной ткани (резорбционных лакунах, или лакунах Хаушипа) поодиночке или небольшими группами (см. рис. 12-6), способны проделывать в костной ткани глубокие ходы (тоннели).
Достигают крупных размеров (20-100 мкм) и содержат до 20-50 ядер (на отдельном срезе обычно видны 6-10). Цитоплазма - ацидофиль-
- 364 -
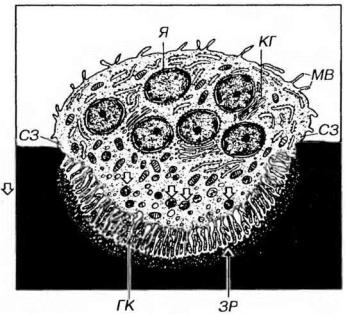
ная, пенистая, с высоким содержанием лизосом, митохондрий, пузырьков (рис. 12-8). Комплекс Гольджи образован множественными диктиосомами. Маркерными ферментами этих клеток служат особая (тартратнечувствительная) форма кислой фосфатазы (КФ), карбоангидраза и АТФаза. Другими важными маркерами этих клеток являются рецепторы кальцитонина и витронектина. Остеокласты - резко поляризованные клетки. В активном остеокласте участок его цитоплазмы, прилежащий к кости и не содержащий ядер и большинства органелл, образует многочисленные складки клеточной мембраны (гофрированный край). В отличие от исчерченной каемки, состоящей из микроворсинок, выпячивания цитоплазмы остеокласта в области гофрированного края - вариабельные структуры, постоянно вытягивающиеся и сокращающиеся. По обеим сторонам гофрированного края имеются гладкие краевые светлые зоны - участки плотного прикрепления его цитоплазмы к кости.
Рис. 12-8. Ультраструктурная организация остеокласта. Цитоплазма остеокласта образует многочисленные складки клеточной мембраны - гофрированный край (ГК) - участок обеспечивающий резорбцию кости. Резорбция включает деминерализацию матрикса в зоне резорбции (ЗР) и переваривание его органических компонентов в лизосомах (стрелки). Плотное прикрепление цитоплазмы остеокласта к кости осуществляется в области краевых светлых зон (СЗ). МВ - микроворсинки, КГ - комплекс Гольджи. Я – ядро.
- 365 -
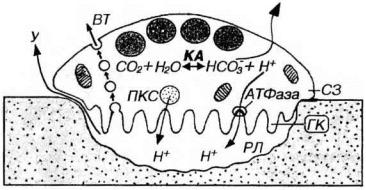
Рис. 12-9. Механизм резорбции костной ткани остеокластом. Остеокласт прикрепляется к поверхности кости в участке резорбции; особо плотное прикрепление образуется в области краевых светлых зон (СЗ). Закисление содержимого резорбционной лакуны (РЛ), обусловливающее растворение минерального компонента матрикса, осуществляется путем экзоцитоза пузырьков с кислым содержимым (ПКС), сливающихся с плазмолеммой остеокласта в области гофрированного края (ГК), а также благодаря действию протонных насосов (АТФазы мембраны ГК), накачивающих ионы Н+ в РЛ. Источником протонов служит реакция между С02 и Н20, катализируемая ферментом карбоангидразой (КА). Органические компоненты матрикса разрушаются лизосомальными ферментами, выделяемыми в лакуну. Продукты резорбции костной ткани удаляются из лакуны путем их утечки (У) в области СЗ (механизм "разгерметизации" лакуны) или везикулярным транспортом (ВТ) через цитоплазму клетки.
Механизм резорбции костной ткани остеокластами. Разрушение костной ткани остеокластами протекает циклически: периоды высокой активности у каждой клетки повторно сменяются периодами покоя. Процессы разрушения сочетаются с активным фагоцитозом и всасыванием в кровь продуктов деградации и включают несколько этапов (рис. 12-9):
1)прикрепление остеокластов к резорбируемой поверхности кости
обеспечивается рядом адгезивных взаимодействий, опосредованных интегринами и белками матрикса (в частности, остеопонтином, витронектином). При этом в остеокласте наблюдается выраженная перестройка элементов цитоскелета. Особое плотное прикрепление к костной ткани остеокласты образуют в области краевых светлых зон, тем самым "герметизируя” зону резорбции, и препятствуя в дальнейшем утечке из нее протонов;
2)закисление содержимого лакун осуществляется двумя механизмами: (а) путем выделения кислого содержимого вакуолей в лакуну;
- 366 -
(б) благодаря действию протонных насосов (АТФазы мембраны гофрированного края), накачивающих ионы Н+ в лакуну;
3)резорбцию минерального компонента матрикса, которая осуществляется вследствие воздействия на него кислого содержимого лакуны;
4)растворение органических компонентов матрикса вследствие действия лизосомальных ферментов остеокластов, секретированных ими в лакуну и активирующихся при низких значениях pH. Высказывается мнение о том, что остеокласты осуществляют лишь деминерализацию матрикса, а разрушение органических компонентов обеспечивается макрофагами;
5)удаление продуктов разрушения костной ткани осуществляется двумя механизмами: (а) их утечкой из лакуны после отделения плазмолеммы от поверхности кости (механизм "разгерметизации" лакуны), (б) поглощением продуктов остеокластами, и их везикулярным транспортом через цитоплазму клетки с последующим выделением в области ее апикального полюса.
Регуляция активности остеокластов обеспечивается общими и местными факторами.
Общие факторы включают гормон околощитовидных желез (паратогормон), 1,25 гидроксивитамин D3 (активируют остеокласты и увеличивают их число, стимулируя слияние мононуклеарных предшественников). Гормон щитовидной железы кальцитонин и женские половые гормоны (эстрогены) угнетают активность остеокластов. Кальцитонин связывается со специфическими рецепторами на поверхности остеокластов, а паратгормон, рецепторы которого на остеокластах отсутствуют, оказывает на них непрямое действие, по-видимому, опосредованное остеобластами.
Местные факторы, вызывающие активацию остеокластов в конкретных участках костной ткани, остаются малоизученными. Получены сведения о том, что механические напряжения создают локальные электрические поля, к которым чувствительны эти клетки. Роль посредников при этом, возможно, выполняют коллагеновые волокна, обладающие свойствами пьезоэлектрнков. Показано, что деятельность остеокластов стимулируется особым фактором, активирующим остеокласты (ФАО), который продуцируется лимфоцитами. На нее оказывают влияние простагландины, вырабатываемые макрофагами и остеобластами. На образование и активность остеокластов влияют также ряд интерлейкинов (ИЛ-1, ИЛ-3, ИЛ-6) и факторов роста.
- 367 -
