
Иллюстрационное пособие по общей микробиологии
.pdf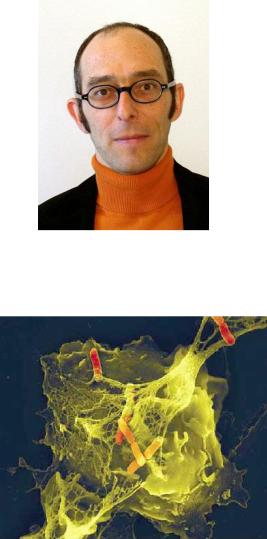
491
Рисунок 14.37 - Артур Циклинский (Arturo Zychlinsky, род в 1962 г.). Заимствовано из Интернет-ресурсов.
Рисунок 14.38 – Нейтрофильные экстрацеллюлярные ловушки. Заимствовано из Интернет-ресурсов.
Эозинофилы – крупные клетки, содержащие большие гранулы, в которых имеются полипептиды с высоким количеством аргинина. Они обладают высокой фагоцитарной активностью по отношению к паразитам.
Базофилы и тучные клетки содержат крупные гранулы с гистамином, серотонином, гепарином, трипсином и химотрипсиноподобными пептидгидролазами. При этом базофилы являются циркулирующими в кровотоке клетками, а тучные клетки представляют собой активированную форму базофилов и являются оседлыми, тканевыми клетками. Тучные клетки тканей и базофилы крови играют важную роль в реакциях воспаления и анафилактических реакциях (в иммунном ответе аллергического характера).
Мононуклеарные фагоциты являются потомками моноцитарномакрофагального предшественника. В костном мозге образуются монобласты, превращающиеся затем в промоноциты. Промоноциты при делении образуют моноциты крови, которые выходят из костного мозга в кровоток и циркулируют в нем или оседают в тканях, превращаясь в фиксированные (тканевые) или свободные макрофаги (в печени фиксированные макрофаги называются клетками Купфера, в селезенке и лимфатических узлах имеются фиксированные и свободные макрофаги,
492
в легких – альвеолярные макрофаги, в серозных полостях – плевральные и перитонеальные макрофаги, в соединительной ткани – гистиоциты, в нервной ткани – микроглиальные клетки, в костях – остеокласты, в почках – интрагломерулярные и мезангиальные клетки).
Естественные или натуральные киллеры (ЕК- и NK – клетки) – это лимфоидные клетки, лишенные признаков Т- и В-лимфоцитов, то есть лишенные свойственных им антигенраспознающих рецепторов. Морфологически они представляют собой крупные гранулярные лимфоциты, в цитоплазматических гранулах которых в больших количествах содержатся перфорины и гранзимы. Перфорин – белок, обусловливающий образование пор в мембране клетокмишеней, через которые поступают гранзимы. К гранзимам относятся сериновые пептидгидролазы (проникают в клетку-мишень через перфорированные поры и вызывают апоптоз или программированную гибель клеток) и хондроитин-сульфат А (защищает ЕК-клетки от аутолиза).
К гуморальным факторам неспецифической защиты относятся лизоцим, комплемент, фибронектин, цитокины, белки острой фазы, нормальные (естественные) антитела, антимикробные пептиды (барьерные белки) и другие факторы.
Лизоцим представляет собой фермент (мурамидаза), который регулирует проницаемость клеточных мембран, разрушая пептидогликановый слой клеточной стенки грамположительных бактерий, расщепляя β-гликозидную связь между N- ацетилмурамовой кислотой и N-ацетилглюкозамином. На грамотрицательные бактерии он действует совместно с комплементом. Он также активирует фагоцитоз
иобразование антител. Лизоцим открыт в 1909 г. П.Л. Лащенко, выделен и изучен в 1922 г. А. Флемингом. Лизоцим синтезируется макрофагами, нейтрофилами и другими фагоцитирующими клетками и постоянно поступает в жидкости и ткани организма. Фермент содержится в крови, лимфе, слезной жидкости, молоке, сперме, на слизистых оболочках дыхательных путей, желудочно-кишечного тракта и мочеполовых путей. Отсутствует лизоцим лишь только в спинномозговой жидкости
ипередней камере глаза. Нарушение синтеза лизоцима ведет к снижению резистентности организма и возникновению инфекционных заболеваний.
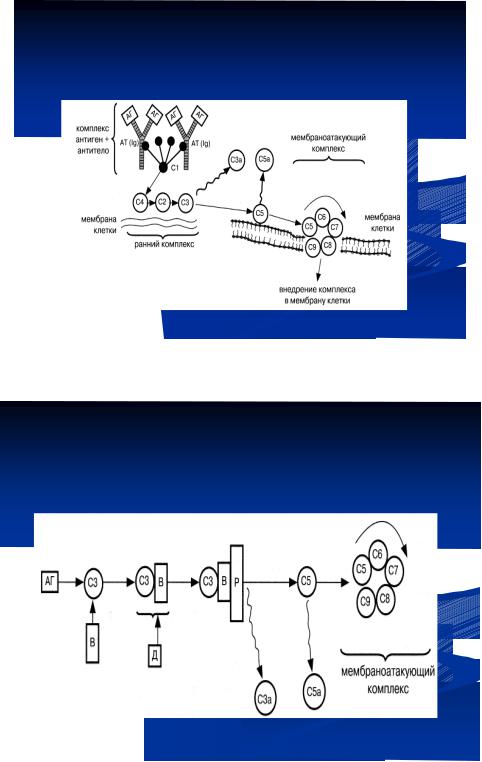
Комплемент – это система белков сыворотки крови. Он был открыт в 1899 г. французским иммунологом Ж. Борде, назвавшим его “алексином”. Современное название комплементу дал П. Эрлих (этот фактор комплементирует, то есть дополняет или усиливает действие антител и фагоцитов). Комплемент представляет собой сложный комплекс белков сыворотки крови, находящийся обычно в неактивном состоянии и активирующийся при соединении антигена с антителом или при агрегации антигена. В состав комплемента входят 20 взаимодействующих между собой белков, девять из которых являются основными компонентами комплемента; их обозначают буквами и цифрами: С1, С2, С3, С4...С9.
Основной функцией комплемента является участие в фагоцитозе и лизисе микробных клеток (цитолиз). Механизм активации комплемента очень сложен и представляет собой каскад ферментативных протеолитических реакций, в результате которого образуется активный цитолитический комплекс, разрушающий стенку бактерии. Известны три пути активации комплемента:
-классический путь;
493
-альтернативный путь;
-лектиновый путь.
Классический путь активации комплемента характерен для специфического иммунного ответа, так как требует наличия антител. При классическом пути вначале к комплексу антигена с антителом присоединяется компонент комплемента С1. Затем последовательно активируются компоненты комплемента С4, С2, С3. Компонент С3 активирует компонент С5, который прикрепляется к мембране клетки. На компоненте С5 путем последовательного присоединения компонентов С6, С7, С8, С9 образуется литический или мембраноатакующий комплекс (МАК),
который нарушает целостность мембраны (образует в ней дефект, пору). Через Классический путь активации образующийся дефект в клетку поступает жидкость. В результате осмотического лизиса клетка погибает (рисуноккомплемента14.39).
Рисунок 14.39 – Схема классического пути активации комплемента.
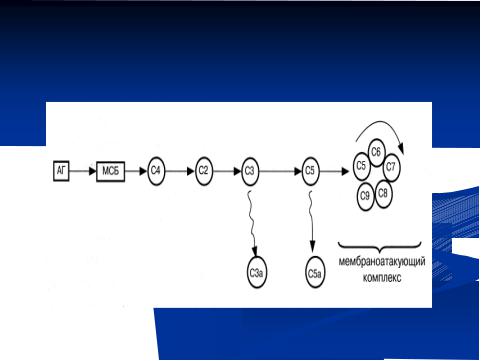
Альтернативный путь активации комплемента проходит без участия антител. Этот путь характерен для защиты от грамотрицательных микробов.
Каскадная цепная реакцияАльтернативныйпри аль ернативном путьп и начинается сразу со взаимодействия патогена с компонентом комплемента С3. Далее реакция идет так
активации комплемента
же, как и при классическом пути - образуется мембраноатакующий комплекс, приводящий к гибели клетки (рисунок 14.40).
Рисунок 14.40 – Схема альтернативного пути активации комплемента.
494
Лектиновый путь активации комплемента также происходит без участия антител. Он инициируетсяЛектиновыйособым маннозосвязывающимпуть активациибелком сыворотки крови,
который после взаимодействия с остатками маннозы на поверхности микробных комплемента клеток катализирует компонент С4. Дальнейший каскад реакций сходен с
классическим путем (рисунок 14.41).
Рисунок 14.41 – Схема лектинового пути активации комплемента.
Фибронектин - универсальный белок плазмы и тканевых жидкостей, синтезируемый макрофагами. Обеспечивает опсонизацию антигенов и связывание клеток с чужеродными веществами, например фагоцитов с антигенами и микробами, экранирует дефекты эндотелия сосудов, препятствуя тромбообразованию. Молекула фибронектина имеет участки для связывания коллагена, фибрина, некоторых бактерий (стафилококки, стрептококки). Связывая эти лиганды, фибронектин быстро их ферментирует.
Цитокины представляют собой небольшие пептидные информационные молекулы, регулирующие межклеточные взаимодействия. Среди цитокинов в процессах неспецифической защиты основная роль принадлежит интерферонам.
Интерфероны – это группа термостабильных низкомолекулярных белков сыворотки крови. Интерфероны открыты в 1957 г. А. Айзексом и Ж. Линдеманом. В зависимости от вида клеток – продуцентов выделяют три типа интерферона.
Альфа-интерфероны синтезируются лейкоцитами, поэтому они называются лейкоцитарными.
Бета-интерферон называют фибробластным, поскольку он синтезируется фибробластами - клетками соединительной ткани.
Гамма-интерферон называется иммунным, так как он вырабатывается активированными Т-лимфоцитами и другими иммунными клетками.
Альфа- и бета-интерфероны относятся к типу I, а гамма-интерферон – к типу II. Интерфероны обладают противовирусным и противоопухолевым действием, стимулируют фагоцитоз, регулируют образование антител.
Белки острой фазы способствуют фагоцитозу, активации комплемента, формированию и ликвидации воспалительного очага. Они образуются в печени при действии цитокинов. К ним относятся С-реактивный белок (СРБ), маннозосвязывающий белок и другие.
С-реактивный белок имеет молекулярную массу 105 кД и состоит из 5 идентичных полипептидов. В норме в сыворотке крови С-реактивный белок присутствует в количестве 800 нг/мл. Его определяют в реакции преципитации со
495
специфической иммуносывороткой. С-реактивный белок способствует удалению из организма патогенных микробов и некротического материала, поврежденных клеток, стимулирует активность фагоцитов и Т-лимфоцитов, являясь, таким образом, участником не только неспецифических, но и специфических защитных реакций. С-реактивный белок является индикатором воспаления.
Маннозосвязывающий белок - нормальный протеин сыворотки крови. Способен прочно связываться с остатками маннозы, находящимися на поверхности микробных клеток, и опсонизировать их. Способствует фагоцитозу, активирует систему комплемента по лектиновому пути.
Нормальные (естественные) антитела содержатся в сыворотке практически здорового неиммунизированного человека. Считают, что они возникают в результате естественной иммунизации микробами, попадающими в организм в малых количествах в течение жизни. Содержание их в сыворотке крови очень малое, но они обладают выраженной противомикробной активностью.
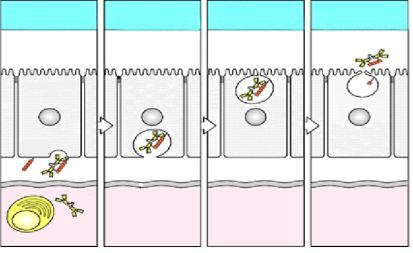
Особую роль в защите организма от проникающих патогенов играет секреторный глобулин А, находящийсяСекреторныйна слизистыхIgAоболочках (рисунок 14.42).
Образование Эндоцитоз Транспорт Освобождение
Эпителиальная клетка
IgA-секретирующая клетка
Рисунок 14.42 – Образование и транспортировка секреторного иммуноглобулина А на поверхность эпителиальных клеток. Заимствовано из Интернет-ресурсов.
Антимикробные пептиды образуются эпителиальными клетками и нейтрофилами. К ним относятся дефензины и кателицидины. Продукция антимикробных пептидов запускается в результате взаимодействия патогенассоциированных молекул с Toll-подобными рецепторами. Одновременно с антимикробными пептидами интенсивно образуются и провоспалительные цитокины. Предполагается, что антимикробные пептиды вызывают деполяризацию мембран фагоцитированных микробов, образование дефектов (пор) в мембранах и выход содержимого микробной клетки.
Лактоферрин - железосвязывающий белок, конкурирующий с бактериями за железо. Синтезируется полиморфно-ядерными лейкоцитами и гроздьевидными клетками железистого эпителия. Является специфическим компонентом секрета слюнных, слезных, молочных желез, дыхательного, пищеварительного и мочеполового трактов.

497
Фагоцитоз осуществляют две популяции клеток:
-циркулирующие в крови гранулоцитарные клетки – моноциты,
эозинофилы, базофилы, нейтрофилы;
-тканевые макрофаги печени, селезенки, лимфатических узлов.
В настоящее время все фагоциты объединены в единую мононуклеарную фагоцитирующую систему (МФС) вместо существовавшей ранее ретикулоэндотелиальной системы (РЭС). В нее включены тканевые макрофаги (альвеолярные, перитонеальные и др.), клетки Лангерганса и Гренстейна (эпидермоциты кожи), клетки Купфера (звездчатые ретикулоэндотелиоциты), эпителиоидные клетки, нейтрофилы и эозинофилы крови и некоторые другие.
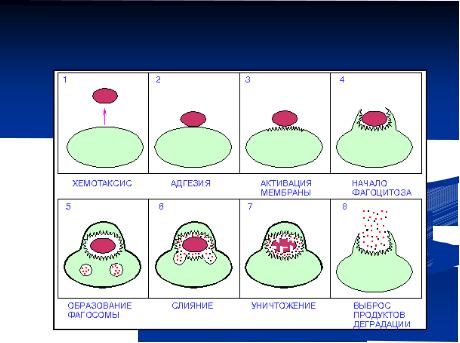
Процесс фагоцитоза включает в себя несколько стадий (рисунок 14.44):
1)стадия хемотаксиса - приближение фагоцита к объекту поглощения;
2)стадия адгезии поглощаемой частицы на поверхности фагоцита;
3)стадия поглощения частицы путем инвагинации клеточной мембраны с образованием в протоплазме фагосомы (вакуоли, пузырьки);
4)стадия слияния фагосомы с лизосомой клетки с образованием фаголизосомы;
5)стадия проникновения в фаголизосому лизосомальных ферментов (кислой фосфатазы, миелопероксидазы, коллагеназы, каталазы и др.);
6)стадия ферментативного переваривания частицы (процессинг антигена)
вфаголизосоме с помощью ферментов;
7)стадия исхода (удалениеФагоцитозэлементов).
Рисунок 14.44 – Стадии фагоцитоза. Заимствовано из Интернет-ресурсов.
В случае полного переваривания поглощенного патогена фагоцитоз является завершенным. В некоторых случаях поглощенные патогенные микробы внутри фагоцитов не перевариваются, сохраняют жизнеспособность и даже размножаются. Такой фагоцитоз называется незавершенным и обусловливает хроническое течение инфекции. В ряде случаев макрофаги с поглощенными бактериями образуют скопления, которые снаружи окружаются соединительно-тканной капсулой. Такие скопления клеток, окруженные капсулой (узелки, бугорки), называются инфекционной гранулемой. Они образуются при туберкулезе, бруцеллезе,
498
сифилисе.
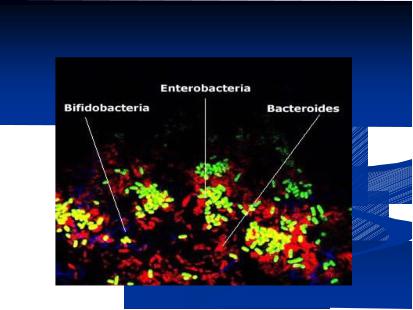
Некоторые полости организма постоянно заселены определенными микроорганизмами (нормальная микробиота). Нормальная микробиота на слизистых
оболочках формирует биопленку, защищающую организм от внедрения возбудителей заболеванийНормальная( исунок 14.45).микрофлора
Рисунок 14.45 – Биопленка на слизистой оболочке кишечника. Заимствовано из Интернет-ресурсов.
Кожа, слизистые оболочки пищеварительной системы и других органов населены свойственными им микроорганизмами, которые составляют биоценоз этих органов. При различных заболеваниях нарушается количественное и качественное соотношение представителей нормальной микрофлоры, а иногда наблюдается и развитие патогенных и условно-патогенных микроорганизмов. В этом случае развивается патологический процесс, называемый дисбактериозом (дисбиозом).
Защитная функция нормальной микробиоты проявляется ее антагонистическими взаимоотношениями с патогенными и условно-патогенными микроорганизмами (например, молочнокислые бактерии подавляют гнилостную микрофлору, эшерихии подавляют развитие стрептококков). Механизм антагонистического действия микроорганизмов самый разнообразный (продукция антибиотиков, антибиотикоподобных веществ, ферментов и других биологически активных соединений).
Защитно-адаптационные механизмы. К неспецифическим факторам защиты относится также стресс. Факторы, вызывающие стресс, были названы Г. Селье стрессорами. По Г. Селье стресс – особое неспецифическое состояние организма, возникающее в ответ на действие различных повреждающих факторов окружающей среды. В качестве стрессоров могут выступать патогенные микроорганизмы и их токсины, холод, голод, тепло, ионизирующее излучение и другие агенты, вызывающие ответные реакции организма. Адаптационный синдром на стресс может быть общим и местным. Он обусловливается действием гипофизарно-адренокортикальной системы, связанной с гипоталамическим центром. Под влиянием стрессора гипофиз усиленно выделяет адренокортикотропный гормон (АКТГ), который стимулирует функцию надпочечников, вызывая у них выделение противовоспалительного гормона типа кортизона, снижающего воспалительную реакцию.
Разные органы и системы организма обладают присущими им защитными
499
факторами. Защитная функция дыхательных путей обусловлена слизью,
реснитчатым эпителием, иммуноглобулинами и фагоцитозом. Защитная функция конъюнктивы обусловлена слезной жидкостью и лизоцимом. Защитная функция пищеварительного тракта обусловлена кислой средой желудка, щелочной средой кишечника, нормальной микрофлорой, механическим перемещением пищи, ферментами, лизоцимом, бактериоцинами. Защитная функция кожи обусловлена анатомическими барьерами, секретами потовых и сальных желез, антимикробными секретами, лактатом, жирными кислотами, кислой средой, нормальной микрофлорой. Защитная функция урогенитального тракта обусловлена током мочи, кислой средой, лизоцимом, вагинальным лактатом.
14.4.2. Патоген-ассоциированные молекулярные образы и образраспознающие рецепторы
Защитная система направлена на то, чтобы распознать чужеродные агенты и элиминировать их из организма. Каким же образом клетки защитной системы узнают патогены? Дело в том, что микроорганизмы имеют структуры, отсутствующие в клетках макроорганизма. Эти структуры получили обозначение
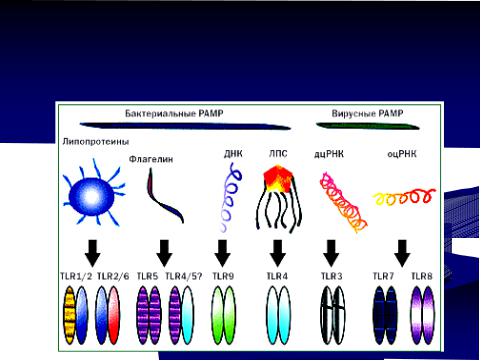
“патоген-ассоциированные молекулярные образы или паттерны” (pathogenassociated molecular patterns, PAMP). Они представляют собой молекулярные структуры, присущие только чужеродным агентам (бактериям, вирусам, грибам). В клетках организма человека они отсутствуют. Описано около 20 вариантов таких структур. К ним относятся липопротеины, флагеллин, липополисахариды, гликолипиды, бактериальная и вирусная ДНК и РНК. В частности, для бактериальной ДНК характерно наличие большого количества неметилированных пар динуклеотидов цитозин/гуанин (CpG). Эти структуры синтезируются только микроорганизмамиПатоген(в клетках-ассоциированныемлекопитающихмолекулярныеих нет), ониобразыхарактерны для целого
ряда патогенов, а не только для одного конкретного вида микробов, они являются (pathogen-associated molecular patterns, PAMP) важными для жизнедеятельности бактерий (рисунок 14.46).
Рисунок 14.46 – Патоген-ассоциированные молекулярные образы. Заимствовано из Интернет-ресурсов.
500
Например, основными РАМР грамотрицательных бактерий являются липополисахарид клеточной стенки, ДНК, флагеллин и пептидогликан. Для грамположительных бактерий основными РАМР являются ДНК, пептидогликан, тейхоевые и липотейхоевые кислоты
Патоген-ассоциированные молекулярные образы распознаются особыми рецепторами, расположенными на поверхности практически всех клеток организма человека. Эти рецепторы называются образ-распознающими рецепторами,
патоген-распознающими рецепторами или паттерн-распознающими рецепторами – PRR (Pattern Recognition Receptors). Они распознают определенные консервативные молекулы патогенов и молекулы, экспрессируемые собственными клетками организма в случае их инфицирования или опухолевого перерождения. У человека обнаружен большое количество образраспознающих рецепторов. Они реагируют на молекулярные структуры (РАМР), присущие всем патогенным микроорганизмам.
Патоген-распознающие рецепторы распределяются на 3 группы:
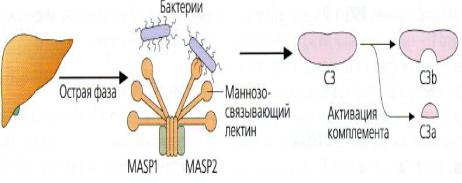
1. Секретируемые патоген-распознающие рецепторы. Они связываются с микроорганизмаСекретируемые патоген-
клеточной стенкой тем самым помечают их для последующей
деградации системойраспознающиекомплемента ли рецепторыфагоцитами. К ним относится маннозосвязывающий лектин, секретируемый печенью. Этот лектин распознает (маннозосвязывающий лектин) углеводы на поверхности бактерий, дрожжей, некоторых простейших и вирусов и
запускает лектиновый путь активации комплемента (рисунок 14.47).
Рисунок 14.47 – Секретируемый патоген-распознающий рецептор – маннозосвязывающий лектин. Заимствовано из Интернет-ресурсов.
2. Патоген-распознающие рецепторы эндоцитоза. Они экспрессируются на поверхности фагоцитов и способствуют захвату патогена и его доставке в лизосомы. К ним относятся маннозный рецептор и рецепторы-мусорщики. Маннозный рецептор узнает маннан на поверхности микробных клеток, а рецепторы-мусорщики связываются с клеточной стенкой бактерий. В результате этого микробные клетки подвергаются эндоцитозу (рисунок 14.48).
