
Иллюстрационное пособие по общей микробиологии
.pdf441
шигелл к ампициллину достигает 90% и более. Устойчивость к антибиотикам чаще возникает у бактерий, реже – у спирохет, риккетсий, хламидий, микоплазм, дрожжеподобных грибов. Устойчивость к антибиотикам возникает в результате изменения различных структур бактериальной клетки (цитоплазматической мембраны, клеточной стенки и др.).
Основные механизмы резистентности микробов к антибиотикам:
-способность к синтезу ферментов, инактивирующих антибактериальный препарат;
-модификация бактериальных структур, с которыми взаимодействует антибиотик.
Различают следующие виды резистентности микроорганизмов:
1.Естественная резистентность (первичная резистентность, природная устойчивость) - генетически обусловленная резистентность данного вида бактерий в отношении какого-либо химиотерапевтического препарата (отсутствие мишени для воздействия антибиотика). Например, микоплазмы не имеют пептидогликана в составе клеточной стенки, поэтому не чувствительны к бета-лактамным антибиотикам.
2.Приобретенная резистентность:
-первично приобретенная резистентность - резистентность бактериального штамма к химиотерапевтическому препарату без предварительного контакта с антибиотиком;
-вторично приобретенная резистентность – резистентность микроба,
развивающаяся после контакта с химиотерапевтическим препаратом.
Генетические основы приобретенной резистентности:
1. Мутации в бактериальной хромосоме с последующей селекцией мутантов. Такой путь приобретения устойчивости наблюдается в присутствии антибиотиков, так как в этом случае мутанты приобретают селективные преимущества.
2. Перенос хромосомных генов антибиотикорезистентности от устойчивых клеток к чувствительным.
3. Перенос R-плазмид (плазмид резистентности). При этом плазмиды могут кодировать устойчивость сразу к нескольким антибиотикам (множественная устойчивость).
4. Перенос транспозонов (мигрирующих генетических последовательностей), несущих гены резистентности к антибиотикам (r-гены). Транспозоны способны мигрировать с хромосомы на плазмиду и обратно, что увеличивает вероятность возникновения антибиотикорезистентных бактерий.
Резистентность, обусловленная мутациями, связана с изменением в структуре гена, кодирующего чувствительность к антибиотику. При этом возникают как спонтанные, так и индуцированные мутации. Спонтанные мутации, наблюдаемые с частотой от 10-7 до 10-12, играют очень незначительную роль в формировании резистентности. На фоне применения антибактериального средства часто возникают индуцированные мутации. В этом случае имеет место естественная селекция антибиотикоустойчивых штаммов. Подобным путем у штаммов Staphylococcus aureus выработалась устойчивость к метициллину.
Мутации могут быть единичными, при которых возникают бактерии, устойчивые к одному какому-нибудь антибиотику, а также множественными, при
442
которых возникает потомство, обладающее устойчивостью к нескольким антибиотикам.
Наиболее часто резистентность к антибиотикам обусловлена переносом плазмид. Плазмиды резистентности (R-плазмиды) - внехромосомные молекулы ДНК. Они способны к автономной репродукции и кодируют антибиотикоустойчивость у различных бактерий. Плазмиды могут включать один и более генов, кодирующих синтез ферментов, обусловливающих инактивацию или модификацию лекарственных препаратов (например, β-лактамазы, инактивирующие пенициллины и цефалоспорины, или ацетилтрансферазы, нарушающие структуру хлорамфеникола), а также опосредующих быструю элиминацию препаратов (например, тетрациклинов) из клетки. Гены множественной устойчивости могут кодировать транспозоны, которые у одних бактерий интегрируются в плазмиды, а у других микробов встраиваются в бактериальную хромосому. R-плазмиды способны к широкому распространению в популяциях бактерий в результате генетического переноса (конъюгации, трансдукции, трансформации).
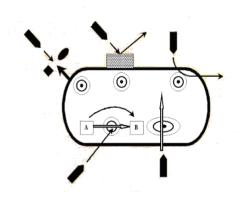
Механизмы формирования резистентности микроорганизмов к антибиотикам (рисунок 13.24):
1. Превращение активной формы антибиотика в неактивную форму путем ферментативной инактивации (разрушения). Например, многие бактерии
продуцируют фермент -лактамазу, |
разрушающую -лактамные антибиотики |
(пенициллины и цефалоспорины). |
|
|
Нарушение |
|
проницаемости |
|
Активный выброс |
Инактивация |
|
бета-лактамазой |
|
|
Изменение мишени |
Обходной путь |
|
Рисунок 13.24 – Основные механизмы резистентности микроорганизмов к антимикробным препаратам. Заимствовано из Интернет-ресурсов.
2.Изменение проницаемости клеточной стенки бактерий для определенного антибиотика. Транспорт антимикробных препаратов в клетку происходит через пориновые каналы клеточной стенки. Нарушение их проницаемости препятствует поступлению антибиотиков внутрь клетки. Например, клеточная стенка грамотрицательных бактерий слабо проницаема для пенициллина.
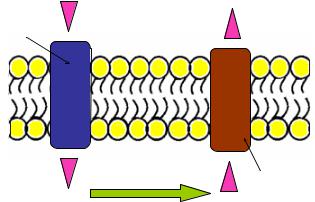
3.Нарушения в системе специфического транспорта антимикробного препарата в бактериальную клетку, то есть активное выведение антибиотика из микробной клетки (эффлюкс). Этот механизм характерен для тетрациклиновых
антибиотиков (рисунок 13.25).
444
-изыскание ингибиторов, подавляющих активность бактериальных ферментов, а также препаратов, препятствующих адгезии бактерий на клетках макроорганизма;
-систематическое изучение типов лекарственной устойчивости патогенных и условно-патогенных бактерий, циркулирующих в пределах отдельных регионов;
-своевременная информация врачей о циркулирующих в регионе лекарственно-устойчивых бактериях;
-определение чувствительности выделенных бактерий к антибиотикам.
С целью предотвращения возникновения резистентных микроорганизмов при лечении необходимо комбинировать антибиотики или использовать их в сочетании с другими химиотерапевтическими средствами (сульфаниламидами, нитрофуранами, производными оксихинолина) и применять препараты, повышающие иммунологическую реактивность организма.
13.8. Характеристика антимикробных препаратов
В настоящее время все антимикробные препараты с учетом комплекса характеристик подразделяются на следующие группы:
А. Антибактериальные препараты: 1. Пенициллины:
1.1.Природные пенициллины (пенициллин).
1.2.Полусинтетические пенициллины:
-устойчивые к пенициллиназам - клоксациллин, оксациллин, метициллин;
-карбоксипенициллины - карбенициллин, тикарциллин;
-уреидопенициллины (антисинегнойные препараты) – мезлоциллин, азлоциллин, пиперациллин;
-аминопенициллины - ампициллин, амоксициллин;
-амидопенициллины – мециллам;
-комбинированные препараты, содержащие ингибиторы бета-лактамаз – амоксициллин + клавулановая кислота, ампициллин + сульбактам, пиперациллин + тазобактам, тикарциллин + клавулановая кислота.
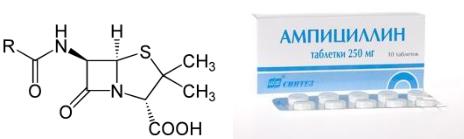
Общая структура и готовая лекарственная форма одного из пенициллинов представлены на рисунке 13.26.
Рисунок 13.26 - Общая структура пенициллинов и готовая лекарственная форма ампициллина. Заимствовано из Интернет-ресурсов.
Пенициллин – это продукт жизнедеятельности грибов P. notatum, P.
446
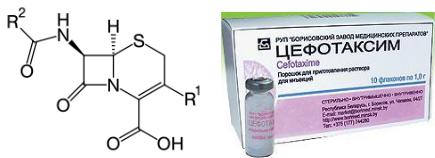
Рисунок 13.27 - Общая структура цефалоспоринов и готовая лекарственная форма цефотаксима. Заимствовано из Интернет-ресурсов.
Цефалоспорины I поколения проявляют активность преимущественно в отношении грамположительных микроорганизмов: Streptococcus spp. и метициллиночувствительных Staphylococcus spp. Обладают невысокой активностью в отношении грамотрицательных бактерий. К цефалоспоринам I поколения чувствительны большинство анаэробов, за исключением B. fragilis. Эти антибиотики применяют преимущественно для лечения инфекций кожи и мягких тканей легкой и средней степени тяжести.
Цефалоспорины II поколения несколько уступают препаратам I поколения по активности в отношении грамположительных кокков, но превосходят в отношении грамотрицательных микроорганизмов. К препаратам II поколения чувствительны Е. coli, Salmonella spp., Proteus mirabilis, Klebsiella spp., Proteus vulgaris, Citrobacter diversus.
Цефалоспорины III поколения проявляют высокую устойчивость к β- лактамазам грамотрицательных микроорганизмов. Они активны в отношении менингококков, гонококков, Н. influenzae и М. catarrhalis, а также всех представителей семейства Enterobacteriaceae. Цефотаксим, цефтриаксон и цефтазидим хорошо проникают через гематоэнцефалический барьер, обеспечивая терапевтические концентрации в ликворе.
Цефалоспорины IV поколения близки к цефалоспоринам III поколения. Однако они лучше проникают через цитоплазматическую мембрану грамотрицательных бактерий и обладают высокой устойчивостью к гидролизу хромосомными β-лактамазами. В результате этого они могут проявлять активность в отношении P. aeruginosa и неферментирующих грамотрицательных бактерий, резистентных к цефтазидиму. Цефепим также активен в отношении Enterobacter spp., Citrobacterfreundii, Serratia spp., Morganella morganii и др. Препарат показан для лечения тяжелых заболеваний разной локализации, вызванных полирезистентной микрофлорой, а также инфекций на фоне иммунодефицитных состояний.
3. Монобактамы (азтреонам). Из-за узкого спектра антибактериальной активности его используют в качестве препарата резерва для лечения поражений, вызванных аэробной грамотрицательной флорой, в том числе микроорганизмами семейства Enterobacteriaceae и P. aeruginosa, включая штаммы, устойчивые к аминогликозидам, уреидопенициллинам и цефалоспоринам (рисунок 13.28).
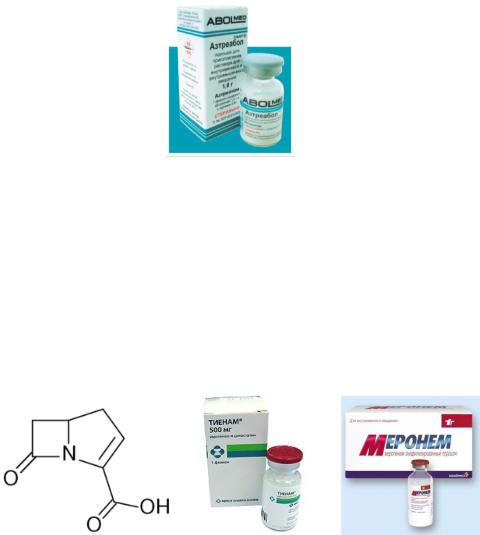
447
Рисунок 13.28 – Препарат азтреабол, содержащий азтреонам. Заимствовано из Интернет-ресурсов.
4. Карбапенемы (меропенем или меронем, имипинем) обладают широким спектром антибактериальной активности и высокой устойчивостью к бактериальным β-лактамазам. Они высокоэффективны при полимикробных, в том числе аэробно-анаэробных инфекциях. Карбапенемы применяются при тяжелых поражениях различной локализации преимущественно в качестве препаратов резерва. Общая структура и примеры карбапенемов представлены на рисунке 13.29.
Рисунок 13.29 - Общая структура и готовые лекарственные формы карбапенемов. Заимствовано из Интернет-ресурсов.
5. Гликопептиды (ванкомицин, тейкопланин) обладают относительно узким спектром действия на грамположительные аэробные и анаэробные микроорганизмы: стафилококки (в том числе метициллинрезистентные), стрептококки, пневмококки, энтерококки, пептострептококки, коринебактерии, клостридии. В отношении большинства микроорганизмов они оказывают бактерицидный эффект, связанный с нарушением синтеза клеточной стенки. На энтерококки, некоторые стрептококки и коагулазонегативные тафилококки действуют бактериостатически. Гликопептиды - это препараты выбора при инфекциях, вызванных метициллинрезистентными стафилококками, энтерококками, устойчивыми к ампициллину и аминогликозидам. Ванкомицин обладает ото- и нефротоксичностью. Общая структура и пример гликопептидов представлены на рисунке 13.30.

448
Рисунок 13.30 – Общая структура и готовая лекарственная форма ванкомицина. Заимствовано из Интернет-ресурсов.
6.Полипептиды (грамицидин, бацитрацин, ристомицин, полимиксины). Грамицидин - это полипептид, продуцируемый В. brevis. Этот антибиотик обладает активностью в отношении стафилококков, стрептококков, сальмонелл, кишечной палочки, бацилл, клостридий и других бактерий. Бацитрацин – это антибиотик, продуцируемый B. subtilis. Наибольшую активность он проявляет по отношению к грамположительным бактериям. Используется при лечении инфицированных ран. Оказывает токсическое действие на почки. Ристомицин – антибиотик, продуцируемый Proactinomyces fructiveri. Подавляет развитие стафилококков, стрептококков, листерий, бацилл, клостридий. Полимиксины (полимиксин В, полимиксин Е или колистин, полимиксин М) – группа антибиотиков, образуемых некоторыми штаммами B. polymyxa. Антибиотики этой группы проявляют активность в отношении грамотрицательных бактерий (синегнойной палочки, кишечной палочки, сальмонелл, пастерелл и других бактерий). К полимиксинам резистентны кокки, микобактерии, протей. В обычно применяемых дозах антибиотики этой группы оказывают бактериостатическое действие, а в высоких концентрациях только бактерицидное. Полимиксины токсичны, поэтому чаще всего применяются местно.
7.Макролиды (эритромицин, азитромицин, кларитромицин, спирамицин, рокситромицин и другие) - антибиотики, обладающие бактериостатическим действием и преимущественной активностью в отношении грамположительных кокков (кроме энтерококков) и внутриклеточных возбудителей (хламидии, микоплазмы, кампилобактеры). Макролиды относятся к числу наименее токсичных антибиотиков. Их назначают при инфекциях дыхательных путей, кожи, мягких тканей и мочеполовой системы. На рисунке 13.31 представлена основа химической структуры и пример макролидов.

450
9. Аминогликозиды (стрептомицин, гентамицин, амикацин, тобрамицин, канамицин) - это группа антибиотиков широкого спектра действия. Они подразделяются на три поколения.
Аминогликозиды I поколения (стрептомицин, неомицин и канамицин) в настоящее время имеют ограниченное применение. Стрептомицин синтезируется Act. streptomycini. Он подавляет рост грамположительных и грамотрицательных микробов (стафилококков, стрептококков, салмонелл, шигелл, возбудителя туберкулеза). Антибиотик действует на микробы бактерицидно. Стрептомицин не подавляет рост анаэробных бактерий, грибов, риккетсий. К стрептомицину быстро вырабатывается резистентность, поэтому он применяется часто в сочетании с другими антибиотиками. При длительном парентеральном применении стрептомицина отмечается поражение органа слуха. Стрептомицин обладает общим нейротоксическим действием: угнетает дыхание, нарушает выделительную функцию почек.
Неомицин - антибиотик, продуцируемый Act. fradiae. Его антибактериальная активность выше, чем у стрептомицина, но он более токсичен. Вызывает потерю слуха и поражение почек, в связи с чем используют редко.
Канамицин выделен из культуральной жидкости Act. kanamyceticus. По биологическим свойствам он сходен со стрептомицином и неомицином.
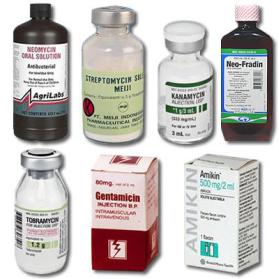
Аминогликозиды II поколения (гентамицин) и III поколения (сизомицин, тобрамицин, амикацин, нетилмицин) активны в отношении микроорганизмов семейства Enterobacteriaceae, неферментирующих грамотрицательных бактерий (P. aeruginosa, Acinetobacter spp.), стафилококков. Аминогликозиды обладают ототоксичностью и нефротоксичностью. Представители аминогликозидов представлены на рисунке 13.33.
Рисунок 13.33 – Готовые лекарственные формы аминогликозидов. Заимствовано из Интернет-ресурсов.
10. Ансамицины (рифамицин, рифампицин, рифабутин). Рифампицин обладает широким спектром антимикробной активности. Действует бактерицидно. Рифампицин является противотуберкулезным препаратом. Применяют для лечения
