
Иллюстрационное пособие по общей микробиологии
.pdf431
осаждения или кристаллизации из водной среды, экстракции, сорбции на ионнообменных материалах, перекристаллизации. После ферментации и выделения антибиотиков из культуральной жидкости они подвергаются очистке от балластных примесей.
5.Высушивание готового продукта с помощью лиофилизации или распылительной сушки. Стандартизация готового препарата по содержанию антибиотика.
6.При производстве пероральных препаратов осуществляется таблетирование с последующей расфасовкой в емкостную тару или путем запрессовывания в упаковочный материал.
7.При производстве антибиотиков в жидком виде для парентерального применения производится фасовка препарата в асептических условиях в ампулы или флаконы. При необходимости производится высушивание препарата в сублимационных установках.
8.Этикетирование готового продукта.
Биосинтез с последующей химической модификацией используется при получении полусинтетических антибиотиков. У полусинтетических препаратов сохраняется основное ядро исходной молекулы антибиотика, а некоторые радикалы удаляются или заменяются. Особенно большие успехи были достигнуты в получении полусинтетических пенициллинов. Ядром молекулы пенициллина является 6-аминопенициллановая кислота (6-АПК), состоящая из β-лактамного и тиозолидинового колец. 6-АПК обладает низкой антибактериальной активностью. При присоединении к молекуле 6-АПК бензильной группы получают бензилпенициллин, который отличается высокой антимикробной активностью. Замена бензильного остатка в молекуле бензилпенициллина на другие органические соединения позволила получить такие антибиотики как метициллин, оксациллин, ампициллин.
Химический синтез антибиотиков предусматривает создание препаратов синтетическим путем без использования природных предшественников. В частности, фторхинолоны были синтезированы на основе налидиксовой кислоты (производное нафтиридина) и оксолиниевой кислоты (производное хинолона). Фторхинолоны дополнительно содержали атом фтора и пиперазиновое кольцо. В результате этого фторхинолоны обладают выраженной противомикробной активностью и широким спектром действия.
Перспективные биотехнологические разработки получения антибиотиков:
-методы иммобилизации антибиотиков;
-модификация молекул естественных антибиотиков химическими методами;
-применение генно-модифицированных продуцентов антибиотиков.
Причины поиска и разработки новых антибиотиков:
-малая чувствительность некоторых патогенных микроорганизмов к применяемым антибиотикам;
-формирование резистентных форм микроорганизмов при длительном применении антибиотиков;
-расширение сферы применения антибиотиков.
432
13.5. Требования, предъявляемые к антимикробным препаратам
К антимикробным препаратам предъявляются определенные требования:
1. Отсутствие токсического действия на организм человека (безвредность препарата). Безвредность устанавливается с помощью химиотерапевтического индекса - отношения максимально переносимой дозы к минимальной терапевтической дозе или минимальной терапевтической дозы к максимально переносимой дозе. При индексе соответственно больше 3 или меньше 1 препарат может быть использован для лечения инфекционного заболевания, поскольку его терапевтическая доза будет меньше переносимой дозы. Величина химиотерапевтического индекса может быть определена по формуле:
Т = МИК/К,
где Т – терапевтический индекс; МИК – минимальная ингибирующая концентрация (мкг/мл); К - концентрация антибиотика (мкг/мл) в очаге инфекции (или в крови) при введении терапевтических доз препарата (таблица 13.4).
Таблица 13.4 – Концентрация антибиотиков в крови (К) после введения среднетерапевтических доз препарата
Антибиотик |
К, мкг/мл |
|
Ампициллин |
15 - 25 |
|
Бензилпенициллин |
0,52 (ЕД/мл) |
|
Ванкомицин |
10 |
– 15 |
Гентамицин |
6 |
– 8 |
Канамицин |
15 |
– 20 |
Линкомицин |
10 |
– 15 |
Метициллин |
10 |
– 15 |
Оксациллин |
4 |
– 6 |
Олеандомицин |
3 |
– 5 |
Полимиксин В |
10 |
– 15 |
Рифампицин |
15 |
– 25 |
Стрептомицин |
20 |
– 25 |
Тетрациклин |
3 |
– 5 |
Тобрамицин |
6 |
– 8 |
Фузидиевая кислота |
10 |
– 20 |
Хлорамфеникол |
5 – 10 |
|
Цефалексин |
15 |
– 25 |
Эритромицин |
3 - 5 |
|
Химиотерапевтический индекс (ХТИ) может быть рассчитан также по формуле: ХТИ=МПД/МЛД, где МПД – максимальная переносимая доза, а МЛД – минимальная лечебная доза. ХТИ определяет токсичность препарата: чем ХТИ выше, тем менее токсичен препарат.
2. Выраженное избирательное действие на микроорганизмы, определяемое антимикробным спектром - преимущественным действием на те или иные бактерии (грамположительные или грамотрицательные).
433
3.Бактериостатическое или бактерицидное действие
(микробостатическое или микробоцидное действие) - полное или частичное подавление роста и размножения бактерий или их гибель.
4. Отсутствие у бактерий способности к формированию лекарственно-
устойчивых форм.
Критерии активности антибактериального препарата:
-минимальная ингибирующая концентрация (МИК) - наименьшая концентрация препарата, тормозящая рост тест-культуры микробов;
-минимальная бактерицидная концентрация (МБК) - наименьшая концентрация препарата, вызывающая бактерицидный эффект.
При клиническом использовании антибиотики дозируются из расчета на 1 кг веса или на всю массу тела человека. В обоих случаях дозы варьируют в зависимости от пути введения, возраста и состояния больного, тяжести болезни, состояния органов выделения, степени чувствительности бактерий к антибиотику и свойств препарата. Например, при введении препарата через рот доза его в 2-4 раза больше, чем при внутримышечном ведении; при сепсисе вводят максимальное количество препарата и по возможности внутривенно; ослабленным больным вводят половину обычной дозы.
Различают следующие дозы антибиотиков:
-лечебная доза - доза, оказывающая выраженный терапевтический эффект при определенном способе введения;
-профилактическая доза - доза, оказывающая профилактический эффект при принятом способе введения препарата;
-стимулирующая доза - доза антибиотика, оказывающая стимулирующий эффект при введении с другими препаратами;
-токсическая доза - доза препарата, оказывающая токсический эффект при принятом способе введения;
-смертельная (летальная) доза - доза антибиотика, вызывающая летальный эффект при однократном введении в организм.
Изучением процессов поступления антибиотиков в организм и распределения его в тканях организма занимается фармакокинетика и фармакодинамика. Под фармакокинетикой понимают процесс изменения концентрации препарата в организме в течение времени. Фармакокинетика изучает такие вопросы как всасывание препарата, распределение его по органам и тканям (тканевая диффузия), метаболизм антибиотика (расщепление препарата в организме) и его экскреция. С учетом фармакокинетики определяют интервал между введениями антибиотика и способ его введения. Терапевтически эффективным считается уровень препарата, который в течение длительного времени при минимальной концентрации оказывает тормозящий эффект на возбудителя.
Под фармакодинамикой понимают специфическое действие препарата на макроорганизм и возбудитель, находящийся в организме. Фармакодинамика изучает также механизмы действия антибиотика, выявляет связь между концентрацией препарата и достигнутым эффектом. Антибиотик лишь воздействует на возбудителя заболевания - окончательная ликвидация инфекционного процесса происходит в результате мобилизации защитных механизмов макроорганизма.
Прежде чем назначать тот или иной антибиотик, необходимо знать его
434
свойства, способ введения, спектр и механизм противомикробного действия, срок сохранения в организме и пути выведения из организма, а также показания к применению. Нельзя использовать антибиотикотерапию в течение длительного времени, так как продолжительный прием антибиотиков приводит к угнетению нормальной микрофлоры организма. Одновременно с этим размножается нечувствительная к антибиотику микрофлора, обусловливающая дисбактериозы, сопровождающиеся гастроэнтеритом, колитом, кандидозом и другими заболеваниями.
Выбор антибиотиков обязательно должен проводиться по фармакологическим критериям (в зависимости от концентрации в очаге инфекции). Так, высокую концентрацию в моче создают пенициллин, ампициллин, аминогликозиды, тетрациклины; в костной ткани – аминогликозиды, макролиды, линкомицин, тетрациклины; в желчи – ампициллин, тетрациклины, макролиды, левомицетин; в легочной ткани – тетрациклины, макролиды; проходящие через гемато-энцефалический барьер – пенициллины, ампициллин.
Антибиотики применяют не только с лечебной, но и с профилактической целью. Показания для профилактического назначения антибиотиков:
- cанация микробоносителей с целью прекращения носительства и выделения микроорганизма (стафилококков, менингококков, коринебактерий дифтерии);
-предупреждение инфицирования в период эпидемий (рифампицин элиминирует носительство менингококка);
-повышенная чувствительность к инфекции у пациентов групп риска (с пониженным питанием или с ожирением, у пожилых и с иммунодефицитом);
-перед плановой хирургической операцией.
13.6. Определение чувствительности бактерий к антибиотикам
При использовании антибиотиков выраженный лечебный эффект достигается в случае применения тех препаратов, к которым возбудитель наиболее чувствителен. Определение чувствительности возбудителя к антибиотикам проводится перед началом лечения и периодически – в ходе лечения. В настоящее время на практике используются следующие методы определения чувствительности микроорганизмов к антибактериальным препаратам.
1. Метод серийных разведений в жидких средах. В жидкие среды с серийными разведениями антибиотиков вносят исследуемую культуру, инкубируют посевы 10-18 часов при 37°С, и учитывают результаты визуально или нефелометрически. Иногда в среду добавляют глюкозу и индикатор, что позволяет учитывать результаты по изменению окраски среды. Этот метод позволяет установить минимальную ингибирующую концентрацию (МИК) или минимальную подавляющую концентрацию (МПК) препарата для конкретного возбудителя. Исследование можно выполнять в различных объемах питательной среды - от 1 до 10 мл; в качестве питательной среды обычно используют МПБ или любую другую среду, соответствующую питательным потребностям возбудителя. В пробирках с питательной средой готовят серию двойных разведений антимикробного препарата.
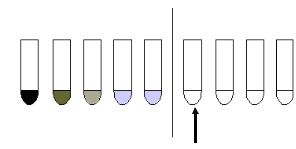
435
Вкачестве контроля используют пробирку с питательной средой без антибиотика.
Вкаждую пробирку (с антибиотиком и контрольную) вносят суспензию бактерий с концентрацией 106 микробных клеток/мл. Пробирки инкубируют 10-18 часов при 37°С (или до появления бактериального роста в контрольной пробирке). По истечении указанного срока учитывают результаты. МПК соответствует наибольшему разведению препарата, тормозящему рост тест-культуры (рисунок
13.17).
Концентрация антибиотика, мкг/мл |
||||||
0 0,25 0,5 |
1 |
2 |
4 |
8 |
16 |
32 |
Рост бактерий |
Рост отсутствует |
|
МПК |
Рисунок 13.17 – Определение МПК методом разведения в жидкой питательной среде.
2.Метод серийных разведений в плотных средах. Метод аналогичен предыдущей процедуре, но проводится на плотных питательных средах. При использовании этого метода готовят серийные разведения антимикробного препарата, затем вносят каждое разведение в пробирки, содержащие охлажденную агаровую среду. Содержимое пробирки после перемешивания быстро переносят в чашки Петри либо пробирки “скашивают” до застывания агара. Затем агар засевают исследуемой культурой (петлей или специальным дозатором). Посевы инкубируют 18-20 часов при 37°С. После инкубирования посевов определяют МИК по отсутствию роста на чашках или в пробирках, содержащих наименьшие концентрации препарата.
3.Диффузионные методы. Эти методы менее чувствительны, чем методы стандартных разведений, но проще по выполнению. На практике их применяют чаще. Эти методы позволяют определять чувствительность бактерий к нескольким антибиотикам одновременно.
Классический метод. В чашки Петри вносят тонкий слой (4-5 мм) плотной питательной среды. После застывания на поверхность агара наносят микробную взвесь (105 клеток/мл) и равномерно распределяют по поверхности агара. Излишки суспензии удаляют, а чашки подсушивают в термостате. Затем в агаре пробивают лунки и в каждую вносят по 0,1 мл раствора исследуемого антибиотика, после чего чашки помещают в термостат. После инкубирования в оптимальных условиях измеряют диаметр зоны подавления роста вокруг лунки для каждого препарата
(рисунок 13.18).

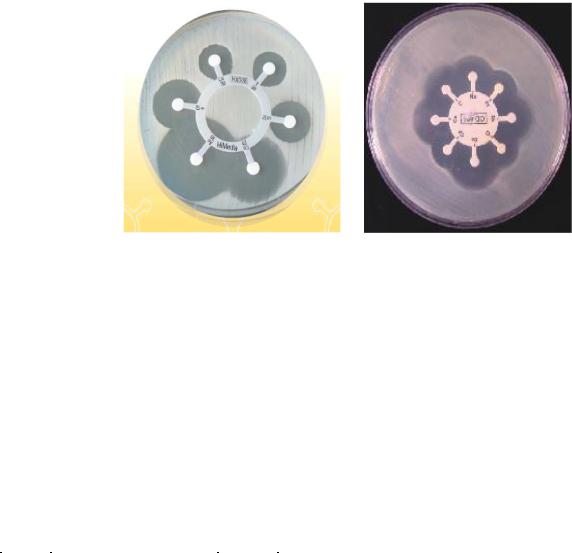
437
За рубежом выпускаются гексадиски (6 объединенных дисков) и октодиски (8 объединенных дисков), позволяющие определять чувствительность бактерий одновременно к 6 или 8 антибиотикам (рисунок 13.21).
а б Рисунок 13.21 – Гексадиски (а) и октодиски (б) для определения чувствительности
бактерий к антибиотикам. Заимствовано из Интернет-ресурсов.
Зоны задержки роста культур измеряют с помощью линейки. Полученные размеры зон сравнивают с величинами зон задержки роста, указанными в инструкции, после чего микроорганизмы относят к той или иной группе (чувствительным, умеренно чувствительным или резистентным). Показатели активности основных антибиотиков, определяемые методом стандартных индикаторных дисков, представлены в таблице 13.5.
Таблица 13.5 – Показатели активности основных антибиотиков, определенные методом стандартных индикаторных дисков
№№ |
Антибиотики |
Код |
Содержание |
Диаметр зоны отсутствия роста, мм |
||
пп |
|
диска |
антибиотика в |
устойчивые |
умеренно |
чувстви- |
|
|
(лат.) |
диске, мкг |
|
устойчивые |
тельные |
1. |
Азтреонам |
АТМ |
30 |
≤15 |
16-21 |
≥22 |
|
|
(Ао) |
|
|
|
|
2. |
Амоксициклин |
АКК |
10 |
≤10 |
11-12 |
≥13 |
|
(амоксиклав) |
(Ас) |
|
|
|
|
3. |
Ампициллин |
АМП |
10 |
≤9 |
10-13 |
≥14 |
|
|
(А) |
|
|
|
|
4 |
Бензилпенициллин |
ПЕН |
6 |
≤11 |
12-21 |
≥22 |
|
|
(Р) |
|
|
|
|
5. |
Ванкомицин |
ВА |
30 |
≤14 |
15-16 |
≥17 |
|
|
(Va) |
|
|
|
|
6. |
Гентамицин |
ГЕН |
10 |
≤13 |
- |
≥14 |
|
|
(G) |
|
|
|
|
7. |
Доксициклин |
ДОК |
10 |
≤12 |
13-19 |
≥20 |
|
|
(Do) |
|
|
|
|
8. |
Канамицин |
КАН |
30 |
≤14 |
15-18 |
≥19 |
|
|
(К) |
|
|
|
|
9 |
Карбенициллин |
КАР |
25 |
≤14 |
15-18 |
≥19 |
439
используют универсальную оценочную шкалу (таблица 13.6).
Таблица 13.6 – Ориентировочная (универсальная) шкала оценки чувствительности микроорганизмов к антибиотикам при использовании диско-
диффузионного метода
Диаметр зоны торможения роста (в мм) |
Чувствительность микроорганизмов |
10 |
нечувствительны |
10 – 15 |
слабо чувствительны |
15 – 20 |
чувствительны |
20 – 25 |
высокочувствительны |
Таким образом, если зона задержки роста составляет 15-25 мм, то микробы считают чувствительными к антибиотикам, до 15 мм - малочувствительными, а отсутствие зоны указывает на резистентность бактериальной культуры к данному антибиотику. Этот метод используется только для “быстрорастущих” микроорганизмов, образующих сплошной рост на плотной питательной среде (в виде “газона”) через 18-20 часов экспозиции.
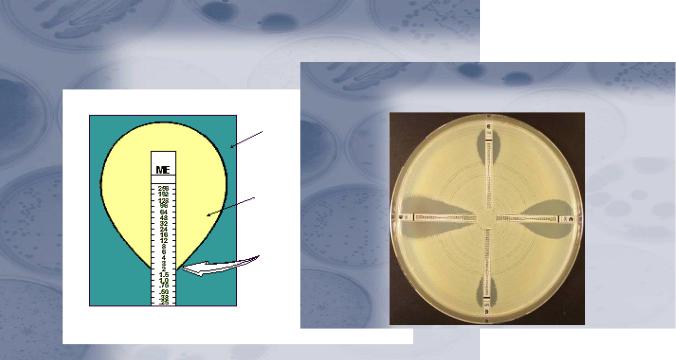
Е-тест представляет собой модификацию метода дисков. В этом тесте вместо дисков используется полоска, содержащая разные концентрации антибиотика на
разных участках. Каждая зона полоски имеет соответствующую маркировку.
Полоска помещается на поверхность агара с бактериальной культурой. Зона |
||
|
эллипсовидную форму. |
|
Е-тест |
соответствует тот участок |
|
культуры (рисунок |
||
|
||
1 |
|
|
|
Вариант постановки Е-теста |
|
Зона |
|
Зона |
|
МПК 2 |
а |
86 |
б |
85
Рисунок 13.22 – Схема интерпретации результатов опыта (а) и определение МПК с помощью Е-теста (б). Заимствовано из Интернет-ресурсов.
Автоматические системы учета результатов метода серийных разведений представляют собой инкубационные системы со встроенными фотометрами, регистрирующими рост бактерий в лунках микропанелей, содержащих антибиотики. Например, устройство VITEK 2 позволяет получать результаты уже через 4-10 часов, при этом определяет минимальную ингибирующую концентрацию более 100 антимикробных препаратов (рисунок 13.23).

АМП |
|
|
• |
Обеспечивают по |
|
|
результата вместе |
|
|
антибиотикограм |
|
|
день получения ч |
|
|
культуры |
|
• |
Идентификация б |
|
|
таксонов |
|
• |
Определение |
|
|
чувствительности |
|
Рисунок 13.23 – Устройство VITEK 2 для автоматической идентификации |
||
|
(минимальных |
|
определения чувствительности бактерий к антимикробным препаратам. |
||
Заимствовано из Интернет-ресурсов. |
ингибирующих |
|
концентраций) к |
||
|
||
|
антимикробных |
|
На практике величина МПК позволяет отнести исследуемый штамм |
||
|
препаратов |
|
микроорганизма к одной из трех общепринятых категорий: - чувствительный микроб; - умеренно-устойчивый микроб; - устойчивый микроб.
Микроорганизм считается чувствительным, если у него нет устойчивости к данному лекарственному средству, и при лечении стандартными дозами этого препарата отмечается хорошая терапевтическая эффективность.
Устойчивым к антимикробному средству считают микроорганизм, если он имеет механизмы резистентности к данному препарату и при лечении инфекций, вызванных этим микроорганизмом, нет клинического эффекта даже при использовании максимальных терапевтических доз этого препарата.
Микроорганизмы относятся к умеренно-устойчивым, если по своей чувствительности они занимают промежуточное значение между чувствительными и устойчивыми штаммами и при лечении инфекций, вызванных данными возбудителями, клинический эффект наблюдается только при использовании высоких терапевтических доз препарата.
13.7. Антибиотикорезистентность микроорганизмов
Антибиотикорезистентность – это устойчивость микробов к антимикробным препаратам. Микробы считаются резистентными в том случае, когда они не обезвреживаются такими концентрациями антибиотиков, которые создаются в организме при введении принятых доз. Таким образом, бактерии являются резистентными к препарату, если он в терапевтической концентрации не подавляет размножения этого микроорганизма. В этом случае минимальная подавляющая концентрация in vitro выше, чем в тканях или в сыворотке крови. Целый ряд микробов под влиянием антибиотиков, особенно при неправильном их применении, утрачивает чувствительность к ним и образует антибиотикорезистентные формы. В настоящее время число лекарственно-устойчивых форм бактерий повсеместно возрастает. Так, частота обнаружения пенициллиноустойчивых стафилококков доходит до 90-98%, стрептомициноустойчивых – до 60-70% и выше, резистентность
