
- •Оглавление
- •От издательства
- •Из предисловия к первому изданию
- •Введение
- •Механика
- •Кинематика
- •Динамика
- •Статика
- •Работа и энергия
- •Криволинейное движение
- •Гидростатика
- •Аэростатика
- •Теплота. Молекулярная физика
- •Молекулярная теория
- •Свойства газов
- •Свойства жидкостей
- •Упругость и прочность
- •Свойства паров
- •Физика атмосферы
- •Тепловые машины
- •Ответы и решения к упражнениям
- •Предметный указатель
Г л а в а XII. МОЛЕКУЛЯРНАЯ ТЕОРИЯ
§ 213. Молекулы и атомы. В настоящем разделе книги мы изучаем изменение теплового состояния тел, характеризуемого их температурой, переход тел из твердого состояния в жидкое, из жидкого — в газообразное и обратно и т. д. Естественно возникает вопрос: что происходит внутри тел, когда меняется их температура, когда они плавятся или испаряются, и т. д. Ответы на этот вопрос, равно как и на ряд других, относящихся к свойствам вещества, дает молекулярная теория.
Уже в глубокой древности, за две с половиной тысячи лет до нашего времени, зародилось представление, что все окружающие нас тела состоят из мельчайших частиц, недоступных непосредственному наблюдению. Однако лишь за последние 150 лет развилось и было экспериментально обосновано современное учение о молекулах и атомах.
Молекулами называются мельчайшие частицы, из которых состоят различные вещества. При этом в одних случаях, например у паров металлов, у инертных газов (гелий, аргон
идр.), мельчайшие частицы вещества представляют собой отдельные атомы; в других же случаях подобные частицы состоят из нескольких атомов, например: у водорода, кислорода и азота
— из двух, у углекислоты — из трех и т. д. Молекулы сложных веществ — не элементов — состоят из атомов различных элементов, входящих в их состав. Такое представление о строении тел позволило объяснить основные законы химии: закон постоянных отношений и закон кратных отношений.
Закон постоянных отношений состоит в том, что при образовании любого количества какого-либо химического соединения массы соединяющихся веществ всегда находятся в совершенно определенном отношении. Например, при образовании воды из водорода и кислорода массы входящих в соединение водорода
икислорода всегда относятся, как 1:8. С точки зрения представлений об атомах и молекулах этот опытный факт сразу становится понятным. В самом деле, например, для образования воды два атома водорода соединяются с одним атомом кислорода, т. е. молекула воды имеет состав H2O. Отношение масс водорода
Гл. XII. Молекулярная теория |
409 |
и кислорода должно быть равно отношению удвоенной массы атома водорода к массе атома кислорода и потому всегда будет одним и тем же, каково бы ни было количество образовавшейся воды. Это связано с тем, что все атомы водорода одинаковы и их масса всегда одна и та же и что все атомы кислорода тоже не отличаются по массе один от другого.
Закон кратных отношений состоит в том, что, когда два элемента образуют несколько соединений, массы одного из элементов в разных соединениях относятся, как целые числа. Например, азот и кислород дают пять соединений. Массы кислорода в них, приходящиеся на одну и ту же массу азота, относятся, как целые числа — как 1:2:3:4:5. Этот факт объясняется тем, что одно и то же число атомов одного элемента (2 атома азота в нашем примере) в молекулах разных соединений связано с разным числом атомов другого элемента (в нашем примере с 1, 2, 3, 4 и 5 атомами кислорода). Эти соединения имеют состав: N2O, N2O2, N2O3, N2O4, N2O5.
§ 214. Размеры атомов и молекул. Представление о молекулярном строении тел на первый взгляд не согласуется с нашим обычным опытом: мы не наблюдаем этих отдельных частиц, тела представляются нам сплошными. Однако это возражение нельзя считать убедительным. М. В. Ломоносов в одной из своих работ писал: «Нельзя также отрицать движение там, где глаз его не видит; кто будет отрицать, что движутся листья и ветви деревьев при сильном ветре, хотя издали он не заметит никакого движения. Как здесь из-за отдаленности, так и в горячих телах вследствие малости частичек вещества движение скрывается от взоров». Итак, причина кажущегося разногласия в том, что атомы и молекулы чрезвычайно малы.
В лучший оптический микроскоп, который дает возможность различать предметы, размеры которых не меньше (2–3) · 10−7 м, рассмотреть отдельные молекулы, даже самые крупные, нельзя. Однако целый ряд косвенных методов позволил не только надежно доказать существование молекул и атомов, но даже установить их размеры. Так, размер атома водорода можно считать равным 1,2 · 10−10 м; длина молекулы водорода, т. е. расстояние между центрами двух атомов, ее составляющих, равна 2,3 · 10−10 м. Существуют более крупные молекулы, например молекулы белка (альбумин) имеют размеры 4,3 · 10−6 м. В последние годы благодаря устройству специального прибора, позволяющего исследовать объекты чрезвычайно малых размеров, —
410 Гл. XII. Молекулярная теория
электронного микроскопа — оказалось возможным сфотографировать не только крупные молекулы, но и атомы.
О том, что размеры молекул чрезвычайно малы, можно судить и без измерений, исходя из возможности получать очень малые количества разных веществ. Разведя 1 мл чернил (например, зеленых) в литре чистой воды, а затем разведя 1 мл этого раствора еще раз в литре воды, мы получим разведение в 1 000 000 раз. И все же мы увидим, что последний раствор имеет заметную зеленую окраску и вместе с тем вполне однороден. Следовательно, в самом малом объеме, который еще может
различить глаз, даже при таком |
разведении находится |
очень |
|||
|
много молекул красящего вещества. |
||||
|
Это показывает, как малы эти моле- |
||||
|
кулы. |
|
|
|
|
|
Золото |
можно |
расплющивать |
||
|
в листки толщины 0,1 мкм, а обра- |
||||
|
батывая такие листки водным рас- |
||||
Рис. 370. Схемы строения |
твором |
цианистого |
калия, |
можно |
|
молекул воды (а) и углекис- |
получать |
листки золота толщины |
|||
лого газа (б) |
0,01 мкм. Следовательно, размер мо- |
||||
|
лекулы золота значительно меньше |
||||
|
одной сотой доли микрометра. |
||||
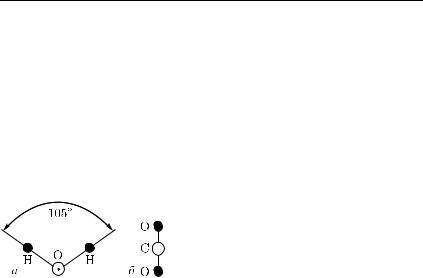
На рисунках мы будем изображать молекулы в виде шариков. Однако молекулы (а также, как увидим дальше, и атомы) имеют строение, различное у разных веществ, часто довольно сложное. Известны, например, форма и строение не только таких простых молекул, как H2O и CO2 (рис. 370), но и несравненно более сложных, содержащих многие тысячи атомов.
§ 215. Микромир. Успехи в изучении строения вещества, о которых говорилось в предыдущих параграфах, раскрыли перед исследователями природы новый мир — мир мельчайших частиц. Его называют микромиром; в отличие от мира крупных тел, или макромира (от греческих слов: «микрос»´ — малый, «м´акрос» — большой), микромир недоступен непосредственному наблюдению, и для изучения его требуются особые, тонкие методы. Микромир оказался чрезвычайно сложным. Как уже говорилось, любое тело, которое в механике рассматривалось как сплошное, при использовании новых методов исследований оказывалось сложной системой громадного числа непрерывно движущихся молекул. Молекулы оказались состоящими из еще более мелких частиц — атомов, причем в некоторых типах молекул число атомов оказалось очень большим. В свою очередь атомы оказа-
Гл. XII. Молекулярная теория |
411 |
лись сложными системами, состоящими из электронов и ядер, а сами ядра — состоящими из различных частиц, о которых будет рассказано в последнем томе нашего учебника.
Конечно, все, что происходит и наблюдается в макромире, взаимосвязано с состоянием частиц микромира и с их изменениями. Изменения теплового состояния тел — температурные изменения и переход тел из одного состояния в другое, например из твердого в жидкое, — оказались связанными, в основном,
сизменениями движения молекул и их взаимного расположения. Химические превращения, наблюдаемые в микромире, связаны
сизменениями атомного состава молекул.
Строение молекул или атомов, а также движения атомов, составляющих молекулы, и движения частиц, образующих атомы, проявляются в макромире в электрических, магнитных, оптических и других явлениях. Эта необычайная сложность микромира представила бы непреодолимые трудности для его познания, если бы не удалось разумно расчленить задачу. Оказывается возможным выделить более простые явления, обусловленные, например, молекулярными движениями, при изучении которых можно пренебречь более тонкими процессами микромира; далее следует перейти к изучению более тонких процессов и движений, связанных со структурой атомов и молекул, оставляя в стороне внутриядерные процессы, и т. д.
Таким образом, переходя от изучения более простых процессов и движений к более сложным, мы постепенно составляем себе все более детальную и глубокую картину микромира. Начнем с таких явлений, при которых можно не обращать внимания на внутреннюю структуру молекул, на движение составляющих молекулы атомов и на еще более тонкие внутриатомные и внутриядерные процессы и движения. Сюда относится обширная группа тепловых явлений, при которых молекулы можно рассматривать как неизменные малые тельца.
Итак, приступая к изучению микромира, ограничимся сначала изучением движения и расположения молекул, не рассматривая их внутреннего строения.
§ 216. Внутренняя энергия с точки зрения молекулярной теории. В предыдущей главе мы пришли к выводу, что, кроме механической энергии некоторой системы тел, зависящей от их скоростей (кинетическая энергия) и от их взаимного расположения (потенциальная энергия), каждому из тел, составляющих систему, присуща его внутренняя энергия, зависящая от состояния этого тела. Теперь можно уточнить понятие
412 |
Гл. XII. Молекулярная теория |
внутренней энергии. Внутренняя энергия есть кинетическая
ипотенциальная энергия частиц, составляющих микромир: молекул, из которых состоят макротела, атомов, из которых состоят молекулы, электронов и других частиц, составляющих атомы. В предыдущем параграфе мы указали, что в основном тепловые явления можно связать только с движением и расположением молекул как неизменных простых частиц. Поэтому, изучая простые явления, мы будем интересоваться только частью внутренней энергии тел, а именно, только кинетической энергией молекул, зависящей от скоростей их беспорядочного движения,
ипотенциальной энергией молекул, зависящей от их взаимного расположения.
Вслучае газов изменение внутренней энергии есть, в основном, изменение кинетической энергии беспорядочного движения их молекул; дело в том, что в газах взаимодействие между молекулами мало и изменениями потенциальной энергии при движении молекул можно пренебречь. В жидкостях и твердых телах взаимодействие молекул весьма велико, и изменение расстояния между молекулами резко изменяет потенциальную энергию их взаимодействия. Поэтому в случае жидких и твердых тел изменение внутренней энергии состоит и в изменении кинетической энергии беспорядочного движения молекул, и в изменении потенциальной энергии их взаимодействия.
Всвете молекулярных представлений становится ясно, что происходит, когда вследствие теплопроводности внутренняя энергия горячего тела (или горячей части тела) уменьшается, а холодного (или холодной части тела) увеличивается. При взаимодействии молекул происходит обмен их скоростями, подобно тому как происходит обмен скоростями при ударе упругих шаров (§ 102); а обмен скоростями связан с обменом кинетическими энергиями. В результате этого внутренняя энергия горячего тела уменьшается, а холодного — увеличивается, т. е. происходит выравнивание внутренней энергии, точнее, той ее части, которая является кинетической энергией молекул. Отсюда следует вывод, что температура тела связана с кинетической энергией молекул, из которых оно состоит. Подробнее будем говорить об этом далее (§ 243).
§ 217. Молекулярное движение. Сопоставим несколько простых фактов, позволяющих сделать заключение о движении молекул. Положим в стакан холодного чая кусок сахара. Сахар растает и образует густой сироп на дне стакана. Этот сироп хорошо виден, если посмотреть сквозь стакан на свет. Оставим
Гл. XII. Молекулярная теория |
413 |
стакан в покое на несколько часов. Останется ли сироп на дне стакана? Нет, он постепенно разойдется по всему стакану. Это распространение сахара по объему стакана происходит самопроизвольно, так как никто чая не перемешивал. Точно так же расходится по комнате запах (например, если открыть флакон с духами); это происходит даже и в том случае, если воздух в комнате совершенно неподвижен.
Произведем еще такой опыт: уравновесим на весах большой открытый сверху сосуд. Если в этот сосуд напустить углекислый газ, то равновесие нарушится, так как углекислый газ тяжелее воздуха. Однако через некоторое время равновесие восстановится. Дело в том, что углекислый газ разойдется по всему помещению, а сосуд будет заполнен воздухом с очень малой примесью углекислого газа. Во всех этих случаях одно вещество (сахар, пары ароматических веществ, углекислый газ) распространяется в другом (в воде, в воздухе). Это явление, при котором два вещества сами собой смешиваются друг с другом, называется диффузией. При диффузии вещество распространяется во все стороны, также и вверх, т. е. против силы тяжести. Явление диффузии показывает, что молекулы вещества все время движутся. Например, при диффузии сахара в воде разные молекулы растворенного сахара движутся в разные стороны между тоже движущимися молекулами воды, и, таким образом, сахар постепенно распространяется по всему сосуду, заполненному водой.
Итак, явление диффузии явно показывает, что молекулы все время движутся и притом в различных направлениях. Такое движение молекул можно обнаружить не только в газах и в жидкостях, но также и в твердых телах. Оно называется молекуляр-
ным тепловым движением.
Здесь может возникнуть вопрос: почему же мы при обычном наблюдении не замечаем этого движения в телах? То есть почему тело не движется как целое, хотя все его молекулы находятся
вдвижении? Объяснение лежит в том, что при молекулярном движении разные молекулы движутся в самых разнообразных направлениях, так что тело в целом покоится. При полной беспорядочности движения молекул и громадности их числа для любой молекулы найдется другая молекула, летящая приблизительно в противоположную сторону с той же скоростью. Так как газ заключен в оболочку, не дающую молекулам разлететься, то
вгазе движение молекул сводится к беспорядочному движению туда и обратно, по всем направлениям. Поэтому нет движения
вкакую-либо сторону.

414 |
Гл. XII. Молекулярная теория |
|
|
|
||||
§ 218. Молекулярное движение в газах, жидкостях и твер- |
||||||||
дых телах. |
Движение молекул в газах имеет беспорядочный |
|||||||
характер: скорости молекул не имеют какого-либо преимуще- |
||||||||
ственного направления, а распределены хаотически по всем на- |
||||||||
правлениям. Вследствие столкновений молекул между собой ско- |
||||||||
рости их все время меняются как по направлению, так и по |
||||||||
модулю. Поэтому скорости молекул могут сильно различаться |
||||||||
между собой. В любой момент в газе есть и молекулы, движущи- |
||||||||
еся чрезвычайно быстро, и молекулы, движущиеся сравнитель- |
||||||||
но медленно. Однако число молекул, движущихся значительно |
||||||||
медленнее или значительно быстрее, чем остальные, мало. Боль- |
||||||||
шинство молекул движется со скоростями, сравнительно мало |
||||||||
отличающимися от некоторой средней скорости, зависящей от |
||||||||
рода молекул и температуры тела. В дальнейшем, говоря о ско- |
||||||||
рости молекул, мы будем иметь в виду их среднюю скорость. |
||||||||
К вопросу об измерении и расчете средней скорости молеку- |
||||||||
лы обратимся позже. |
|
|
|
|
|
|
||
Во многих рассуждениях относительно движения молекул |
||||||||
газа играет важную роль понятие средней длины свободного |
||||||||
пробега. Средней длиной свободного пробега называют среднее |
||||||||
|
|
расстояние, |
пробегаемое |
|
молекула- |
|||
|
|
ми между двумя последовательны- |
||||||
|
|
ми столкновениями. С уменьшением |
||||||
|
|
плотности газа средняя длина свобод- |
||||||
|
|
ного пробега увеличивается. При ат- |
||||||
|
|
мосферном давлении и 0 ◦C средняя |
||||||
|
|
длина |
свободного |
пробега |
молекул |
|||
|
|
воздуха равна примерно 10−8–10−7 м |
||||||
|
|
(рис. 371). |
|
|
|
|
||
|
|
В очень разреженных газах (на- |
||||||
|
|
пример, внутри пустотных электриче- |
||||||
|
|
ских лампочек) средняя длина сво- |
||||||
|
|
бодного пробега достигает нескольких |
||||||
Рис. 371. Таким примерно |
сантиметров и даже десятков санти- |
|||||||
метров. Здесь молекулы движутся от |
||||||||
представляется |
путь мо- |
|||||||
стенки к стенке почти без столкнове- |
||||||||
лекулы воздуха при нор- |
||||||||
ний. В |
твердых телах молекулы ко- |
|||||||
мальном давлении (уве- |
||||||||
леблются около средних |
положений. |
|||||||
личено в миллион раз) |
||||||||
|
|
В жидкостях молекулы также колеб- |
||||||
лются около средних положений. Однако время от времени каж- |
||||||||
дая молекула переходит скачком в новое среднее положение, |
||||||||
отстоящее от предыдущего на несколько межмолекулярных рас- |
||||||||
стояний. |
|
|
|
|
|
|
|
|
Гл. XII. Молекулярная теория |
415 |
Представление о теплоте как о движении частичек тела было развито задолго до создания молекулярной теории М. В. Ломоносовым.
§ 219. Броуновское движение. Как мы видели, давление газа на стенку вызывается ударами молекул об нее. Но ведь число этих ударов за единицу времени случайно может оказаться то больше, то меньше. Поэтому можно предполагать, что сила давления газа на стенку не всегда должна иметь одно и то же значение: иногда она немного больше, иногда меньше. Так ли это? Можно ли обнаружить эти отклонения давления от постоянного значения? Непосредственно измерить эти колебания давления газа на стенку не удается — они слишком малы; но есть явления, которые можно наблюдать и которые объясняются именно наличием колебаний в числе и силе ударов молекул. Это, прежде всего, явление так называемого броуновского движения.
Если наблюдать в сильный микроскоп любые маленькие частицы, находящиеся даже в совершенно спокойной жидкости или газе (например, капельки жира в воде, частицы, из которых состоит дым, или капельки тумана в воздухе), то обнаруживается, что эти частицы непрерывно движутся, причем направление движения изменяется случайным образом. Движение меньших частиц сильнее, чем б´ольших. Это явление, открытое в 1827 г. английским ботаником Робертом Броуном (1773–1858), получило название броуновского движения. Причина явления очень долго оставалась непонятной, пока не было доказано, что это движение частиц вызвано толчками окружающих молекул жидкости или газа. Хотя молекулы жидкости (или газа) ударяют частицы со всех сторон, но все же их удары не уравновешивают полностью друг друга. Случайно иногда действие ударов на частицу с какой-нибудь стороны окажется несколько сильнее, чем с других сторон, в результате чего частица начнет двигаться в некотором направлении. Затем перевесят удары с ка- кой-нибудь другой стороны, и частица начнет двигаться в новом направлении. Результатом является беспорядочное движение частицы.
Подробное изучение этого явления не только подтвердило правильность такого объяснения, но его результаты позволили определить число молекул в единице объема жидкости и газа. Таким образом, броуновское движение явилось одним из наиболее непосредственных и ярких обоснований молекулярных представлений.

416 |
Гл. XII. Молекулярная теория |
§ 220. |
Молекулярные силы. Если открыть кран в трубке, |
соединяющей вверху два баллона, один из которых наполнен газом, а другой — пустой, то часть газа из первого немедленно перейдет во второй. Вещество, находящееся в газовом состоянии, всегда полностью занимает предоставленный ему объем. Если же первый баллон будет наполнен жидкостью или твердым телом, перехода вещества во второй (пустой) баллон не произойдет. Если пренебречь незначительным испарением, то и жидкость, и твердое тело останутся на своих местах.
Чем объясняется эта разница между поведением газов и жидкостей? Когда вещество находится в жидком состоянии, между его молекулами действуют силы, мешающие молекулам вещества разлетаться во все стороны. Будем называть эти силы молекулярными силами или силами сцепления. Весьма наглядно видно проявление сил сцепления, когда капельки дождя повисают
на проводах или |
листьях и некоторое время не падают вниз |
||||
|
|
|
|
(рис. 372). В этом случае силы сцепле- |
|
|
|
|
|
ния не только мешают молекулам раз- |
|
|
|
|
|
||
|
|
|
|
летаться во все стороны, но и уравно- |
|
|
|
|
|
вешивают силу тяжести, действующую |
|
Рис. 372. Повисшая кап- |
на каплю. |
||||
В твердых телах, очевидно, тоже |
|||||
ля воды удерживается от |
|||||
действуют силы сцепления, удержива- |
|||||
падения силами |
сцепле- |
||||
ющие молекулы друг около друга. |
|||||
ния. Слишком |
тяжелая |
||||
Почему же силы сцепления не про- |
|||||
капля падает |
|
|
|||
|
|
|
|
являются в газах и парах? Мы знаем, |
|
что в газах и парах молекулы удалены друг от друга, вообще говоря, на значительно большее расстояние, чем молекулы
вжидкостях и твердых телах. Естественно предположить, что силы сцепления быстро убывают с расстоянием и поэтому заметно действуют лишь на небольших расстояниях между молекулами; этим и объясняется, что они почти не проявляют себя
вгазах.
Это предположение может быть подкреплено следующими наблюдениями. Части стеклянного стакана прочно сцеплены между собой, и для их разъединения, т. е. для разрушения стакана, требуется значительная сила. Однако стоит стакану разбиться — и разбитые части уже не взаимодействуют между собой, если их прикладывать друг к другу. Дело в том, что, прикладывая части разбитого стакана друг к другу, мы сближаем лишь ничтожное число молекул. Остальные молекулы остаются на расстоянии хотя и небольшом, однако достаточном для того, чтобы взаимодействие молекул было ничтожно малым. Но нагретые и вследствие
Гл. XII. Молекулярная теория |
417 |
этого размягченные куски стекла при соприкосновении слипаются. В этом случае сближается до достаточно малого расстояния большое число молекул и силы взаимодействия оказываются большими.
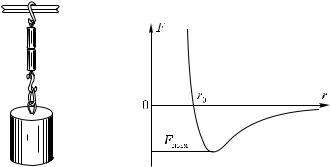
В случаях мягких материалов, применяя достаточные силы, можно привести в соприкосновение большое число молекул и при не совсем ровной поверхности. Это, например, можно сделать со свинцом. Если два свежесрезанных свинцовых бруска прижать друг к другу, то они слипаются так, что могут выдержать вес большой гири (рис. 373).
Рис. 373. |
Свинцовые |
бруски |
Рис. 374. Зависимость силы |
слипаются |
настолько |
сильно, |
взаимодействия F молекул от |
что выдерживают тяжесть боль- |
расстояния r между ними |
||
|
шой гири |
|
|
Мы пришли к заключению, что молекулы жидкостей и твердых тел взаимно притягиваются. Однако это не объясняет нам всех свойств жидкостей и газов. В самом деле, жидкости и твердые тела гораздо труднее сжимаются, чем газы. Чтобы уменьшить их объем, например на 1 %, жидкости (и твердые тела) нужно подвергнуть несравненно большему давлению, чем газы.
Чем же объяснить, что при сжатии жидкостей (и твердых тел) возникает громадное давление, препятствующее этому сжатию? Для объяснения этого факта мы должны предположить, что при уменьшении расстояния между молекулами жидкого или твердого тела между ними возникают большие силы отталкивания.
На рис. 374 показана примерная зависимость силы взаимодействия F от расстояния между молекулами r. Положительная сила соответствует отталкиванию молекул, отрицательная —
14 Г. С. Ландсберг

418 |
Гл. XII. Молекулярная теория |
притяжению |
молекул друг к другу 1). Расстояние r0 отвечает |
устойчивому равновесному (ненапряженному) состоянию тела. В этом состоянии F = 0.
При отклонении r от значения r0 возникают силы, стремящиеся восстановить равновесное состояние. Из рисунка видно, что при смещении от значения r0 в сторону больших r между молекулами возникает сила притяжения, сначала резко возрастающая по модулю до значения Fmax, а затем постепенно убывающая по мере увеличения r. При смещении от значения r0 в сторону меньших r возникает сила отталкивания, очень быстро возрастающая при уменьшении r.
Вследствие теплового движения молекулы совершают малые колебания около равновесных положений, в процессе которых силы притяжения сменяются силами отталкивания и наоборот. Чтобы сжать жидкость (например, сдавить воду в цилиндре поршнем), нужно уменьшить средние расстояния между молекулами. При этом возникают все возрастающие силы отталкивания между молекулами, благодаря чему увеличивается давление жидкости на стенки сосуда. Мы видели, что у жидкостей ничтожное уменьшение объема связано с очень большим увеличением давления. Эти рассуждения можно отнести также и к твердым телам.
Средние расстояния между молекулами газов, находящихся при обычных условиях (комнатная температура, атмосферное давление) составляют десятки равновесных расстояний r0, вследствие чего силы притяжения между молекулами газа крайне малы. Поэтому молекулы газа разлетаются во все стороны вследствие молекулярного движения. Однако эти рассуждения неприменимы к сильно сжатым газам: в сжатых газах взаимодействие молекул сказывается заметно.
1) Баланс сил притяжения и отталкивания между молекулами или атомами газа играет решающую роль при процессах его сжижения. Этим определяется температура и давление, при которых газ может быть переведен в жидкое состояние.
