
ИСПОЛЬЗОВАНИЕ ДНК-ТЕХНОЛОГИЙ В МЕДИЦИНЕ - МЕТОДЫ ПЦР И СЕКВЕНИРОВАНИЯ. ГЕННАЯ ТЕРАПИЯ
.pdf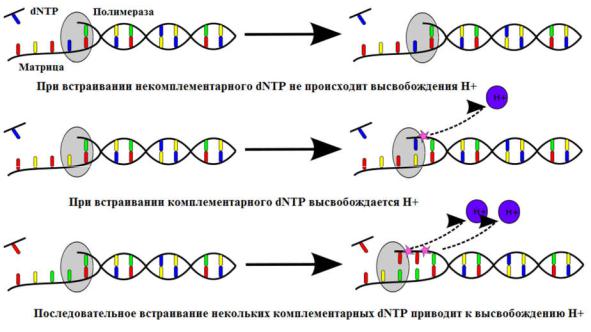
выделяющихся в среду в ходе ферментативного синтеза ДНК. Вначале, одним из стандартных методов создают иммобилизованную на твердой фазе клональную библиотеку одноцепочечных фрагментов ДНК. Важно, чтобы метод создания библиотеки позволял отделить каждую колонию ДНК от других так, чтобы выравнивание рН в случае его изменения в районе колонии происходило не слишком быстро. При использовании эмульсионной ПЦР это обеспечивается закатыванием микросфер в соответствующие им по размерам микрореакторы так, что в реактор помещается только одна частица, а
сообщаются реакторы только одной поверхностью на проточном чипе.
Секвенирование начинают с отжига праймера, комплементарного адаптеру на одном из концов библиотеки ДНК. Затем к микрореаторам, содержащим микросферы, по очереди добавляют обычные dNTP. Если добавленный нуклеотид оказывается комплементарным матрице, ДНК-полимераза встраивает его в синтезируемую цепь. Реакция образования фосфодиэфирной связи приводит к выделению пирофосфата и протона, вызывающего локальное изменение рН раствора в микрореакторе, которое детектируется подключенным к каждому микрореактору сенсором. Если нуклеотид не подходит, сигнал отсутствует. После каждого добавленного в реакцию нуклеотида, прибор выполняет промывку системы буфером для очистки от остатков невключившихся dNTP данного типа (Рис. 28).
Рис. 28 Полупроводниковое секвенирование
Как и в случае пиросеквенирования, у полопроводникового секвенирования есть трудности с детекцией гомополимерных участков. В
случае протяженного мононуклеотида, например ТТТТТТТТ, сигнал теряет дискретность и определить, сколько именно нуклеотидов присутствует в последовательности становится затруднительно.
Важным отличием полупроводникового секвенирования от других методов является отсутствие оптического детектора сигнала, что значительно упрощает и удешевляет конструкцию прибора. Кроме того, отсутствие необходимости оптической детекции снимает ограничение по количеству микроцентров секвенирования, которые можно разместить на чипе.
На принципе полупроводникового секвенирования основана коммерческая технология IonTorrent, предоставляемая компанией Life Technologies Thermo Fisher Scientific. Разработки в данном направлении ведутся также компанией Roche.
2.9 Нанопоровое секвенирование
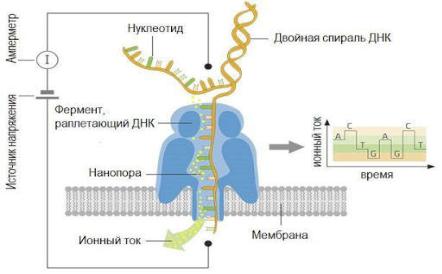
 Еще одна оригинальная идея секвенирования была предложена Касьяновичем в 1996 г. Принцип метода заключается в регистрации изменений ионного тока, вызванного прохождением одноцепочечной ДНК через нанопору в тонкой пленке под действием электрического поля (Рис. 29).
Еще одна оригинальная идея секвенирования была предложена Касьяновичем в 1996 г. Принцип метода заключается в регистрации изменений ионного тока, вызванного прохождением одноцепочечной ДНК через нанопору в тонкой пленке под действием электрического поля (Рис. 29).
Рис. 29 Принцип нанопорового секвенирования.
Проходящая через пору молекула одноцепочечной ДНК или РНК меняет потенциал на
мембране.

Поры могут быть естественного биологического происхождения.
Например, можно использовать биологическую мембрану с какой-либо порой.
Также могут использоваться искусственные поры. Например, поры в виде сенсора для фиксации изменения какой-либо характеристики: туннельного тока, емкости, ионного тока или флуоресценции. При переходе через пору,
каждый тип азотистых оснований по-своему "закупоривает" пору и влияет на ток.
В настоящее время данная технология реализована компанией Oxford Nanopore (Великобритания) в устройствах MinION, GridION и PromethION (Рис. 30).
Рис. 30 Приборы для нанопорового секвенирования: секвенаторы MinION (А), GridION
(Б) и PromethION
В настоящее время, технологии Nanopore позволяют осуществлять:
- Прямое прочтение нуклеотидных последовательностей цепей ДНК и
РНК
-Длина прочтения ограничена только длиной фрагмента.
-Наблюдение за ходом секвенирования в реальном времени дает возможность остановки процесса в любой момент при достаточном накоплении данных, при очевидных ошибках пробоподготовки или других сбоях в работе;
интерпретацию сигналов (base calling) и анализ данных можно проводить непосредственно в процессе секвенирования. Технология обеспечивает простой алгоритм сборки, полученных буквенных последовательностей.
В секвенаторе MinION используется ячейка с 512 нанопоровыми каналами, каждый из которых предназначен для анализа отдельной молекулы нуклеиновой кислоты. В сумме прибор позволяет получить до 20 Гб
информации о последовательности ДНК. Длина прочтения, ограничена только длиной фрагмента нуклеиновой кислоты и составляет сотни тысяч нуклеотидов. GridION, в отличие от MinION, состоит из пяти проточных ячеек с нанопоровыми каналами, что позволяет проводить пять параллельных независимых экспериментов. Общий объём информации о последовательности ДНК, полученный с помощью секвенатора GridION, может быть до 100 Гб.
Методика характеризуется простой пробоподготовкой и возможностью анализировать последовательности любой длины. Секвенатор PromethION
пердназначен для высокопроизводительного секвенирования. Прибор включает
24 независимые ячейки, каждая из которых содержит 3000 каналов. При анализе можно задействовать любое количество этих ячеек, в каждой из которых будет проводиться отдельный эксперимент. Анализ результатов происходит с помощью встроенного процессора.
2.10 Секвенирование генома человека
 Создание автоматических секвенаторов настолько упростило и удешевило процесс определения последовательности ДНК, что позволило к середине 1980-х годов говорить о возможности определить полную последовательность генома человека, что вылилось в крупнейшее исследование под названием Human Genome Project (HGP) (Проект "Геном человека"). Целью проекта, кроме определения последовательности нуклеотидов, была также идентификация всех генов человека. Проект стартовал в 1990 г. и финишировал в 2001 г. публикацией в журнале Nature. Однако полный анализ полученных данных был завершен только в 2004 г. Стоит отметить, что в 1998 г.,
Создание автоматических секвенаторов настолько упростило и удешевило процесс определения последовательности ДНК, что позволило к середине 1980-х годов говорить о возможности определить полную последовательность генома человека, что вылилось в крупнейшее исследование под названием Human Genome Project (HGP) (Проект "Геном человека"). Целью проекта, кроме определения последовательности нуклеотидов, была также идентификация всех генов человека. Проект стартовал в 1990 г. и финишировал в 2001 г. публикацией в журнале Nature. Однако полный анализ полученных данных был завершен только в 2004 г. Стоит отметить, что в 1998 г.,
параллельно с мировым научным сообществом, секвенированием генома человека занялась компания Celera. Полная последовательность нуклеотидов генома человека (3х109 п.н.) была получена ее сотрудниками в течение 9
месяцев, т.е. в 20 раз быстрее, чем участниками консорциума HGP. Получение столь быстрых результатов, среди прочего, было связано с тем, что Celera
стартовала на автоматических секвенаторах последнего поколения, сильно выигрывавших по производительности. Кроме того, это позволило
сотрудникам Celera не прибегать к клонированию генома в искусственных бактериальных хромосомах (bacterial artificial chromosomes, BAC), а сразу применить "метод дробовика" для всего генома.
Основная сложность данной задачи состояла в том, что имевшиеся в то время в распоряжении исследователей секвенаторы ДНК позволяли секвенировать лишь несколько сотен нуклеотидов за одно прочтение. Решение данной проблемы состояло в том, чтобы разбить геном на фрагменты и секвенировать затем каждый фрагмент по отдельности. Однако, главная проблема состояла также в том, как соединить последовательности коротких фрагментов в правильном порядке, чтобы получить сначала последовательности отдельных хромосом, а потом и весь геном. Для решения этой задачи были применены две стратегии: шутган-секвенигование (shotgun)
или метод "дробовика" и секвенирование по принципу "клон за клоном" (clone- by-clone).
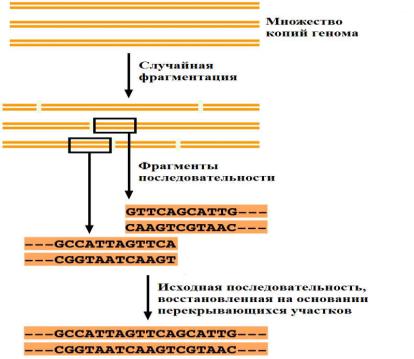
Метод "дробовика" состоял в том, чтобы разбить геном на небольшие фрагменты, определить их нуклеотидную последовательность, а затем при помощи мощного суперкомпьютера восстановить исходную последовательность на основании перекрывающихся участков (Рис. 31).
Рис. 31 Принцип секвенирования методом "дробовика"
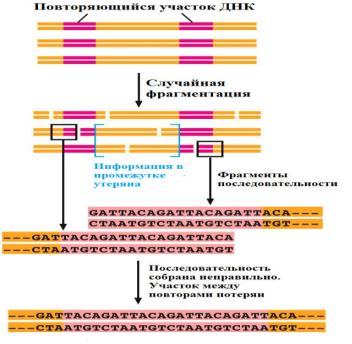
Однако, такой подход может быть успешно применён лишь для секвенирования относительно небольших геномов. Данный метод показал свою эффективность в 1995 г., когда был секвенирован геном бактерии Haemophilus influenzae, первого организма, последовательность генома которого была установлена. Недостатком метода является то, что сборка генома может быть сильно осложнена повторяющимися нуклеотидными последовательностями
(Рис. 32).
Рис. 32 Повторяющиеся участки затрудняют правильную сборку последовательности
У эукариот, в особенности у позвоночных, такие повторяющиеся последовательности составляют довольно большую часть генома.
Данную проблему удалось преодолеть путем совмещения метода
"дробовика" с подходом "клон за клоном". Вначале была создана геномная библиотека. Геном человека разбили на перекрывающиеся фрагменты длиной
100-200 тыс. п.н. Затем эти фрагменты лигировали в искусственные бактериальные хромосомы (bacterial artificial chromosomes, BAC), которые внедрили в клетки E. coli. BAC похожи на бактериальные плазмиды, но, в
отличие от них, они могут включать гораздо большие фрагменты ДНК.
Бактерии делились и копировали BAC, производя коллекцию перекрывающихся клонированных фрагментов.
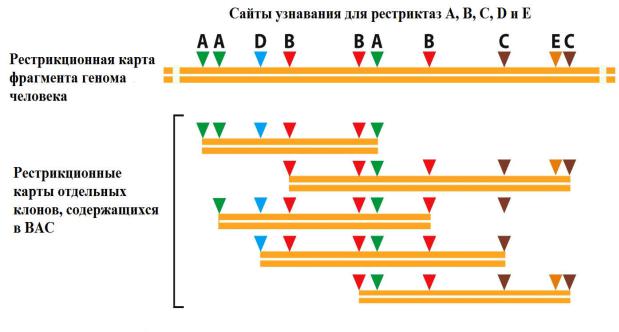
Затем было найдено местоположение каждого из этих фрагментов в геноме человека. Для этого была составлена рестрикционная карта каждого из клонов (Рис. 33).
Рис. 33 Расположение индивидуальных клонов фрагментов генома, содержащихся в BAC, на физической карте генома определяется при помощи их рестрикционных карт.
Знание расположения сайтов рестрикции в каждом из клонов позволило определить их местоположение на рестрикционной карте генома человека. Зная относительное расположение клонированных фрагментов, исследователи выбрали из них около 30 000, разрезали на небольшие фрагменты с помощью рестриктаз и секвенировали по методу "дробовика". После этого стало возможным собрать последовательность всего генома, соединяя между собой последовательности отдельных клонов, покрывающих всю длину генома.
3. Генная терапия
 Генная терапия, в широком смысле, означает лечение путем введения в ткани или клетки пациента смысловых последовательностей ДНК.
Генная терапия, в широком смысле, означает лечение путем введения в ткани или клетки пациента смысловых последовательностей ДНК.
Первоначально генная терапия рассматривалась как возможность исправления дефекта в гене с целью лечения моногенных наследственных заболеваний
(МНЗ). Предполагалось, что теоретически такая коррекция будет возможной как на соматическом уровне, так и на уровне половых клеток. Однако,
многочисленные исследования в данной области показали, что значительно
проще исправлять не сам дефект в гене, а вести коррекцию путем введения в
организм пациента полноценно работающего гена. Несмотря на значительные успехи генной инженерии, исследования по генной терапии у человека осуществляются исключительно на соматических клетках, в которых происходит экспрессия дефектного гена. Генная терапия на уровне половых и зародышевых клеток человека, ввиду возможных серьезных последствий для генофонда человечества, представляется на современном этапе весьма проблематичной и малореальной. Разработанная на сегодняшний день и применяемая на практике методология генной терапии оказалась пригодной для лечения не только МНЗ, но и онкозаболеваний, тяжелых вирусных инфекций, сердечно-сосудистых заболеваний и др. Поэтому, на современном этапе, генную терапию можно определить как лечение наследственных,
онкологических, некоторых вирусных и других заболеваний путем введения генов в клетки пациентов с целью направленного изменения генных дефектов либо придания клеткам новых функций. Первые клинические испытания методов генной терапии были предприняты 22 мая 1989 г. с целью генетического маркирования опухоль-инфильтрующих лимфоцитов в случае прогрессирующей меланомы прокариотическим геном neo. Первым МНЗ, в
отношении которого были применены методы генной терапии был наследственный иммунодифицит, обусловленный мутацией в гене аденозиндезаминазы (ADA). К другим МНЗ, в отношении которых уже имеются официально разрешенные протоколы и начаты клинические испытания,
относятся семейная гиперхолестеролемия, гемофилии А и В, муковисцидоз,
болезнь Гоше и некоторые другие.
3.1 Типы генотерапевтических вмешательств и выбор клеток-мишеней
 Генная терапия предполагает введение последовательностей ДНК в клетки-мишени. Она проводится либо с целью коррекции наследственной патологии, возникшей вследствие генетического дефекта, либо для придания этим клеткам новых функций, способствующих устранению патологических процессов. В первом случае в организм пациента вводят нормально
Генная терапия предполагает введение последовательностей ДНК в клетки-мишени. Она проводится либо с целью коррекции наследственной патологии, возникшей вследствие генетического дефекта, либо для придания этим клеткам новых функций, способствующих устранению патологических процессов. В первом случае в организм пациента вводят нормально
работающий гомолог дефектного гена. Второй подход применяют для лечения онкологических и инфекционных заболеваний. В этих случаях вводят гены,
обладающие условным цитотоксическим эффектом или способствующие формированию выраженного иммунного ответа. Мишенями для таких генов могут служить пораженные ткани, иммунные клетки, специфическим образом проникающие в эти ткани, либо предварительно трансформированные in vitro
другие клетки. В зависимости от способа введения экзогенных ДНК в геном пациента генная терапия может проводиться либо в культуре клеток (ex vivo),
либо непосредственно в организме (in vivo). Клеточная терапия (ex vivo)
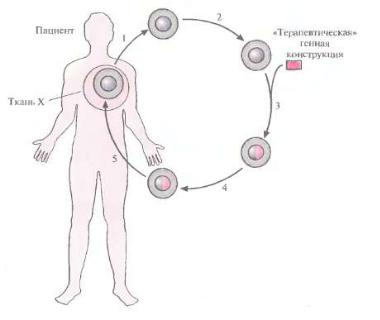
предполагает выделение и культивирование специфических типов клеток пациента, введение в них чужеродных генов, отбор трансфецированных клеток и реинфузию их тому же пациенту. В настоящее время, большинство допущенных к клиническим испытаниям программ генной терапии используют подход ex vivo. Генная терапия ex vivo включает следующие этапы (Рис. 34):
1)получение клеток от больного;
2)исправление генетического дефекта с помощью переноса нужного гена
визолированные клетки;
3)отбор и наращивание генетически "исправленных" клеток;
4)инфузия или трансплантация этих клеток пациенту;
Рис 34. Принцип генной терапии ex vivo
Использование собственных клеток пациента (аутологичных клеток)
гарантирует, что после инфузии или трансплантации у него не разовьется иммунный ответ.
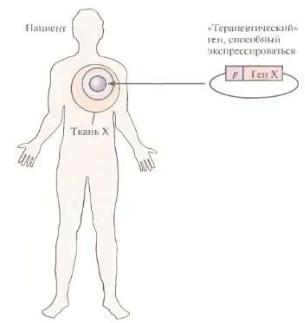
Генная терапия in vivo основана на прямом введении клонированных и определенным образом упакованных последовательностей ДНК в специфические ткани больного (Рис. 35). При этом вводимые ДНК, как правило, интегрируют с молекулами, обеспечивающими их адресную доставку в клетки-мишени. В настоящее время этот подход опробирован только для лечения муковисцидоза.
Рис. 35 Принцип генной терапии in vivo
Особенно перспективным для лечения генных болезней in vivo
представляется введение генов с помощью аэрозольных или инъецируемых вакцин. Аэрозольная генотерапия разрабатывается, как правило, для лечения пульмонологических заболеваний, таких как муковисцидоз, эмфизема, рак легких, при которых объектами генетической модификации являются специфические типы легочных клеток. Инъецируемые вакцины могут использоваться для модификации различных типов клеток и представляют собой наиболее универсальный способ доставки чужеродного генетического материала в любые ткани.
Разработке программы генной терапии предшествуют тщательный анализ тканеспецифической экспрессии соответствующего гена, идентификация
