
ИСПОЛЬЗОВАНИЕ ДНК-ТЕХНОЛОГИЙ В МЕДИЦИНЕ - МЕТОДЫ ПЦР И СЕКВЕНИРОВАНИЯ. ГЕННАЯ ТЕРАПИЯ
.pdf"ИСПОЛЬЗОВАНИЕ ДНК-ТЕХНОЛОГИЙ В МЕДИЦИНЕ: МЕТОДЫ ПЦР И СЕКВЕНИРОВАНИЯ. ГЕННАЯ ТЕРАПИЯ"
План:
1. Полимеразная цепная реакция (классическая ПЦР, ПЦР в реальном времени,
мостиковая ПЦР, эмульсионная ПЦР, цифровая капельная ПЦР)
2.Оборудование и материалы для ПЦР (Типы ПЦР-амплификаторов, Формат пробирок для проведения ПЦР, "Горячий старт")
3.Методы секвенирования нуклеиновых кислот (Максама-Гилберта, Сэнгера)
4.Методы высокопроизводительного секвенирования нового поколения (NGS) (Метод гибридизации на твердой фазе, MALDI-TOF-секвенирование,
секвенирование лигированием, пиросеквенирование, метод обратимых терминирующих нуклеотидов, полупроводниковое секвенирование,
нанопоровое секвенирование)
5. Секвенирование генома человека (метод "дробовика", метод "клон-за-
клоном")
6.Генная терапия
7.Типы генотерапевтических вмешательств и выбор клеток-мишеней
8.Методы генетической трансфекции в генной терапии
9.Коструирование векторных систем для трансфекции клеток человека
(Физико-химические методы переноса чужеродной ДНК в клетки эукариот,
липосомный метод трансфекции, рекомбинантные вирусы)
1. Полимеразная цепная реакция (ПЦР)
 Ранее, клонирование с использованием библиотек ДНК было единственным способом изолировать ген или исследуемый фрагмент ДНК.
Ранее, клонирование с использованием библиотек ДНК было единственным способом изолировать ген или исследуемый фрагмент ДНК.
Этот подход и в настоящее время сохраняет свою актуальность при полногеномном секвенировании, а также при работе с очень большими генами.
Гораздо более быструю и простую альтернативу для многих приложений клонирования, в особенности для тех организмов, чьи полные последовательности геномов секвенированы, предлагает метод полимеразной цепной реакции (ПЦР) (polymerase chainreaction, PCR), предложенный в 1983
г. сотрудником компании "Cetus" Кэри Муллисом, удостоенным за данное изобретение Нобелевской премии по химии. В настоящее время, метод ПЦР в той или иной его модификации является неотъемлемой частью любого молекулярно-биологического исследования. В медицине ПЦР применяют для диагностики инфекционных и наследственных заболеваний, при диагностике рака и иммунных патологий. В криминалистике и судебной медицине ПЦР используют для идентификации личности, определения биологического родства индивидов и анализе образцов биологического материала, собранного на месте преступления. Санитарно-эпидемиологические службы используют ПЦР для контроля за микробиологическим загрязнением окружающей среды и продуктов питания, а также для выявления генетически модифицированных продуктов (ГМО). В научно-исследовательских лабораториях, ПЦР используют для изучения нуклеиновых кислот и проведения манипуляций с ними.
Благодаря ПЦР стало возможным быстрое получение участков ДНК в чистом виде и достаточном количестве. На основе ПЦР были созданы современные технологии секвенирования нуклеиновых кислот (ДНК и РНК) Внедрение ПЦР
вмедицину открыло новое диагностическое направление - ДНК-диагностику.
Внастоящее время существует множество модификаций ПЦР: ПЦР в реальном времени, количественная ПЦР (quantitative, qPCR), мостиковая ПЦР
(bridge PCR, bPCR), эмульсионная (emulsion PCR, ePCR) и цифровая капельная ПЦР (digital drop PCR, ddPCR). несмотря на большое разнообразие отдельных подходов, в основе всех разновидностей метода ПЦР лежит общий принцип способности нуклеиновых кислот к самокопированию (репликации). Поэтому рассмотрение биологических основ и отличительных особенностей каждого из этих методов следует начать с рассмотрения принципа классической ПЦР.
1.1 Классическая ПЦР
 ПЦР может быть проведена целиком in vitro в бесклеточной среде.
ПЦР может быть проведена целиком in vitro в бесклеточной среде.
С помощью этого метода заданную нуклеотидную последовательность можно выборочно и быстро реплицировать в больших количествах из любого образца ДНК. ПЦР основана на использовании ДНК-полимеразы для копирования образца ДНК в повторяющихся циклах репликации. ДНК-полимеразу
направляют к необходимой последовательности короткие ДНК-праймеры
(затравки), представляющие собой короткие (18-24 нуклеотида) искусственно синтезированные ДНК-олигонуклеотиды, которые добавляют в реакционную смесь, где они гибридизуются с образцом ДНК в начале и в конце необходимой последовательности. Эти праймеры предоставляют 3ʹ-концы для ДНК-
полимеразы, с которых она начинает репликацию обеих цепей.
Последовательность самих праймеров необходимо подобрать таким образом,
чтобы они были комплементарны участкам ДНК, фланкирующим (т.е.
ограничивающим) необходимую последовательность. В настоящее время задача по "дизайну" праймеров может быть решена с помощью специальных компьютерных программ, предназначенных для анализа биологических последовательностей, таких как, например, Primer3, Primer Express и Vector NT.
В последнее время, бурное развитие биоинформатики предоставляет все больше возможностей для быстрого и автоматизированного анализа последовательностей генов любого организма, чей геном секвенирован и занесен в соответствующие биоинформационные базы данных, такие как
GenBank и NCBI. Синтез праймеров в настоящее время также полностью автоматизирован и осуществляется с помощью специальных приборов -
синтезаторов ДНК. В настоящее время задача по синтезу праймеров является рутинной и данная услуга предоставляется многими коммерческими компаниями, действующими на рынке биотехнологий: Синтол, Евроген, Invitrogen, Sigma Aldrich, Cell Signaling. Поскольку праймеры должны быть комплементарны к участкам ДНК, ограничивающим амплифицируемый фрагмент, ПЦР можно использовать только для амплификации последовательности, начало и конец которой известны. В ходе каждого цикла репликации две цепи двухцепочечной ДНК разделяются и копируются независимо.
Каждый цикл ПЦР включает три этапа (Рис. 1). Сначала двухцепочечную ДНК ненадолго нагревают до 90-96°С, чтобы отделить цепи друг от друга
(плавление ДНК). Температура плавления каждого образца ДНК индивидуальна и определяется соотношением G≡C и А=Т пар в первичной

структуре амплифицируемого фрагмента. Как известно, при образовании Уотсон-Криковских пар между азотистыми основаниями, между G и C
формируется три водородные связи, тогда как пара А=Т образована двумя водородными связями. Поэтому, чем выше содержание G≡C пар в первичной структуре нуклеиновой кислоты, тем выше ее температура плавления (Tm).
Приблизительную |
температуру |
плавления |
короткого |
фрагмента |
двухцепочечной ДНК можно рассчитать по уравнению: |
|
|||
|
|
|
, где |
|
|
в интервале 0<k<5. Обычно принимают k = 4. |
|
||
k - число, находящееся = 2( + |
) + 4( + ) + |
|
|
|
Рис. 1 Первый цикл ПЦР
После расхождения цепей ДНК охлаждают (примерно до 40-75°С) в
присутствии переизбытка праймеров, что позволяет им гибридизоваться с комплементарными последовательностями на цепях ДНК. Затем смесь инкубируется с ДНК-полимеразой и 4-мя видами dNTP, чтобы ДНК синтезировалась, начиная с двух праймеров. Затем цикл начинается заново с нагревания, чтобы отделить вновь синтезированные цепи ДНК друг от друга.
Поскольку процесс плавления ДНК требует использования высоких температур, данная методика требует использовать особые виды ДНК-
полимераз, способные выдерживать нагревание до 96°С. Большинство известных ДНК-полимераз, как и других ферментов, при нагревании до столь высоких температур подвергаются денатурации и теряют биологическую активность. Поэтому для проведения ПЦР используют специальные ДНК-
полимеразы, выделенные из термофильных бактерий, которые устойчивы к
действию гораздо более высоких температур, чем эукариотические ДНК-
полимеразы. Это снимает необходимость добавления новой порции фермента после каждого цикла ПЦР.
Долгое время для проведения ПЦР использовались отдельные термостабильные ДНК полимеразы: Taq, Tth, Pwo, Pfu и др. В настоящее время,
для различных целей, в ПЦР используют смеси полимераз с различными свойствами, включая искусственно полученные модификации природных ферментов. Большинство используемых в настоящее время ферментов получены на основе технологии рекомбинантных ДНК.
Taq-полимераза была выделена из термофильной эубактерии Thermus aquaticus. Фермент представляет собой одну полипептидную цепь с молекулярной массой 95 кДа. Данный фермент эффективно амплифицирует фрагменты длиной 3000-5000 п. н. и обладает хорошо выраженной 5ʹ-3ʹ-
экзонуклеазной активностью, но не проявляет корректирующей 3ʹ-5ʹ-
экзонуклеазной активности. Получаемые при использовании Taq-полимеразы фрагменты ДНК, как правило, содержат выступающий 3ʹ-концевой нуклеотид
(чаще всего А), который нематрично присоединяется ферментом. Это свойство
Taq-полимеразы используют для эффективного клонирования продуктов ПЦР в линеаризованные векторы с 3ʹ-выступающим Т.
Tth-полимераза была выделена из термофильной эубактерии Thermus thermophilus. Это также высокопроцессивный фермент, амплифицирующий до
3000 п. н., имеющий молекулярную массу порядка 94 кДа, обладающий хорошо выраженной 5ʹ-3ʹ-экзонуклеазной активностью, но не проявляющий корректирующей 3ʹ-5ʹ-экзонуклеазной активности. Особенностью этой полимеразы является наличие ревертазной активности. Данный фермент обычно используют для проведения обратной ПЦР с обратной транскрипцией
(RT-PCR).
Pwo-полимераза была выделена из гипертермофильной архебактерии
Pyrococcus woesei. Молекулярная масса фермента около 90 кДа. Это процессивный фермент, обеспечивающий амплификацию до 3000 п. н., не

проявляющий 5ʹ-3ʹ-экзонуклеазной активности, но обладающий выраженной 3ʹ- 5ʹ-экзонуклеазной активностью.
Pfu-полимераза получена из Pyrococcus furiosus. Молекулярная масса около 92 кДа. Pfu-полимераза характеризуется сравнительной процессивностью и эффективно амплифицирует фрагменты до 1000 п. н. Фермент обладает 3ʹ-5ʹ-
экзонуклеазной активностью, наличие которой делает его пригодным для тех вариантов ПЦР, в которых необходимо получение продукта с высокой точностью синтеза (например, для последующего секвенирования).
Рис. 2 Схема амплификации ДНК в течение трех циклов ПЦР
Помимо ДНК-матрицы, ДНК-полимеразы и праймеров, необходимыми компонентами реакционной смеси являются dNTP 4-х типов (dATP, dGTP, dCTP и dTTP), а также ионы Mg2+ (чаще всего в форме MgCl2).
После множества циклов амплификации образуется большое число,
обычно миллиарды копий исходной последовательности (Рис. 2).
В результате каждого цикла количество копий амплифицированного фрагмента увеличивается как 2n. При этом относительная концентрация целевых последовательностей многократно возрастает (показано желтым), в то время как доля нецелевых участков прогрессивно уменьшается.
ПЦР крайне чувствительна и может зарегистрировать присутствие единичной копии последовательности ДНК в образце, амплифицируя ее так,

что эту ДНК становится возможным увидеть с помощью, например,
окрашивания бромистым этидием (интеркалирующего агента, встраивающегося между цепями двойной спирали ДНК и вызывающего ее сверхспирализацию, в
результате чего образовавшийся комплекс приобретает способность флуоресцировать в УФ-свете) после разделения гель-электрофорезом.
Рис. 3 Получение геномных (А) и кДНК копий с помощью ПЦР
Существует несколько особенно важных областей применения ПЦР. На сегодняшний день, это основной метод клонирования относительно коротких фрагментов ДНК (менее 10 000 п. н.). Изначальной матрицей для реакции может служить как ДНК, так и РНК, что позволяет с помощью ПЦР получать как полногеномные копии, так и копии кДНК (Рис. 3). Удобство метода состоит
втом, что ген можно клонировать непосредственно с любого фрагмента ДНК или РНК без необходимости первоначального создания библиотек.
Другое применение ПЦР, связанное с ее особой чувствительностью, это поиск патогенов инфекционных заболеваний на ранних стадиях. В этом случае,
вкачестве праймеров используют короткие фрагменты ДНК, комплементарные какой-либо из уникальных последовательностей генома возбудителя. С

помощью большого числа циклов ПЦР можно проверить наличие или отсутствие даже единичных его копий в образце крови (Рис. 4).
Рис. 4 Использование метода ПЦР для диагностики инфекционных заболеваний.
ПЦР - самый чувствительный метод диагностики для многих инфекций.
В настоящее время он часто заменяет иммунологические методы диагностики,
такие как ИФА.
ПЦР широко применяется в судебной медицине и криминалистике.
Крайне высокая чувствительность этого метода позволяет работать с очень маленькими образцами, такими как волосяная луковица от волоса, мельчайшие следы крови или тканей, которые могут содержать фрагменты лишь одной клетки. Используя ДНК, выделенную из таких образцов, можно получать генетические "отпечатки пальцев" человека, от которого получен образец.
Геном каждого человека, за исключением монозиготных близнецов, отличается по последовательности ДНК от генома любого другого человека. ДНК,
амплифицированная с помощью ПЦР с использованием определенных праймеров будет различаться по последовательности у разных людей.
Используя набор праймеров, покрывающих известные высоковариабильные участки генома человека, можно с помощью ПЦР получить различающиеся генетические "отпечатки пальцев" для каждого человека. Обычно, в таком анализе используют так называемые короткие тандемные повторы (short tandem repeats, STRs), состоящие из таких последовательностей как САСАСА... или
GTGTGT..., и находящиеся в различных локусах в геноме человека. Число

повторов в каждом STR высоковариабильно в популяции, с разбросом от 4 до
40 у разных индивидов. Из-за разнообразия в этих последовательностях люди обычно наследуют разные варианты каждого STR от матери и от отца; два неродственных человека, как правило, несут разные пары последовательностей.
После ПЦР с использованием праймеров, ограничивающих локус, образуется пара полос амплифицированной ДНК от каждого человека, одна из которых представляет материнский вариант STR, а вторая - отцовский. Длина ПЦР-
продукта и, соответственно, положение полосы в геле после электрофореза будет зависеть от точного числа повторов в локусе (Рис. 5).
Рис. 5 ПЦР-анализ одного STR-локуса
На Рис. 6 представлен пример анализа трех STR-локусов у трех подозреваемых (А, Б и В), что приводит к образованию шести полос для каждого человека после электрофореза в полиакриламидном геле (ПААГ).
Несмотря на то, что у разных людей отдельные полосы могут совпадать, общая картина уникальна для каждого человека. Четвертая дорожка геля (Г) содержит продукты ПЦР проведенной с образцом ДНК, полученным из биологического материала, собранного на месте преступления. Чем больше локусов будет проанализировано, тем ниже будет вероятность ошибки из-за совпадения числа повторов в отдельных локусах. Если исследовать вариабельность 5-10 разных
STR-локусов, то вероятность того, что у двух случайных людей совпадут
"отпечатки пальцев" будет примерно 1 на 10 млн.
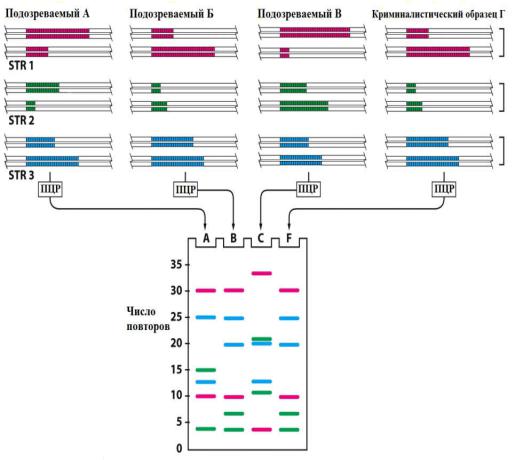
Рис. 6 Анализ трех STR-локусов методом ПЦР
В рассмотренном случае, индивиды А и В могут быть исключены из числа подозреваемых, а Б остается явным подозреваемым в совершении преступления. Аналогичный подход используется при определении отцовства.
1.2Оборудование и материалы для ПЦР
1.2.1Типы ПЦР-амплификаторов
 Приборы для проведения ПЦР (термоциклеры, ДНК-
Приборы для проведения ПЦР (термоциклеры, ДНК-
амплификаторы, ПЦР-амплификаторы) представляют собой устройства для быстрого изменения температуры реакционной смеси по определенной программе. Все современные амплификаторы можно разделить на модели с возможностью детекции накопления ДНК в процессе реакции (детектируюшие или real-time-амплификаторы) и без таковой (обычные амплификаторы).
Детектирующие амплификаторы, в сравнении с обычными амплификаторами,
оснащены дополнительной оптической насадкой, позволяющей регистрировать флуоресценцию в закрытой реакционной пробирке (через прозрачную крышку или стенки пробирки) непосредственно во время реакции (Рис. 7).
