
БИОХИМИЯ НЕРВНОЙ ТКАНИ
.pdfОсобенности обмена аминокислот и аммиака в нервной ткани (пуриновый цикл).
В большом количестве в нервной ткани присутствуют и свободные аминокислоты. Причем их содержание значительно выше, чем в крови и спинномозговой жидкости. Ткань мозга интенсивно обменивается аминокислотами с кровью. Для этого существуют специальные транспортные системы: две для незаряженных и еще несколько — для аминокислот, заряженных положительно и отрицательно.
Роль аминокислот в нервной ткани:
•участие в синтезе нейропептидов и белков,
•осуществление межнейрональных связей, в качестве нейромедиаторов
инейромодуляторов,
•энергетическое обеспечение нервных клеток и т.д.
До 75% от общего количества аминокислот нервной ткани составляют:
глутаминовя кислота
глутамин
аспарагиновая кислота
N-ацетиласпарагиновая кислота
Ƴ-аминомасляная кислота
Особое положение среди свободных аминокислот нервной ткани занимает глутаминовая кислота.
Глутаминовая кислота образуется в мозге из α-кетоглутаровой в процессе ее восстановительного аминирования в реакции, катализируемой глутаматдегидрогеназой.
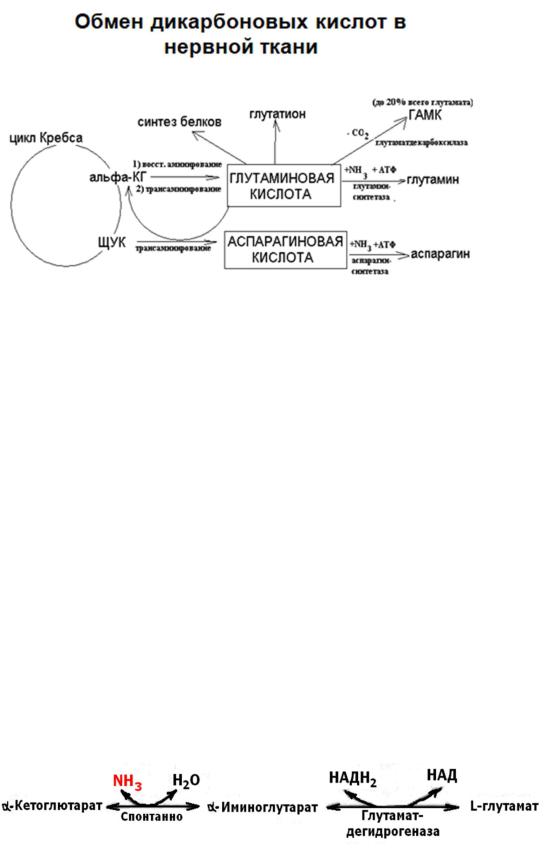
Функции глутаминовой кислоты в нервной ткани:
нейромедиатор
принимает участие в обезвреживании аммиака
синтезе тормозного медиатора ГАМК
глутатиона
энергетическая ( в процессе трансаминирования превращается в промежуточный продукт цикла трикарбоновых кислот α- кетоглутаровую кислоту).
Важное значение в реализации роли глутаминовой кислоты, как энергетического субстрата в нервных клетках играет ее окислительное дезаминирование в глутаматдегидрогеназной реакции.
Процесс окислительного дезаминирования глутаминовой кислоты сопровождается образованием аммиака – токсического конечного продукта азотистого обмена. Высокую чувствительность к нему проявляют именно
нервные клетки. Повышение концентрации аммиака уже до 0,6 мМ сопровождается поражением мозга.
Характерными проявлениями его поражения являются повышение внутричерепного давления, отек мозга и развитие коматозного состояния.
Одной из причин поражения мозга при увеличении в нем уровня аммиака, является стимуляция его использования для восстановительного аминирования α-кетоглутаровой кислоты с образованием амидов аминокислот в астроцитах. Следствием этого является уменьшение содержания в них глутаминовой кислоты и, наоборот – увеличение содержание глютамина в астроцитах. В результате возникновения подобных сдвигов в цитоплазме астроцитов резко повышается осмотическое давление. Это приводит к угнетению их функции. В результате нарушается трофика нейронов, а также развивается отек мозга и повышение внутричерепного давления.
Важный вклад в повреждение мозга при интоксикации аммиаком вносит уменьшение содержания в нем глутаминовой кислоты. Эта аминокислота сама выступает в роли нейромедиатора, а также используется в качестве предшественника синтеза γаминомасляной кислоты – медиатора тормозных синапсов ЦНС.
Понижение уровня этих нейромедиаторов предопределяет нарушение нейрофизиологических процессов в мозге.
Помимо этого, глутаминовая кислота играет важную роль в энергетическом обеспечении нервных клеток. Поэтому уменьшение ее содержания способствует понижению уровня энергетического обеспечения нейронов и, соответственно, торможению их специфический функций.
Вместе с тем, вовлечение глутаминовой кислоты в реакцию амидирования, катализируемую глутаминсинтетазой, играет ключевую роль в детоксикации аммиака в мозге:
Большая часть глутаминсинтетазы находится в глиальных клетках. Глутамин способен свободно проникать через клеточные мембраны. Поэтому
далее он транспортируется в печень, где амидная группа отщепляется в форме свободного аммиака в глутаминазной реакции. Освободившийся при этом аммиак далее подвергается детоксикации в цикле мочевины.
Образовавшийся в глиальных клетках глутамин далее может транспортироваться в нейроны. Здесь он в глутаминазной реакции дезаминируется в глутамат, который может использоваться в качестве энергетического субстрата или для синтеза ГАМК. Таким образом, в нервной ткани глутамин выступает в качестве транспортной формы глутаминовой кислоты.
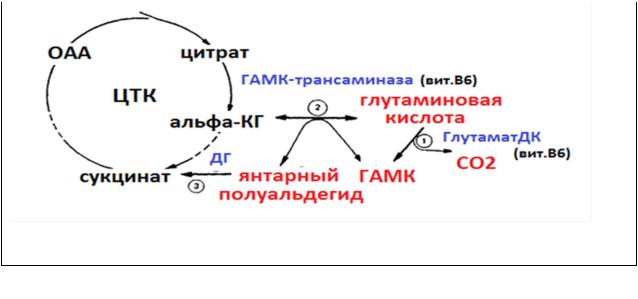
С метаболизмом глутаминовой кислоты в нервной ткани связано существование особого метаболического процесса – ГАМК-шунта.
α-кетоглутаровая кислота, которая образуется в качестве промежуточного продукта в цикле трикарбоновых кислот, может подвергаться трансаминированию с образованием глутаминовой кислоты Далее она подвергается декарбоксилированию с образованием медиатора – γ- аминомасляной кислоты (ГАМК). ГАМК окисляется в янтарный полуальдегид, который в дальнейшем используется для образования янтарной кислоты – одного из промежуточных продуктов цикла Кребса образования янтарной кислоты – одного из промежуточных продуктов цикла Кребса.
ГАМК-шунт

Скорость превращений ГАМК в шунте возрастает при экстремальных состояниях (гипоксии, психическом перенапряжении и др.).
Пуриновый цикл
Еще одним источником образования аммиака в нервной ткани является гидролитическое дезаминирование АМФ. Однако, он более активен в мышечной ткани. Роль пуринового цикла заключается в образовании и выведении аммиака из нервной ткани в составе глутамина, который проникает через ГЭБ и доставляет аммиак в печень для синтеза мочевины.
Особенности обмена липидов в нервной ткани.
Липидный состав головного мозга уникален не только по высокой концентрации общих липидов, но и по содержанию здесь их отдельных фракций.
Почти все липиды головного мозга представлены тремя главными фракциями:
глицерофосфолипидами
сфинголипидами
холестеролом, который всегда обнаруживается в свободном, а не
эстерифицированном состоянии, характерном для большинства других тканей.
практически не встречаются триацилглицеролы
характерен более широкий спектр жирных кислот чем для других тканей организма. Более того, их содержание в нервной ткани выше, чем в
других тканях.
протекает синтез жирных кислот с длинным радикалом (>20), которые нужны для синтеза миелина.
характерно сравнительно высокое содержание полиеновых длинноцепочечных жирных кислот (20:4; 22:5; 22:6 и др.). Важной особенностью жирнокислотного состава мозга является присутствие в нем большого количества их гидроксипроизводных. Последние могут входить в структуру цереброзидов и сульфатидов.
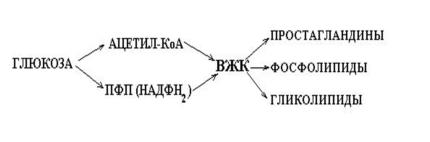
нет β-окисления, так ВЖК не проходят через ГЭБ,
жирные кислоты образуются из глюкозы в самой мозговой ткани.
жирные кислоты используются для синтеза:
БАВ (простагландинов и др.)
Фосфолипидов
Гликолипидов
Функции липидов нервной ткани:
структурная: входят в состав клеточных мембран нейронов;
диэлектрическая: обеспечивают надежную электрическую изоляцию;
защитная
регуляторная.

Миелиновые мембраны: особенности состава и функции.
Миелиновая оболочка представляет собой производное плазматической мембраны клеток нейроглии, которые многократно наслаиваются вокруг нервных отростков.
Функции:
•изоляция нервных волокон друг от друга
•ускорение проведения нервного импульса по перехватам Ранвье.
Вмиелиновой оболочке отношение: холестерин : фосфоглицериды : галактолипиды
4 : 3 : 2.
В отличие от цитоплазматической в миелиновой мембране три слоя белков.
Нарушения миелинизации нейронов
Рассеянный склероз - хроническое аутоиммунное заболевание, при котором поражается миелиновая оболочка нервных волокон головного и спинного мозга. В результате этого разные системы организма перестают получать сигналы из головного мозга, и возникают симптомы болезни (способность ясно мыслить сохраняется).
Токсическое нарушение созревание миелиновых оболочек
фенилпируватом при фенилкетонурии.
Токсическая демиелинизация (дифтерийный токсин, свинец,
хлороорганические соединения, в т.ч., гексахлорофен)
Вирусные инфекции и нейропатии
Дефицит витамина В12
Этот витамин в форме 5'-дезоксиаденозилкобаламина выступает в роли кофермента метилмалонил-КоАкатализирует реакцию превращения метилмалонил-КоА в сукцинил-КоА.
Характерным проявлением недостаточности витамина В12 служит появление неврологической симптоматики. Причиной ее возникновения

служит нарушение миелинизации нервных волокон. В основе нарушения процесса миелинизации лежит накопление в нервных клетках метилмалонилКоА. Этот метаболит тормозит синтез высших жирных кислот, необходимых для образования миелиновой оболочки нервных проводников. Включение в синтез жирных кислот метилмалонил-КоА приводит к образованию разветвленных жирных кислот, следствием чего становится нарушение структуры миелина.
Биохимия возникновения и проведения нервного импульса
Перенос электрического импульса между нервными клетками происходит через нервные окончания – синапсы.
В ЦНС встречаются разные типы синапсов. Однако все они построены по одному принципу.
В структуру синапса входят пре- и постсинаптические мембраны, а между ними находится синаптическая щель
В пресинаптическом нервном окончании содержатся специальные мембранные пузырьки, содержащие нейромедиаторы.
Возникновение нервного импульса связано с состоянием мембраны нейрона. Биологические мембраны, будучи липидно-белковым комплексом непроницаемы для заряженных ионов.
Перемещение ионов через мембрану осуществляется с помощью специальных транспортных систем:
натриевогонасоса, работающего с затратой энергии (Na+/ К+- АТФ-аза)
ионпроводящих каналов – натриевых и калиевых.
Всостоянии физиологического покоя по разные стороны мембраны имеет место разность концентраций ионов, главным образом Na+
иК+.
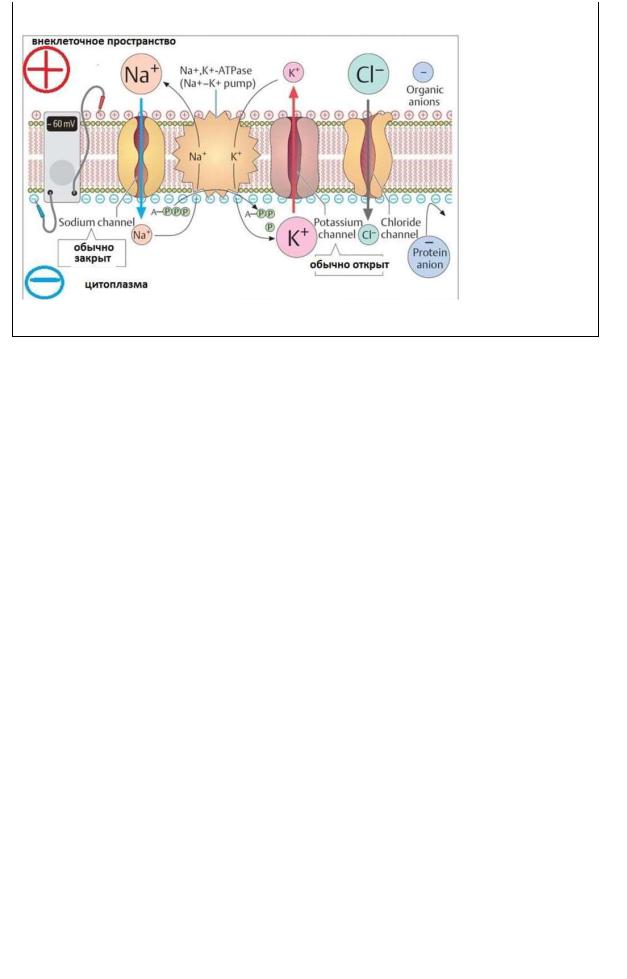
Концентрация ионов К+ выше в клетке, ионов
Na+ – в
межклеточной жидкости. Это влияет и на распределение других ионов.
Разность концентраций ионов поддерживается с помощью натриевого насоса, перекачивающего ионы против градиента концентрации (в противном случае диффузия ионов по градиенту концентрации привела бы к выравниванию концентраций ионов по обе стороны мембраны и гибели клетки). Таким образом, внутри аксона образуется избыток (–) зарядов, снаружи – (+) зарядов, то есть возникает разность электрических потенциалов – потенциал покоя (ПП).
Потенциал действия – это быстрое изменение мембранного потенциала, которые возникают в месте нанесения раздражения и распространяются на всю мембрану клетки.
В основе возбуждения лежит изменение проницаемости мембраны для натрия и калия, связанное с активацией потенциалзависимых натриевых и калиевых каналов.
При действии на клетку раздражителя проницаемость мембраны для ионов Na+ резко повышается за счет активации (открывания) натриевых каналов. При этом ионы Na+ по концентрационному градиенту интенсивно перемещаются из вне - во внутриклеточное пространство. Вхождению ионов Na+ в клетку способствует и электростатический градиент. В итоге проницаемость мембраны для Na+ становится в 20 раз больше проницаемости для ионов К+.

Поскольку поток Na+ в клетку начинает превышать калиевый ток из клетки, то происходит постепенное снижение потенциала покоя, приводящее к реверсии - изменению знака мембранного потенциала. При этом внутренняя поверхность мембраны становится положительной по отношению к ее внешней поверхности.
Синаптическая передача
Медиатор высвобождается в синаптическую щель в результате прихода ПД в окончание аксонна.
ПД деполяризует мембрану аксонного окончания, в результате чего на ней открываются Ca2+ специфические каналы.
Ионы Ca2+ по градиенту концентрации поступают в аксонное окончание,
Вход ионов Ca2+ запускает процесс высвобождения медиатора в синаптическую щель.
Характеристика основных нейромедиаторов
