
БИОХИМИЯ СОЕДИНИТЕЛЬНОЙ И КОСТНОЙ ТКАНИ
.pdfгазовой гангрены) выделяет коллагеназу, расщепляющую пептидную цепь коллагена более чем в 200 местах. Таким образом, разрушаются соединительнотканные барьеры в организме человека, что обеспечивает инвазию этого микроорганизма и способствует развитию газовой гангрены. Сам возбудитель не содержит коллагена и поэтому не подвержен действию коллагеназы.
Основным маркером распада коллагена (т.е. важнейшим метаболитом, характеризующим скорость распада коллагена) является гидроксипролин – аминокислота, синтезируемая путем посттрансляционного гидроксилирования пролиновых остатков в составе коллагена.В результате распада коллагена в крови и моче появляется свободный гидроксипролин. Большая часть этой аминокислоты катаболизируется под действием фермента гидроксипролиноксидазы, а часть ее выводится с мочой. При некоторых заболеваниях, связанных с поражением соединительной ткани, экскреция гидроксипролина увеличивается, вследствие ускоренного распада коллагена. Это наблюдается при коллагенозах, гиперпаратиреозе, при тяжелых формах пародонтита, некоторых инфекционных заболеваниях и недостаточном синтезе фермента катаболизма гидроксипролина - гидроксипролиноксидазы.
Характерным показателем распада коллагена является также повышение количества продуктов деградации коллагена I типа - N- и С- пептидов.
Применение коллагеназ в медицине: коллагеназа в медицинской практике используется для лечения ожоговой болезни в хирургии и для лечения гнойных заболеваний глаз в офтальмологии.
Регуляция обмена коллагена
1)По принципу отрицательной обратной связи сам коллаген и N
–пропептиды после своего отщепления тормозят трансляцию коллагена.
2)Гормональная регуляция.
Глюкокортикоиды тормозят синтез коллагена, во-первых, путем снижения уровня м-РНК проколлагена, а во-вторых - ингибированием активности ферментов пролил- и лизиогидроксилазы. Недостаточное гидроксилирование остатков пролина и лизина повышает чувствительность коллагена к действию коллагеназы и неспецифических протеаз.
Синтез коллагена зависит также от активности половых гормонов, снижение уровня которых приводит к остеопорозу и уменьшению
содержания коллагена, так у женщин в менопаузе снижается содержание коллагена в коже.
Минералокортикоидные гормоны (альдостерон, дезоксикортикостерон) надпочечников, напротив, стимулируют пролиферацию фибробластов и одновременно усиливают биосинтез «основного вещества» соединительной ткани.
Причины нарушений структуры коллагена и эластина.
1)Недостаток в организме аскорбиновой кислоты. Аскорбиновая кислота стимулирует синтез коллагена и протеогликанов, а также пролиферацию фибробластов. При цинге страдает гидроксилирование пролина и лизина в структуре проколлагена. В результате образуются хрупкие и ломкие сосуды. Нарушение синтеза коллагена в пульпе и дентине приводит к развитию множественного кариеса, страдают периодонтальные связки.
2)Недостаток в организме ионов Cu2+ и пиридоксина, в результате чего происходит снижение активности лизилоксидазы.
3)Генетические дефекты ферментов
4)Аутоиммунные заболевания.
Нарушения обмена коллагеновых белков у человека.
У молодых людей обмен коллагена протекает интенсивно, с возрастом (и особенно в старости) заметно снижается. Поэтому, если у молодых людей в возрасте 10-20 лет содержание гидроксипролина в моче может достигнуть 200 мг/сутки, то с возрастом экскреция гидроксипролина снижается до 15-20 мг/сутки.
Возрастные изменения соединительной ткани:
1.уменьшение содержания воды и отношения основное вещество/волокна;
2.снижения концентрации гликозаминогликанов (в первую очередь значительно снижается содержание гиалуроновой кислоты);
3.изменение физико-химических свойств коллагена (увеличение числа и прочности внутри- и межмолекулярных поперечных связей, снижение эластичности и способности к набуханию);
4.развитие резистентности к коллагеназе и повышение структурной стабильности коллагеновых волокон (увеличение количества поперечных сшивок затрудняет доступность коллагена для действия коллагеназы).
При заживлении ран синтез коллагена повышается. Фибробласты мигрируют в заживающую рану и начинают активно синтезировать в этой области основные компоненты межклеточного матрикса. Результат
этих процессов – образование на месте раны соединительнотканного рубца, содержащего большое количество хаотично расположенных фибрилл коллагена. Сходным образом происходит замещение погибающих клеток соединительной тканью в печени при циррозе, в стенках артерий при атеросклерозе, при мышечных дистрофиях.
Нарушения синтеза и распада коллагена могут приводить к фиброзу органов и тканей, развитию патологий, связанных с повышенной ломкостью и деформацией костей, гиперподвижностью суставов, изменением со стороны зубочелюстной системы в виде кровоточивости десен, подвижности и выпадения зубов, множественного кариеса.
Коллагеновые болезни (синонимы: коллагенозы, диффузные болезни соединительной ткани) — группа заболеваний, при которых отмечается диффузное поражение соединительной ткани и сосудов аутоиммунного характера. Дезорганизация соединительной ткани касается всех её компонентов (волокнистые структуры, межуточное аморфное вещество, клетки, сосуды микроциркуляции, нервные волокна) со вторичным вовлечением в процесс паренхимы органов. Возможно повреждение соединительной ткани суставов (ревматоидный артрит), капилляров (красная волчанка), кожи (склеродермия), мышц (миозит) и кровеносных сосудов (полиартериит). Нарушение метаболизма коллагена свойственно всем болезням этой группы. Наиболее ярко эта патология проявляется при системной склеродермии и ревматоидном артрите, при которых отмечается повышенная скорость биосинтеза коллагена, формирование менее устойчивых коллагеновых структур и как следствие их повышенный распад.
Нарушение процесса гидроксилирования коллагена – один из биохимических дефектов при цинге. Такой коллаген не может образовать нормальные по структуре волокна, в результате соединительная ткань, присутствующая в любом органе, в том числе и в оболочке кровеносных сосудов, теряет свою прочность, становиться рыхлой и подвергается пропитыванию плазмой и форменными элементами крови. Характерная клиническая картина цинги: разрыхление и кровоточивость десен, вплоть до полного выпадения зубов, и множественные кровоизлияния на теле. Смерть наступает от кровоизлияния в жизненно важные органы.
Эластин.
Это – основной белок эластических волокон, которые в больших количествах содержатся в межклеточном веществе таких тканей, как
кожа, стенки кровеносных сосудов, связки, легкие. По химической природе – гликопротеин.
Свойства:
растягивается в несколько раз по сравнению с исходной длиной;
сохраняет высокую прочность на разрыв;
возвращается в первоначальное состояние после снятия нагрузки.
Эластин содержит в своем составе около 800 аминокислот, среди которых преобладают аминокислоты с неполярными радикалами, такие как глицин, валин, аланин. Эластин содержит много пролина и лизина, но лишь немного гидроксипролина, полностью отсутствует гидроксилизин.
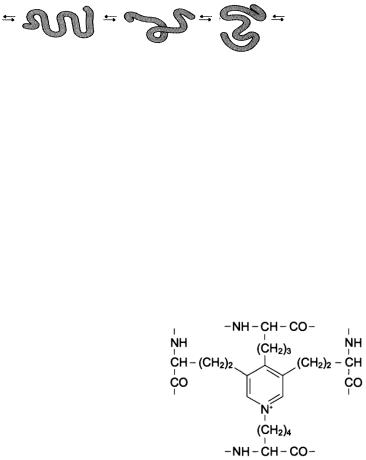
Наличие большого количества гидрофобных радикалов препятствует созданию стабильной глобулы, в результате полипептидные цепи эластина не формируют регулярные вторичную и третичную структуры, а принимают в межклеточном матрикса разные случайные конформации.
Рис.11. Случайные конформации молекулы эластина.
Общим для эластина и коллагена является большое содержание глицина и пролина, наличие оксипролина, хотя последнего в эластине примерно в 10 раз меньше, чем в коллагене. Как и в коллагене, в эластине мало метионина и отсутствуют триптафан и цистеин.
В отличие от коллагена в эластине значительно больше валина и аланина и меньше глутаминовой кислоты и аргинина.В межклеточном пространстве молекулы эластина образуют волокна и слои, в которых полипептидные цепи связаны множеством жестких поперечных сшивок в разветвленную сеть: четыре остатка лизина, соединяясь своими радикалами, образуют замещенное пиридиновое кольцо.
Рис.12. Структура десмозина
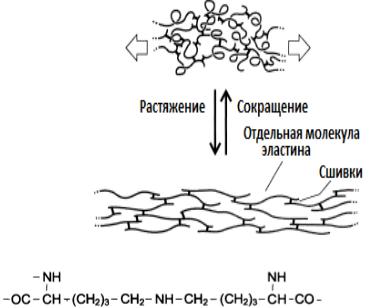
Структуры образующиеся при этом, называются десмозинами (десмозин и изодесмозин). Эти соединения содержатся только в эластине.
Кроме десмозина , в образовании поперечных сшивок может участвовать лизиннорлейцин, который образуется двумя остатками лизина.
Рис.13. Сетчатая структура десмозина
Рис.14. Лизин норлейцин
Наличие ковалентных сшивок между пептидными цепочками с неупорядоченной, случайной конформацией позволяет всей сети волокон эластина растягиваться и сжиматься в разных направлениях, придавая соответствующим тканям свойство эластичности.
Синтез эластина
Синтез эластина начинается в фибробластах с образования растворимого предшественника эластина «тропоэластина», гидрофильные участки которого обогащены остатками лизина. В межклеточном матриксе при участии Cu2+-зависимой лизилоксидазы остатки лизина окисляются до аллизина, которые формируют поперечные сшивки, стабилизируя молекулу эластина. После образования поперечных сшивок эластин приобретает свою конечную внеклеточную форму, для которой характерна нерастворимость, высокая стабильность и низкая скорость метаболизма.
Сравнительная характеристика коллагена и эластина
|
Коллаген |
|
|
|
|
Эластин |
|
|
|
|
|
|
|
|
|
|
Несколько |
разных |
|
|
|
Один |
|
генетических типов |
|
|
|
генетический тип |
|||
|
Тройная спираль |
|
|
|
Не |
образует |
|
|
(Гли-X-Y)n |
повторы |
в |
|
тройной спирали |
||
структуре |
|
|
|
|
Нет |
повторов |
|
|
Имеется гидроксипролин |
|
|
(Гли-X-Y) |
|
||
|
Содержит углеводы |
|
|
|
Нет |
|
|
|
Внутримолекулярные |
|
|
гидроксипролина |
|||
альдольные поперечные связи |
|
|
|
Нет углеводов |
|||
Во время синтеза образуются |
|
|
Поперечные связи |
||||
дополнительные пептиды |
|
|
в форме десмозина |
||||
|
Расщепляетсяколлагеназой |
|
|
|
Дополнительных |
||
|
|
|
|
|
пептидов не образуется |
||
|
|
|
|
|
|
Расщепляется |
|
|
|
|
|
|
эластазой |
|
|
|
|
|
|
|
|
||
|
Катаболизм эластина |
|
|
|
|||
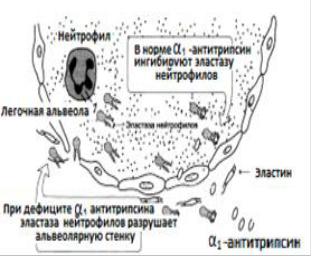
Время полужизни эластина в тканях человека около 75 лет.Таким образом, за всю жизнь эластин обновляется только наполовину.
Рис.14. Разрушение легочных альвеол эластазой нейтрофилов
Катаболизм |
|
эластина |
|
происходит |
при |
участии |
|
эластазы нейтрофилов. |
При |
||
снижении |
образования |
||
десмозинов |
(или |
их |
|
отсутствии) |
|
поперечные |
|
сшивки |
образуются |
в |
|
недостаточном количестве или не образуются вообще. Вследствие этого у эластических тканей снижается предел прочности на разрыв и появляются такие
нарушения, |
как |
истонченность, |
вялость, |
растяжимость, |
т.е |
утрачиваются |
их |
резиноподобные свойства.
Клинически такие нарушения могут проявляться кардиоваскулярными изменениями (аневризмы и разрывы аорты, дефекты клапанов сердца), частыми пневмониями и эмфиземой легких.
Неколлагеновые специализированные белки межклеточного матрикса.
Внеклеточный матрикс содержит большое число белков, которые можно разделить на две группы:
1)Адгезивные - обладают способность склеивать компоненты межклеточного матрикса. Их структурной особенностью является наличие доменов, способных специфически связываться с другими макромолекулами и рецепторами на поверхности клетки. Непременным компонентом доменов, обеспечивающих взаимодействие с клетками, является последовательность аминокислот арг-гли-асп. Основные представители:
фибронектин, ламинин, нидоген, интегрин, винкулин, таллин, α актинин.
2)Неадгезивные - подавляют адгезию клеток и внеклеточных компонентов, способны менять форму клеток и частично откреплять их от компонентов внеклеточного матрикса неколлагеновых белков. Основные представители: тенасцин, тромбоспондин.
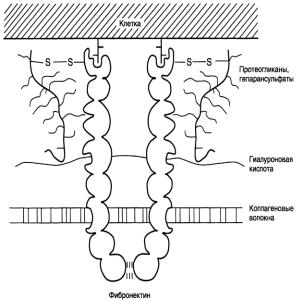
Фибронектин |
|
|
|
|
|
|
|
Фибронектин |
|
|
– |
один |
из |
|
ключевых |
|
|
|
белков |
|
|
межклеточного |
|
|
матрикса, |
||
|
неколлагеновый |
структурный |
||||
|
гликопротеин, |
|
синтезируемый |
|||
|
и выделяемый в межклеточное |
|||||
|
пространство |
|
|
|
многими |
|
|
клетками. Он построен из двух |
|||||
|
инден тичных |
полипептидных |
||||
|
цепей, |
|
|
соединенных |
||
|
дисульфидными |
мостиками |
у |
|||
|
своих |
|
|
|
С-концов. |
|
|
Полипептидная цепь |
фибронек |
||||
Рис. 15. Строение фибронектина |
тина содержит 7-8 доменов, на |
|||||
|
||||||
|
каждом |
из |
|
которых |
||
расположены в специфические центры
связывния разных веществ Фибронектин может связывать коллаген, протеогликаны, гиалуроновую кислоту, углеводы плазматических мембран, гепарин,фермент трансглутаминазу. Трансглутаминаза катализирует реакцию соединения остатков глутамина одной полипептидной цепи с остатками лизина другой белковой молекулы. Это позволяет сшивать поперечными ковалентными связями молекулы фибронектина друг с
другом, коллагеном и другими протеинами.
Функции фибронектина:
1)интегрирующая роль в организации межклеточного вещества;
2)способствует адгезии клеток;
3)поддержание цитоскелета клеток;
4)контролирует дифференцировку клеток;
5)учвствовует в воспалительных и репаративных процессах.
6)стимулирует пролиферацию и миграцию эмбриональных и опухолевых клеток
|
Ламинин |
- |
наиболее |
|
распростра |
|
ненный |
|
неколлагеновый гликопротеин |
||
|
базальных мембран. Состоит |
||
из |
трех полипептидных цепей А, |
||
В1 и |
В2. |
|
|
|
Молекула |
ламинина имеет |
|
|
крестообразую форму с тремя |
||
|
одноцепочечными |
ветвями и |
|
|
одной трехцепочечной ветвью. |
||
Рис.17. Схема взаимодействия фибронектина с интегрином.
Каждая цепь ламинина содержит несколько глобулярных и стержневых доменов, которые имеют специфические центры связывния для различных веществ.

Основная роль ламининаспособность связывать клетки и модулировать клеточное поведение, выполняет роль адгезивного белка для различных эпителиальных и мезенхимальных клеток.
Рис. 18. Строение комплекса ламининнидоген
Нидоген – сульфатированный гликопротеин базальных мембран,. образует с ламинином плотный нековалентно связанный комплекс. Этот белок представлен одной цепью, содержащей три глобулярных домена.Один из доменов нидогена имеет центр связывания ламинина, в области другого домена находится центрсвязывания с коллагеном IV типа.Таким образом, нидоген может выступать в качестве одного из связующих мостов между различными компонентами межклеточного матрикса и участвовать в образовании тройных комплексов ламинин- нидоген-коллаген.
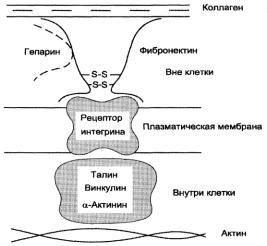
Интегрины – это трансмембранные белки, представляют собой α- и β димеры. Каждая цепь пересекает мембрану только один раз. Семейство интегринов включает20 видов рецепторов с разной специфичностью.Там, где клеточная мембрана тесно контактирует с компонентами межклеточного матрикса находятся скопления интегринов. Обе цепи интегринов имеют большие внеклеточные домены. Эти домены содержат центры связывания, комплементарные соответствующим лигандам. Так ламинин служит лигандом для 6 разных интегринов, коллагены - для 4, фибронектин – для 8. Внутриклеточные домены интегринов – короткие – 50 или меньше аминокислотных остатков (за исключением цепи β4 – 1000 остатков). Эти домены взаимодействуют с актиновыми белками цитоскелета, а также с регуляторными цитоплазматическими белками.
Основная роль. Интегрины не просто осуществляют физический контакт между внеклеточнми и внутриклеточными структурами, а обеспечивают трансмембранную передачу сигнала, т.е. они – подлинные
Рис.19. Строение интегринов |
рецепторы, по механизму действия |
|
близки к рецепторам гормонов. |
Антиадгезивные белки появляются и играют заметную роль в эмбриогенезе и морфогенезе, развитии клеточного ответа на повреждение. Их концентрация в матриксе повышается при некоторых опухолевых заболеваниях.
Остеонектин – кислый белок, богатый цистеином. состоит из 4 доменов, к двум из которых могут присоединяться ионы Са2+.Функция: обеспечивает взаимодействие компонентов межклеточного матрикса; ингибирует рост эндотелиальных клеток.
Тенасцин - (антиген мышечных сухожилий)- олигомерный гликопротеин, состоящий подобно фибронектину, из 2-х субъединиц, соединенных дисульфидной связью.
Рис.20. Пространственное строение тенасцина
Эту большую молекулу, похожую на осьминога, называют еще «гексабрахион», так как она имеет 6 «рук», отходящих радикально от одного участка. Благодаря такому строению, тенасцин может взаимодействовать с большим количеством лигандов, к которым относят различные молекулы межклеточного матрикса. Обладает адгезивными и антиадгезивными свойствами, которые опосредуют различные домены белка. Распространен в матриксе эмбриональных тканей. В зрелых тканях небольшие количества тенасцина находится в сухожилиях и хрящах. Его синтез увеличивается в заживающих ранах.
Тромбоспондин – гликопротеин, который проявляет свои антиадгезивные свойства в клетках эндотелия и фибробластов, ослабляет связывание матриксных молекул между собой. Тромбоспондин проявляет и адгезивные свойства при взаимодействии с молекулами интегринов, гликопротеинов, гепарансульфата и гликопротеинов. Глобулярные домены, солержащиеся в N-и С- концевых областях, способствуют связыванию кальция с гепарином, после чего тромбоспондин вступает во взаимодействие с коллагеном, фибронектином, фибриногеном , ламинином и плазминогеном.
Помимо адгезивных белков, участвующихв организации надмолекулярных комплексов межклеточного матрикса, в тканях присутствуют гликопротеины, относящиеся к факторам роста.
