
Программированная клеточная гибель - биологическое значение, классификация и сравнительная характеристика различных видов гибели клеток
.pdf
4.«Программированная клеточная гибель»: биологическое значение,
классификация и сравнительная характеристика различных видов гибели
клеток
Классификация видов клеточной гибели. Номенклатурный комитет по исследованию гибели клеток по совокупности морфологических и биохимических изменений выделил четыре типичных вида клеточной смерти - апоптоз, некроз,
аутофагию и корнификацию (ороговение), а также восемь атипичных видов
(митотическую катастрофу, анойкис, экзитотоксичность, валлеровское перерождение, параптоз, пироптоз, пиронекроз и энтоз).
Апоптоз - форма программируемой клеточной гибели. Процесс самоликвидации имеет ряд морфо-функциональных характеристик, приобретаемых клеткой за счет активации специфических метаболических путей и молекулярных маркеров апоптоза.
Характерно прекращение деятельности клетки, сокращение псевдоподий,
уменьшение объема клетки и ядра (пикноз), фрагментация ядра (кариорексис) и
хроматина. Уплотняются наружная и цитозольные мембраны, деполимеризуются микротрубочки цитоскелета, актиновые микрофиламенты связываются с мембраной,
сокращаются - формируются пузыревидные выпячивания (блеббинг). Затем -
фрагментация на окруженные мембраной апоптотические тельца без выхода содержимого клетки в окружающую среду. Тельца поглощаются соседними
клетками.
Физиологическая роль апоптоза:
1.Реализация морфогенеза в эмбриогенезе. Основное биологическое назначение апоптоза - в процессе эмбрионального морфогенеза создавать органы и ткани с эволюционно закрепленными конфигурациями и размерами, поддерживая эти параметры в течение жизни.
2.Контроль клеточного гомеостаза и дифференцировки в онтогенезе.
Мониторинг внутренней среды клетки, в т.ч. клеточного ядра с его содержимым;
обеспечение правильного соотношения численности клеток различных типов;
селекция разновидностей клеток внутри популяции; удаление генетически
дефектных клеток; участие в клеточной дифференцировке (эритропоэзе,
созревании Т-лимфоцитов в тимусе, кератинизации).
3.Участие в иммунных процессах. Реализация режимов толерантности,
цитотоксичности, клональной селекции, контроля численности популяции лимфоцитов.
4.Контроль физиологической регенерации (обновления) клеток разных тканей и органов и поддержании клеточного гомеостаза.
5.Реализация программ гормонзависимой инволюции. Отторжение эндометрия во время менструального цикла, атрезия фолликулов яичников, регрессия (обратное развитие) молочной железы после прекращения лактации).
6.Участие в процессах старения. При старении интенсивность процессов апоптоза нарастает. Генетический контроль над сменой интенсивности пролиферации,
дифференцировки и апоптоза на тканевом уровне, постепенная убыль функционально активных клеток – механизмы старения.
Некроз – развитие клеточного хаоса на фоне метаболической катастрофы,
вызванной тяжелыми внезапными повреждениями клетки. В развитии некроза выделяют несколько стадий: паранекроза (стадия обратимых изменений), некробиоза
(необратимых), аутолиза (лизиса, разрушения). В стадии паранекроза клетка временно теряет способность формировать гранулы прижизненных красителей,
повышается окрашиваемость цитоплазмы, ее вязкость и кислотность, снижается дисперсность ее коллоидов, деполяризуется наружная мембрана, нарушается клеточный метаболизм и функции. При некробиозе хроматин конденсируется в крупные глыбки,
ядро уменьшается в объеме, становится сморщенным, плотным, интенсивно базофильным - кариопикноз. Затем следует кариорексис (распад ядра на фрагменты) и
кариолизиз (полное разрушение остатков ядра).
В цитоплазме визуализируется набухание
митохондрий и деструкция мембран органелл, вакуолизация. Коагуляция белков сменяется их колликвацией, спустя 6 ч от момента развития некроза цитоплазма становиться гомогенной. Лизис клетки происходит в результате действия своих же протеолитических ферментов – аутолиз. Содержимое клетки поступает во внеклеточную среду, поглощается макрофагами и нейтрофилами, развивается
воспаление.
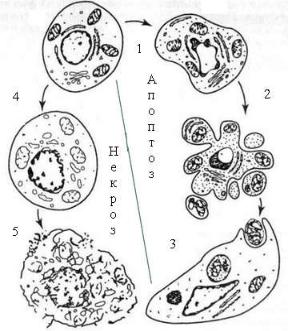
Некроз и апоптоз имеют ряд характерных особенностей. На схеме при апоптозе указаны: 1) начало фрагментации хроматина и ядра, 2) формирование апоптозных телец, 3) их фагоцитоз соседней клеткой. При развитии некроза: 4)
конденсация хроматина и деградация цитоплазматических структур, 5) мембраной.
Нет (или почти нет) поглощения фагоцитами. Пути реализации связаны с активностью многочисленных белков Atg-семейства (autophagosome-related proteins).
Индукторы аутофагии повреждённые органеллы, частично денатурировавшие белки и их агрегаты, дефицит питательных веществ при голодании, активные формы кислорода и свободные радикалы, токсины.
Выделяют 3 типа аутофагии: микроаутофагию, макроаутофагию и шаперон-
зависимую аутофагию. При первой макромолекулы и обломки клеточных мембран захватываются лизосомой. Таким путем клетка может переваривать белки при нехватке энергии или строительного материала (например, при голодании). Шаперон-
зависимый вариант аутофагии подобен, но характеризуется направленным транспортом через лизосомальную мембрану удаляемого белка после его комплексирования с шаперонами. Индуцируется стрессом, участвуют цитозольные белки-шапероны семейства hsc-70, вспомогательные белки и LAMP-2 (мембранный рецептор лизосомы для связывания комплекса шаперона и белка, подлежащего транспорту в лизосому). При макроаутофагии участок цитоплазмы (часто содержащий какие-либо органоиды) окружается мембранным компартментом,
похожим на цистерну эндоплазматической сети. Такие двухмембранные органеллы,
окружающие удаляемые органеллы и цитоплазму, называют аутофагосомами.
Аутофагосомы соединяются с лизосомами, образуя аутофаголизосомы, где
содержимое аутофагосом переваривается. Реализация одного из видов программируемой гибели контролируется самой клеткой на молекулярном уровне.
Корнификация – вид гибели кератиноцитов эпидермиса. Характерны изменения в мембране, аккумуляция липидов в F- и L-гранулах, затем выделение гранул липидов (церамидов, холестерина и др.) во внеклеточное пространство.
Липиды заполняют межклеточные промежутки рогового слоя, обеспечивая его барьерные свойства. Внутриклеточные органеллы разрушаются протеазами.
Происходит аккумуляция элафина, кератиновых промежуточных филаментов,
лорикрина, инволюкрина, богатых пролином белков. Между последними трансглутаминазы катализируют образование межмолекулярных изопептидных связей. Филагрин собирает кератиновые филаменты в плотные пучки, что способствует уплощению клетки, характерному для корнеоцита рогового слоя.
Ороговение способствует формированию барьерных функций (предотвращение потери воды, защита от микробных агентов, химических, механических воздействий).
Аноикис - форма гибели клетки, вызываемая утратой межклеточных контактов. Молекулярные механизмы гибели клеток подобны таковым при классическом апоптозе. В индукции участвуют гены семейства Bcl-2, jun-N, PARP, RAF и эпителиальный фактор роста (EGRF). Аноикис предназначен для поддержания определенного числа клеток в тканях эпителия. Его нарушения, устойчивость к аноикису может облегчать образование метастазов, поскольку позволяет клеткам выживать после открепления от матрикса.
Митотическая катастрофа - это тип клеточной гибели в результате грубых нарушений митоза, таких, как отставание хромосом в мета- и анафазе,
мультиполюсные и мультигрупповые мета- и анафазы. Ведущим морфологическим признаком этой формы гибели клетки считается образование одного или несколько микроядер, в которых отсутствуют явления конденсации хроматина, что отличает ее от апоптоза. Ключевую роль в развитии этого процесса играют гены chk1, chk2, atm, atr, p53, p21.
Валлеровская дегенерация - парциальный некроз нейрона, при котором часть
(аксон) дегенерирует без распространения на тело клетки. Это понятие не отражает
программируемую клеточную гибель в буквальном смысле, поскольку нейроны остаются живыми. Наблюдается в аксонах при травматическом разрыве нервов и спинного мозга.
Экзитотоксичность - гибель нейронов, подвергшихся действию
«возбуждающих» аминокислот (глутамата, аспартата), сопровождающаяся открытием
Ca2+ - каналов, активацией летальных сигнальных путей. Имеет общие черты с апоптозом, некрозом. Критическим событием является открытие митохондриальных
пор.
Параптоз в отличие от апоптоза не может быть остановлен введением ингибиторов каспаз или сверхэкспрессией проапоптотических белков bcl-2. Может быть вызван экспрессией рецепторов инсулин-подобного фактора роста I. Характерна интенсивная цитоплазматическая вакуолизация и набухание митохондрий, но без других морфологических признаков некроза.
Пироптоз преимущественно характерен для моноцитов и макрофагов, чаще сопровождает инфекционные процессы. Впервые был описан как особая смерть макрофагов, вызваннная Shigella typhimurium. Впоследствии было показано, что и другие бактериальные и вирусные инфекционные агенты, а также синтетические аналоги бактериального липопептида Pam3CSK4, натриевая соль мочевой кислоты, a-токсин Staphylococcus aureus могут индуцировать развитие пироптоза человеческих моноцитов. В развитии ключевую роль играет снижение концентрации К+ в клетке.
Другим ключевым фактором является активация каспазы-1, избыточная продукция цитокинов. Это ведет к перестройке цитоскелета, формированию выступов наружной мембраны, к фрагментации ДНК и порообразованию. Есть признаки и апоптоза, и
некроза. Финал - осмотический лизис клетки. Выход IL-1β (мощный провоспалительный цитокин и пироген), IL-18 и др. - важный этап в развитии воспаления.
Пиронекроз как и пироптоз развивается через NLR (Nod-like receptors) и ASC
рецепторы в макрофагах, инфицированных бактериями, при высоком соотношении бактерии/макрофаги. Однако не отмечено активации каспазы-1.
Энтоз - неапоптотический процесс клеточной гибели, при котором одна клетка интернализируется внутри другой клетки. При этом поглощенная клетка погибает в фагосоме, форма «клеточного каннибализма».
5. Апоптоз: трансмембранные и внутриклеточные стимулы, стадии, роль каспаз,
Ca2+ и Mg2+-зависимых эндонуклеаз, белка Р53 в развитии апоптоза клетки
Каспазы - протеазы, реализующие программы клеточной гибели. Это семейство цистеиновых аспартат-
специфичных протеаз, катализирующих гидролиз пептидных связей, образованных карбоксильными группами аспарагиновой кислоты, что и сформировало их название
(cysteinyl (С+) aspartate (asp +) proteases (ases)
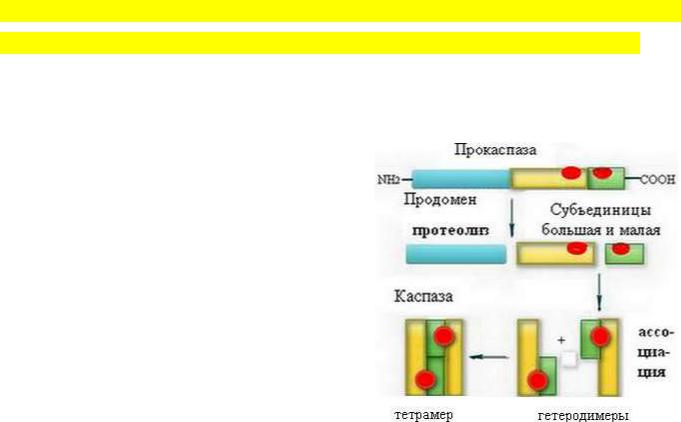
= Сaspases). В клетках находятся в виде зимогенов (проферментов) – прокаспаз.
Активация каспаз делает гибель клетки неизбежной. Это реализуется за счёт
частичного протеолиза прокаспаз (молекулярная масса 32-56 кДа), в составе которых выделяют 3 домена: регуляторный N-концевой домен (продомен), большую (17-21
кДа) и малую (10-13 кДа) субъединицы.

Активация происходит путём протеолитического процессинга: все три домена расщепляются, отделяется продомен, а оставшиеся большая и малая субъединицы ассоциируются в гетеродимер. Два гетеродимера в дальнейшем формируют полноценную каспазу с двумя каталитическими участками - тетрамер.
Каспазы делятся на инициаторные (А) и эффекторные (Б). Инициаторные
каспазы (8, 9, 10), принимая сигнал, активируются аутопротеолизом, а затем активируют эффекторные каспазы (3, 6, 7) –
основные исполнители апоптоза. Каспаза-2
обладает двойной функцией.
Непосредственное участие в реализации апоптоза принимают только 7 из 12 каспаз,
выявленных у человека. Эффекторные каспазы, расщепляя белки, принадлежащие самым различным семействам, выполняют
ряд функций, реализуя эффекторную фазу апоптоза. Одна из главных функций -
прямое и опосредованное разрушение клеточных структур. Гидролизу подвергаются ключевые структурные компоненты цитоскелета и ядра, белки, вовлеченные в филаментную организацию – их расщепление вызывает сморщивние и распад клетки.
Например, гидролиз ламинов, армирующих (укрепляющих) ядерную мембрану, ведет к конденсации хроматина. Также разрушаются белковые факторы транскрипции;
белки, участвующие в репликации и репарации ДНК. Другой важной функцией эффекторных каспаз является протеолиз ингибиторов апоптоза (например,
ингибитора фрагментации ДНК - DFF (англ. DNA fragmentation factor),
антиапоптозных белков семейства Bcl-2). На некоторые белки протеолиз каспазами,
наоборот, оказывает активирующее действие. Это белки, регулирующие ключевые морфологические изменения при апоптозе (например, белки, участвующие в деполяризации F-актина - запускают мембранный блеббинг, фактор фрагментации ДНК - CAD (англ. caspase-activated DNase - «ДНКаза, активируемая каспазами»).
Также на белки, преобразующие или усиливающие сигнал (например, участвующие в передаче сигнала, протеинкиназы). Итак, важной биохимической особенностью
апоптоза являются каспазные каскады, которые позволяют усиливать и передавать инициирующий сигнал в клетке.
Процесс апоптоза состоит из ряда последовательных событий, которые можно условно разделить на 3 фазы. Во время сигнальной фазы клетка воспринимает сигнал, инициирующий апоптоз. Затем активируются эффекторные внутриклеточные механизмы гибели (эффекторная фаза), что неизбежно приводит к деструктивной фазе (или фазе деградации), при которой отмечают расщепление ДНК и другие необратимые изменения биополимеров цитоплазмы и ядра клетки. События в клетке,
происходящие в деструктивную фазу визуализируются в виде характерных морфологических признаков апоптоза. Деградационная фаза - три последовательных шага: высвобождения (деполимеризуются микротрубочки цитоскелета, актиновые микрофиламенты реорганизуются в связанные с мембраной периферийные
(кортикальные) кольцевые пучки, клетка приобретает округлую форму); блеббинга
(сокращение периферийных актиновых колец, клетка как бы «кипит»); конденсации или фрагментации (клетка фрагментируется на маленькие апоптотические тела, либо целиком конденсируется, округляясь и уменьшаясь в размерах).
Инициация процесса осуществляется различными путями. Для большинства клеток сигнальная фаза реализуется либо при участии рецепторов клеточной поверхности («рецепторов смерти»), либо вследствие повреждений внутриклеточных структур (чаще всего митохондрий). Исходя из этого, выделяют рецепторный (внешний) и митохондриальный (внутренний) пути апоптоза.
В реализации сигнальной фазы внешнего пути ключевым моментом является связывание лиганда - сигнальной молекулы со своим клеточным рецептором.
Рецепторы, воспринимающие сигнал апоптоза, т.н. «рецепторы смерти», относятся к суперсемейству TNF-рецепторов (англ. tumor necrosis factor receptor или кратко TNF
R — «рецептор фактора некроза опухолей»). Известны два структурно гомологичных рецептора TNF-R1 (CD120a, р55) и TNF-R1 (р75), а также CD95 (известный как Fas
или Aро-1). Гомология аминокислотной последовательности среди рецепторов семейства TNF высока, можно выделить внеклеточный, трансмембранный и цитоплазматический домены. Это трансмембранные белки с наличием общей
последовательности из 80 аминокислот в цитоплазматическом домене. Данная последовательность называется доменом смерти (англ. death domain или кратко DD)
и является необходимой для трансдукции сигнала апоптоза. К дополнительным относятся рецепторы TRAILR, CARI, DR3 (англ. death receptor3 - «рецептор смерти
3» или Apo-3, Wsl 1), DR4 и DR5.
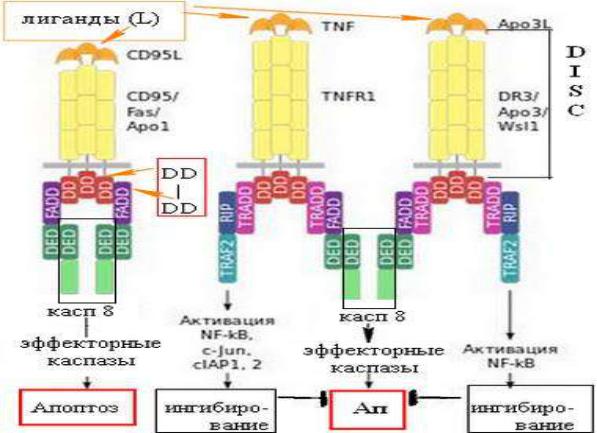
В сигнальной фазе внешнего пути в результате связывания «лигандов смерти» со своими специфическими рецепторами в клетке образуется особый белковый комплекс - DISC (death-inducing signaling complex), инициирующий развитие апоптоза.
Рис. Рецепторзависимый (внешний) сигнальный путь, формирование DISC
Особыми трансдукторами сигнала являются адапторные белки, имеющие как домен для связывания с лиганд-рецепторным комплексом, так и эффекторный домен для связывания с прокаспазами. Так адаптерный белок FADD связывается с активированными рецепторами в домене связывания (через DD-DD-взаимодействие).
При этом своим «эффекторным доменом смерти» (death effector domain - DED) он
участвует в связывании с неактивными прокаспазой-8 или -10 (через DED-DED-
взаимодействие). В результате образуются агрегаты, например, CD95L–CD95– FADD–прокаспаза-8, т.е. заканчивается сборка DISC, который в ассоциированном виде содержит лиганд-рецептор-адаптор-прокаспазу. Это апоптосома (апоптозный шаперон или «сигнальный комплекс, индуцирующий смерть». После того, как прокаспаза-8 (или прокаспаза-10) становится частью комплекса DISC, происходит ее олигомеризация с последующим аутопротеолизом, т.е. инициаторные прокаспазы активируются в апоптосомах. Затем сигнальная фаза внешнего пути переходит в
эффекторную фазу с активацией эффекторных прокаспаз-3 и -7.
Рис. 10. Особенности сигнальных фаз внутреннего и внешнего путей.
Примечание: стрелки – активация, «плашки» - подавление
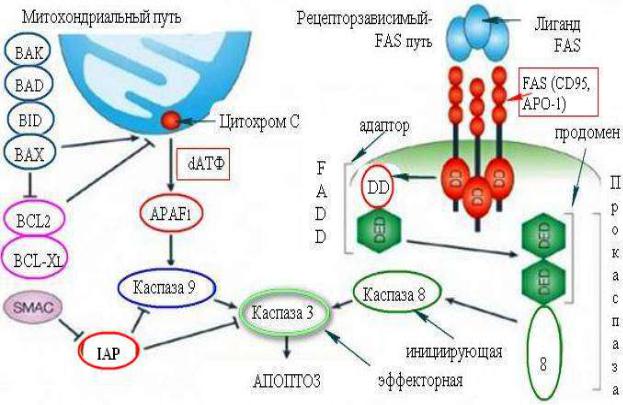
Инициация апоптоза через митохондриальный сигнальный путь
происходит вследствие пермеабилизации либо разрывов наружной митохондриальной мембраны, что способствует выходу в цитоплазму ряда апоптогенных факторов (цитохрома с, Smac, AIF, эндонуклеазы G и др.). В частности,
