
Специфические пути обмена аминокислот
.pdfТема: «Специфические пути обмена аминокислот»
Цель занятия: изучить специфические пути превращения аминокислот организме человека. Усвоить значение этих процессов. Использовать приобретенные знания при изучении других разделов биохимии.
План:
1.Фонд АК: пути образования и использования (схема).
2.Кофактор обмена АК – ТГФК: состав, образование из ФК, участие
втранспорте одноуглеродных фрагментов.
3.Причины распада АК. Классификация АК на (глюкогенные, кетогенные, глюко и кетогенные) – примеры.
4.Схема распада АК.
5.Распад глюкогенных АК до:
6.ПВК и ОАА (сер, цис, гли, три, тре, асн) на примере асн;
7.КГ (глу, глн, про, арг, гис) на примере арг;
8.Фумарата (фен, тир), на примере фен, нарушения распада (фенилкетонурия, алкаптонурия).
9.Схема распада кетогенных до:
10.АсКоА (лиз, тре, иле и три) на примере треонина;
11.Ацетоацетата (фен, тир);
12.АсКоА и ацетоацетата (лей)
13.Схема синтеза заменимых АК из:
14.промежуточныхпродуктовЦТК:оаа(асп,асн),a-КГ(глу,глн,про,
арг);
15.промежуточных продуктов обмена глю: пирувата (ала), 3- фосфоглицерата (сер, гли, цис)
16.Синтез катехоламинов из тирозина, их биологическая роль.
17.Синтез S-аденозилметионина из метионина.
18.Аргинин как источник оксида азота, биологическая роль NO.
19.Синтез креатина из аргинина и глицина. Использование креатина
вкачестве макроэрга, ферменты процесса.
Кроме общих путей обмена, характерных для большинства аминокислот, существуют и специфические пути превращения, которые приводят к синтезу биологически активных продуктов и во многом определяют физиологические состояния в организме человека.
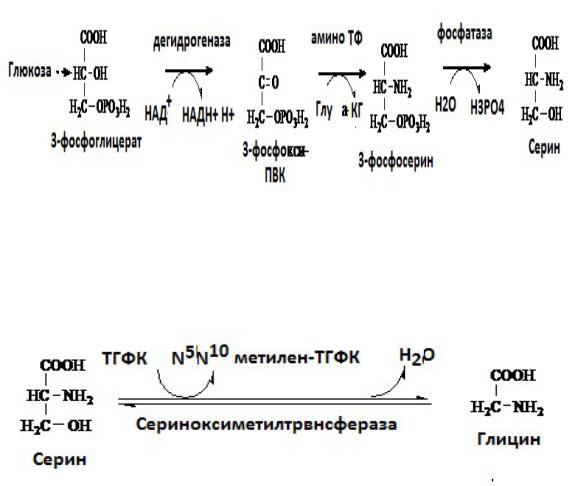
Обмен серина и глицина Серин-заменимая аминокислота,синтезируетсяиз промежуточного продукта
гликолиза - 3-фосфоглицерата, а аминогруппу получает от глутаминовой кислоты:
Глицин - также заменимая аминокислота, основным источником которой служит серин. Реакцию синтеза глицина из серина катализирует фермент сериноксиметилтрансфераза, коферментом которой является Н4-фолат (ТГФК):
Реакция превращения серина в глицин легко обратима.
Основной путь катаболизма глицина у человека также связан с использованием Н4-фолата:
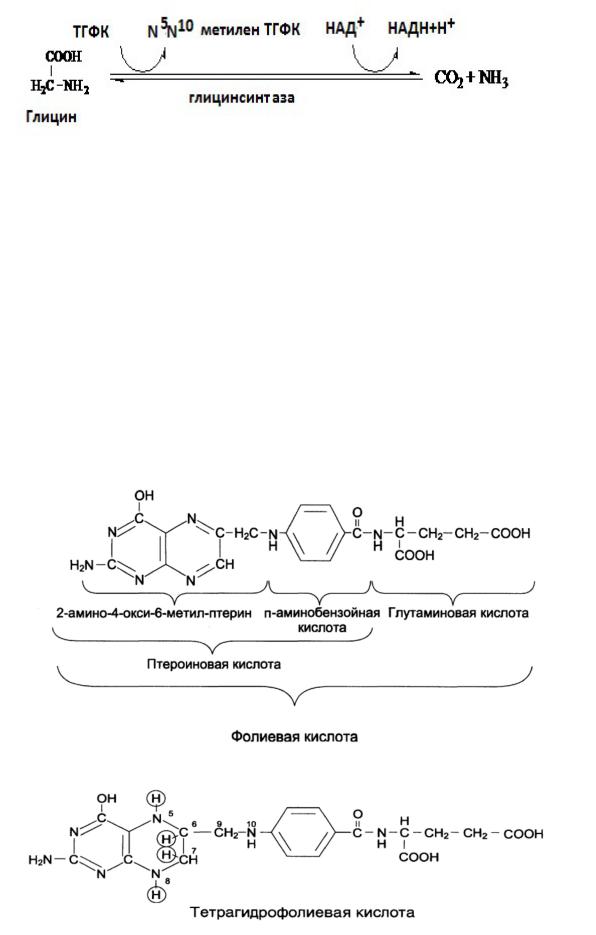
Роль фолиевой кислоты.
В превращениях серина и глицина главную роль играют ферменты, коферментамикоторыхслужатпроизводныефолиевойкислоты.Этотвитамин широко распространён в животных и растительных пищевых продуктах. Молекула фолиевой кислоты (фолата) состоит из 3 частей: птеринового производного, парааминобензойной и глутаминовой к-т. Фолиевая кислота в печени превращается в Н4-фолат в несколько стадий с участием ферментов фолатредуктазы и дигидрофолатредуктазы, коферментом которых служит НАДФН. Коферментную функцию выполняет восстановленная форма фолата - тетрагидрофолиевая кислота (ТГФК или Н4-фолат):
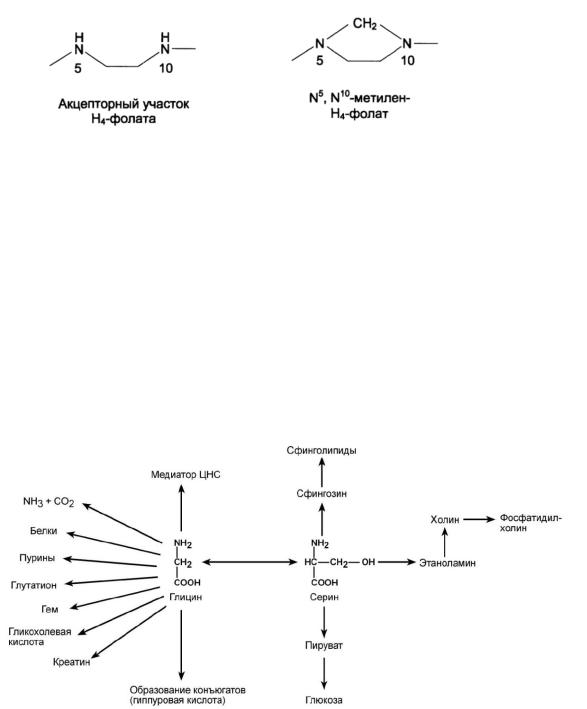
Н4-фолат - акцептор β-углеродного атома серина. При этом образуется метиленовый мостик между атомами азота в молекуле Н4-фолата в положениях 5 и 10, образуя метилен-Н4-фолат Аминокислоты серин и глицин выполняют в организме человека
разнообразные и очень важные функции. Роль серина и глицина в синтезе многих биологически важных соединений представлена на рис.1. На рисунке видно, что обе аминокислоты необходимы не только для синтеза белков и глюкозы (при её недостатке в клетках), но и нуклеотидов, коферментов, гема, сложных липидов, креатина и других соединений.
Рис. 1 Биологическая роль глицина и серина
Серин в составе белков-ферментов участвует в формировании каталитического центра фермента, например, в сериновых протеазах: трипсине, химотрипсине и др. Также серин участвует в формировании гидратной оболочки белков, потому что является полярной аминокислотой.
ращается в гиппуровую кислоту
Образование и использование одноуглеродных фрагментов.
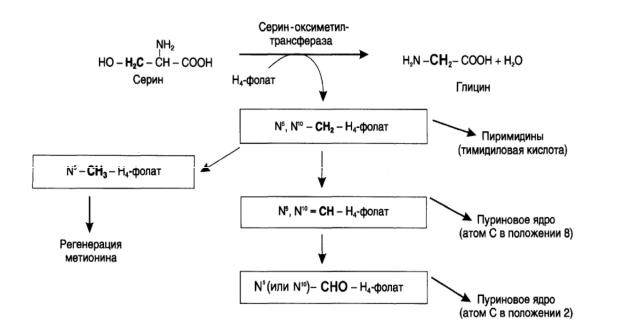
Особое значение реакций катаболизма серина и глицина заключается в том, что они сопровождаются образованием одноуглеродного метиленового фрагмента (-СН2-). Метиленовая группа в молекуле метилен-Н4-фолата может превращаться в другие одноуглеродные группы (фрагменты): метенильную (- СН=), формильную (-НС=О), метильную (-СН3) и формиминогруппу (- CH=NH). Все образующиеся производные Н4-фолата играют роль промежуточных переносчиков и служат донорами одноуглеродных фрагментов при синтезе некоторых соединений: пуриновых оснований и тимидиловой кислоты (необходимых для синтеза ДНК и РНК), регенерации метионина, синтезе различных формиминопроизводных и т.д.
Перенос одноуглеродных фрагментов к акцептору необходим не только для синтеза ряда соединений, но и для регенерации свободного Н4-фолата в печени.
Рис. 2 Образование и использование одноуглеродных фрагментов
Наследственные нарушения обмена глицина
В настоящее время известно несколько заболеваний, связанных с нарушениями обмена глицина. В их основе лежит недостаточность какоголибо фермента или дефект системы транспорта этой аминокислоты. Некоторые из этих нарушений представлены ниже.
Гиперглицинемия характеризуется повышенной концентрацией глицина в крови вследствие дефекта глицинрасщепляющей ферментной системы. Наиболее тяжёлое проявление гиперглицинемии - повреждение мозга, судороги, гипотония, нарушение дыхания.
Глицинурия характеризуется повышенным выделением глицина с мочой (до 1г/сут)принормальномсодержании его вкрови.Одиниз симптомовэтого заболевания - образование оксалатных камней в почках, причём содержание оксалата в моче находится в пределах нормы. Избыток оксалата имеет эндогенное происхождение. Скорее всего, он получается из глицина, при дезаминировании которого образуетсяглиоксилат-предшественникоксалата. Метаболический дефект, очевидно, состоит в нарушении метаболизма глиоксилата - невозможности его превращения снова в глицин из-за дефекта глицинаминотрансферазы. Причиной глицинурии является, очевидно, нарушение реабсорбции глицина в почках. Наследуется как доминантный признак, сцепленный, вероятно, с Х-хромосомой.
Первичная гипероксалатурия характеризуется постоянно высоким выделением оксалата с мочой, независимо от поступления его с пищей. В дальнейшем прогрессирует двустороннее образование оксалатных камней в мочевыводящих путях, развиваются нефрокальциноз и инфекция мочевыводящих путей. Больные погибают в детском возрасте от почечной недостаточности или гипертонии.
Обмен метионина
Метионин – незаменимая аминокислота, однако может регенерироваться из гомоцистеина:
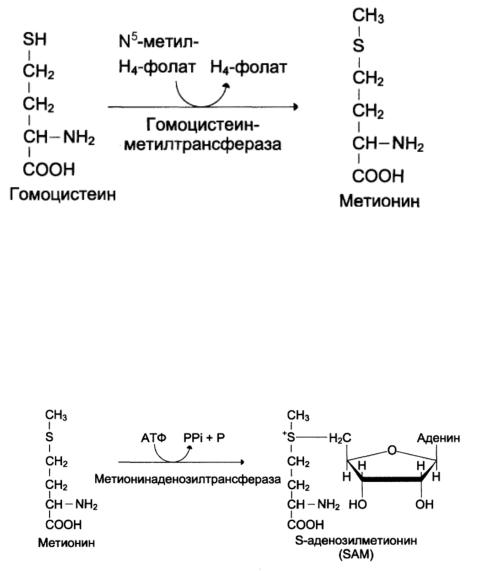
Главной особенностью обмена метионина является то, что из него тоже образуется активный одноуглеродный фрагмент в виде СН3-группы, которая участвует в различных синтезах. Однако, этот активный С1 образуется без участия ТГФК. Чтобы стать источником СН3- группы, метионин подвергается активации с участием АТФ:
ВрезультатеэтойреакцииотАТФотщепляютсявсетриостаткафосфорной кислоты, а аденозин присоединяется к атому серы метионина. Так образуется активная форма метионина - S- аденозилметионин.
S-аденозилметионин участвует в реакциях трансметилирования. Наиболее важный из них синтез фосфатидилхолина из фосфатидилэтаноламина, обезвреживание биогенных аминов с участием О-метилтрансфераз, синтез адреналина из норадреналина, синтез ацетилхолина из холина и Ацетил-КоА, синтез креатина и др:
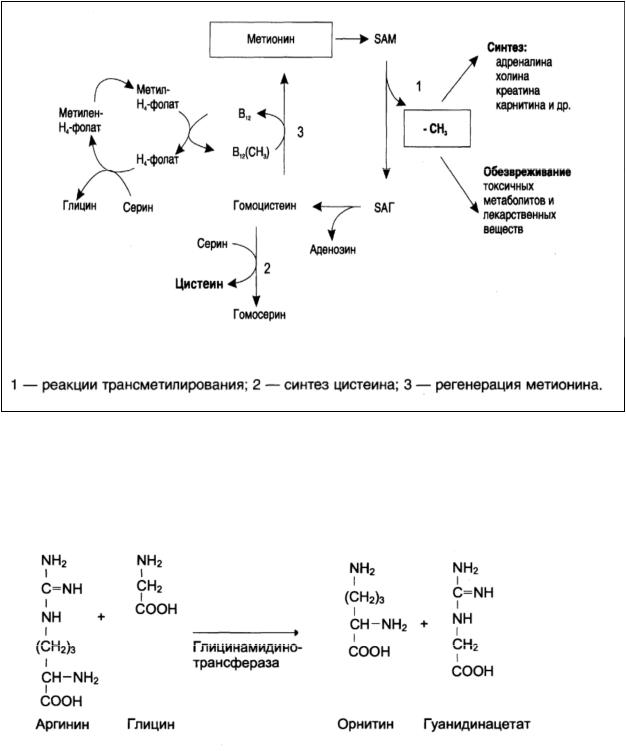
Рис.3 Метаболизм метионина
Синтез креатина
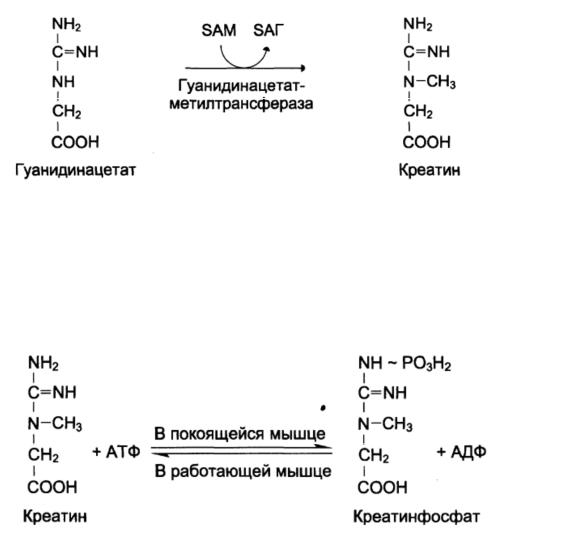
В синтезе креатина участвуют аргинин и глицин.
Первая стадия синтеза креатина (в почках) приводит к образованию гуанидинацетата:
Вторая стадия (в печени) – метилирование |
с участием S-аденозил- |
метионина и образования креатина: |
|
Судьба креатина
Креатин с кровотоком переносится в мышцы и клетки мозга, где подвергается фосфорилированию с участием АТФ, в результате образуется соединение с макроэргической связью – креатинфосфат:
Это обратимая реакция, которая катализируется ферментом креатинфосфокиназой (КФК). Фермент локализован в митохондриях клеток, обладает органоспецифичностью. В норме активность его в крови незначительна. Обнаружено три изоферментные форм креатинкиназы: КФК1 (ВВ, в головном мозге), КФК2 (МВ, в миокарде) и КФК3 (ММ, в скелетных мышца). Повышение их в крови позволяет определить поражение соответствующего органа. Определение активности изоферментных форм КФК используют для дифференциальной диагностики инфаркта миокарда, миопатий, мышечных дистрофий и т.д.
Креатинфосфатактивно синтезируется в покое, распадается при мышечной работе и играет важную роль в обеспечении энергией работающей мышцы в начальный период. Это наиболее быстрый способ регенерации АТФ.
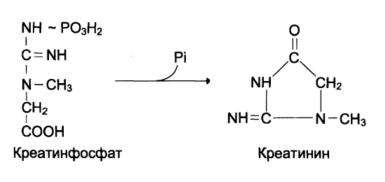
Креатинфосфат в результате неферментативного дефосфорилирования превращается в креатинин, который выводится с мочой:
Суточное выделение креатинина у каждого человека постоянно и пропорционально общей мышечной массе, поэтому у мужчин креатинина в моче больше, чем у женщин (в сутки вы водится 1-2 грамма креатинина). При уменьшении массы мышц вследствие длительного отрицательного азотистого баланса, при состояниях, ведущих к атрофии мышц, выделение креатинина снижается (голодание, острые инфекции, сахарный диабет и т.д).
Определение содержания креатина и креатинина в крови и моче используют также как показатель эффективности работы мышц в спортивной медицине.
Креатинин не реабсорбируется из первичной мочи, поэтому его количество во вторичной моче характеризует объем клубочковой фильтрации.
Биосинтез и биологическая роль оксида азота (II)
Аминокислотааргинин такжеслужитворганизме источникомоксидаазота (NO). Образование NO в клетках катализирует сложный Са2+-зависимый фермент NO-синтаза. Образование NO происходит во всех клетках и тканях. NO – важная сигнальная молекула, активирующая гуанилатциклазу и стимулирующая быстрое образование цГМФ. Это вызывает снижение силы сердечных сокращений, регулирует секрецию медиаторов и гормонов, обладает антиканцерогенной активностью.
