
Биосинтез ВЖК, регуляция. Роль ЛОНП в транспорте жиров
.pdfТема: «Биосинтез ВЖК, регуляция. Роль ЛОНП в транспорте жиров.»
1.Синтез ВЖК: характеристика процесса, транспорт ацетилКоА в цитозоль, образование малонил-Ко.
2.Строение синтазы жирных кислот.
3.Реакции синтеза жирных кислот.
4.Представление о синтезе удлиненных и ненасыщенных ВЖК. Регуляция синтеза ВЖК.
5.II-й ресинтез липидов: субстраты, ферменты, последовательность реакций.
6.Синтез фосфолипидов: последовательность реакций, взаимопревращения глицерофосфолипидов, регуляция. Липотропные факторы.
7.Транспортная форма эндогенных жиров – ЛОНП: состав, метаболизм.
8.Сурфактант: структура, биологическая роль.
9.Транспортная форма эндогенных жиров – ЛПОНП: состав, метаболизм.
Большинство жирных кислот, необходимых человеку, содержится в рационе, однако
путь их синтеза (липогенез) из двухуглеродных соединений (de novo) присутствует во многих тканях, таких как: печень, мозг, почка, молочная железа и в меньшей степени -
жировой ткани. Биосинтез жирных кислот происходит в абсорбтивный период при высокой концентрации глюкозы в крови путем последовательного присоединения двухуглеродных фрагментов к цепи.
Синтез пальмитиновой кислоты
Липогенез, в отличие от β-окисления, протекает в цитозоле клетки и требует другого набор ферментов. Кроме того, он использует восстановленный никотинамидаденинди-нуклеотидфосфат (NADPH) в качестве донора водородов, в отличие от никотинамидадениндинуклеотида (NAD+), необходимого для β-окисления.
Условно можно следующие этапы биосинтеза жирных кислот:
•образование субстратов: АсКоА, СО2, НАДФН;
• транспорт ацетил-КоА из митохондрии в цитозоль.
Митохондриальный АсКоА образуется при декарбоксилировании пирувата и в процессе катаболизма некоторых аминокислот.
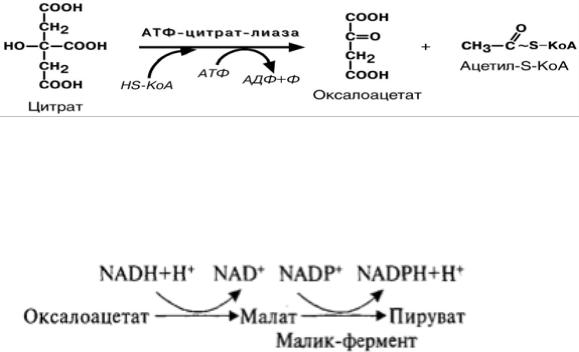
Основным поставщиком НАДФН является пентозофосфатный путь, кроме того,
дополнительное его количество образуется из оксалоацетата при участии малик-фермента.
Транспорт ацетил-КоА из митохондрии в цитозоль
Ацетил-КоА образуется в матриксе как при распаде углеводов и кетогенных
аминокислот.
Внутренняя мембрана митохондрий непроницаема для ацетил-КоА, поэтому роль переносчика ацетильных групп из митохондрий выполняет цитрат, концентрация которого в абсорбтивный период повышается. Это связано с образованием больших количеств АТФ и NADH, которые аллостерически ингибируют регуляторные ферменты ЦТК, что приводит к замедлению цикла Кребса и накоплению цитрата.
Часть цитрата переносится в цитозоль, где расщепляется на ацетил-КоА и ОАА под действием фермента цитратлиазы:
Этот процесс является энергозависимым, поскольку связан с использованием
АТФ.
Оксалоацетат в цитозоле подвергается следующим превращениям:
+ СО2
Пируват транспортируется обратно в матрикс митохондрий. Восстановленный в результате действия малик-фермента НАДФН используется как донор водорода для последующих реакций синтеза жирных кислот (другой источник НАДФН - окислительные стадии пентозофосфатного пути катаболизма глюкозы) (рис. 3.2.).
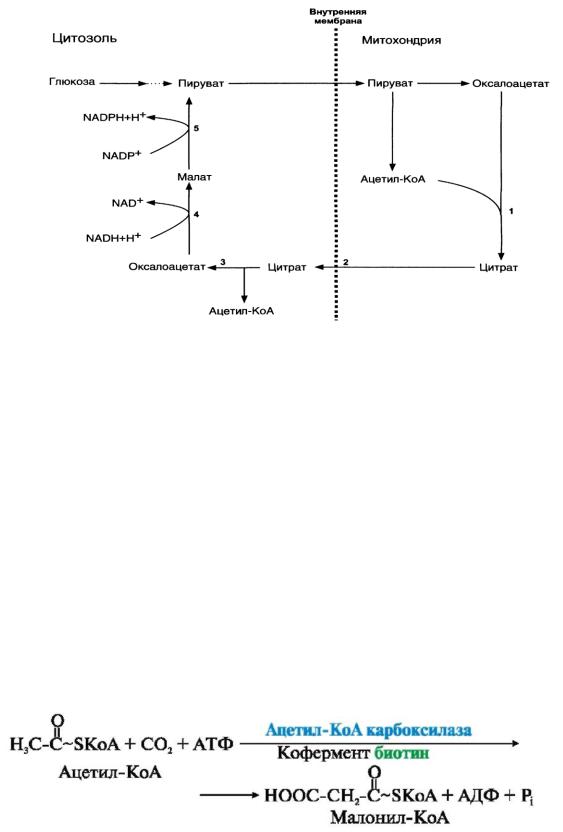
Рис.2.2. Перенос ацетильного остатка из митохондрий в цитозоль (Т-Транслоказа)
при участии ферментов: 1-цитратсинтаза, 2-транслоказа, 3-цитратлиаза, 4-
малатдегидрогеназа, 5-малик-фермент.
Всинтезе жирной кислоты выделяют стадии:
-образования малонил-КоА;
-удлинения цепи.
Вцитозоле ацетил-КоА карбоксилируется и превращается в малонил-КоА - второй субстрат, необходимый для образования жирной кислоты. Реакцию катализирует биотин-
зависимый фермент ацетил-КоА-карбоксилаза с участием АТФ. Реакция протекает в 2
этапа. На первом - СО2 связывается в активном центре с биотином, а на втором этапе - СО2
переносится на молекулу ацетил-КоА:
Фермент ацетил-СоА-карбоксилаза – регуляторный фермент, является сложным белком, содержащим в качестве простетической группы остаток фосфорилированного биотина (витамина Н).

Процесс синтеза жирной кислоты носит циклический характер. При каждом обороте цикла происходит удлинение жирной кислоты на два углеродных атома. Промежуточные продукты синтеза остаются связанными с ферментом вплоть до образования пальмитиновой кислоты.
После образования малонил-СоА синтез жирных кислот продолжается на мультиферментом комплексе – синтазе высших жирных кислот (пальмитоилсинтазе).
Она состоит из 2 идентичных протомеров, каждый из которых содержит семь доменов с
различными |
ферментативными |
активностями |
и |
ацильный |
белок-носитель |
ацилпереносящий белок (АПБ или acyl-carrier protein, АСР), который |
заменяет CoA, |
||||
связываясь |
с удлиненной цепью кислот. АПБ содержит длинную пантетеиновую группу, |
||||
которая действует как гибкая «рука», делающая синтезируемую молекулу доступной для различных ферментов в комплексе синтетазы жирных кислот. Структурно фосфопантотеиновая группа АПБ соответствует аналогичной группе в коферменте А.
Протомеры синтазы ВЖК находятся в положении «голова к хвосту» и каждый содержит по две SH-группы:
одна -у цистеина в составе кетоацилсинтазы,
другая – у 4- фосфопантеината из АПБ)
Таким образом, в активном центре каждого из протомеров присутствуют 2
свободные SН-группы.
Реально синтезируются одновременно 2 жирных кислоты, но для упрощения в
схемах изображают последовательность реакций для синтеза одной молекулы кислоты.
Мультиферментный комплекс синтазы ВЖК действует как роторный механизм по
кругу: продукт, образованный на одном центре, с помощью АПБ перемещается в другой
активный центр.
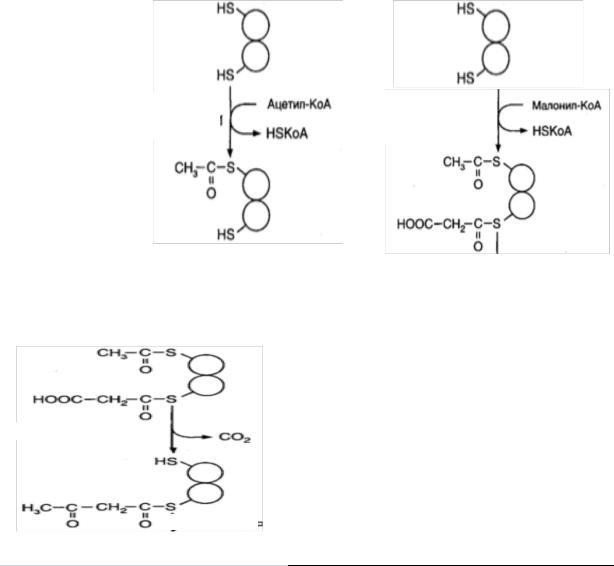
Началу синтеза ВЖК предшествует перенос ацетильного и малонильного остатков
на SН-группы пальмитоилсинтазы:
|
ацетил-СоА переносит |
ацетил-трансацилаза |
на SH-группу цистеина |
|
кетоацилсинтазного центра. |
|
|
|
малонил-СоА переносит малонил-трансацилаза на SH-группу АПБ. |
||
цис |
цис |
АПБ |
АПБ |
|
АцетилКoA-АПБ- |
|
малонил-КоА- |
трансацетилаза |
|
АПБ-ТФ |
|
цис |
цис |
|
|
|
|
АПБ |
АПБ |
|
|
После этого комплекс готов к первому циклу синтеза, состоящему из четырех
реакций:
1
кетоацилсинтаза
•конденсация: ацетильная группа переносится на малонильную группу в НSAПБ ферментом 3-кетоацилсинтазой в
результате: образуется 3-кетоацил-АПБ, выделяется CO2 и освобождается остаток цистеина, который был занят ацетил-КоА.
АПБ
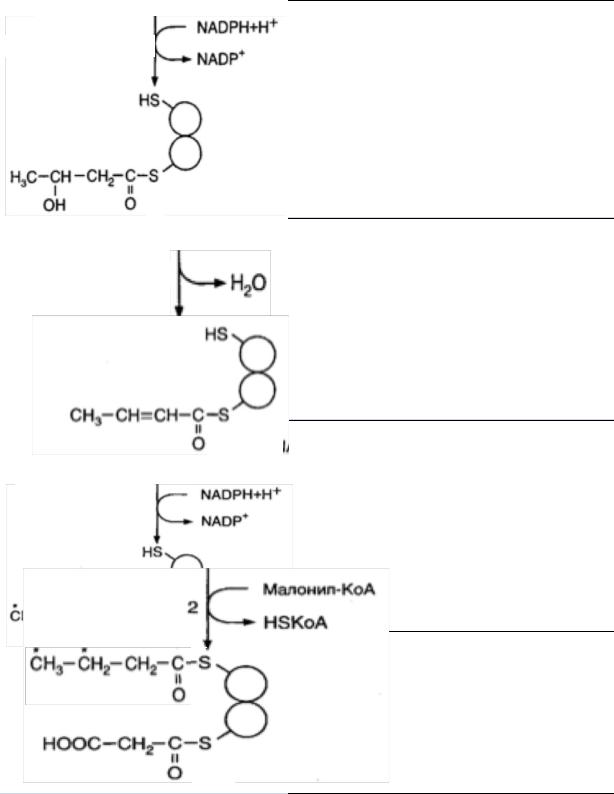
кетоацилредуктаза |
2 |
АПБ
восстановление 3-оксо группы с участием кофермента NADPH как донора водорода до 3-оксиацил-АПБ (3-
оксибутирил-АПБ) при участии
кетоацилредуктазы.
дегидратация радикала с
оксиацилдегидратаза |
3 |
последующим образованием двойной связи |
|
||
|
|
|
|
|
при С2 и транс–еноил-АПБ (кротонил-АПБ) |
|
|
при участии дегидратазы. |
АПБ
восстановления радикала при участии
Еноилредуктаза
АПБ
цис
АПБ
NADPH с образованием |
ацил-АПБ |
|
(бутирил–АПБ) |
при |
участии |
еноилредуктазы. |
(закончился 1-й цикл |
|
синтеза) |
|
|
Далее следует перенос:
радикала ацила (бутирила) на SНгруппу цистеина, а
Новая молекула малонила переносится
на SН-группу АПБ и процесс повторяется вновь до образования пальмитиновой кислоты.
Аналогичные циклы реакций повторяются до тех пор, пока не образуется радикал
пальмитиновой кислоты, который под действием тиоэстеразы гидролитически отделяется
от ферментного комплекса, превращаясь в свободную пальмитиновую кислоту:
С15Н31СО-SАПБ + Н2О -тиоэстераза-> С15Н31СООН + HS-АПБ

Суммарное уравнение синтеза пальмитиновой кислоты из ацетил-КоА и малонил-
КоА имеет следующий вид:
Ацетил-КоА +7Малонил-КоА + 14(НАДФН+Н+) -> С15Н31СООН + 7СО2 + 8НS - КоА + 14НАДФ+ + 7Н2О
Процесс биосинтеза жирных кислот является энергозависимым, поскольку использует АТФ для процессов карбоксилирования ацетил-СоА (при синтезе малонил-
СоА) и транспорта ацетил-СоА из митохондрии (в цитратлиазной и пируваткарбоксилазной реакциях), и 2 НАДФН в восстановительных реакциях.
Представление о синтезе удлиненных и ненасыщенных ВЖК
Жирные кислоты, радикал которых содержит более 16 атомов углерода,
синтезируются в эндоплазматическом ретикулуме аналогично тому, как это происходит на пальмитоилсинтазе: путем достраивания пальмитоила с помощью малонил-КоА, доноров -
НАДФН + H+. Но каждую стадию процесса катализируют отдельные ферменты, а не комплекс. Первоначальным продуктом элонгации пальмитиновой кислоты является стеариновая кислота (С18:0), радикал которой в дальнейшем может увеличиваться до 24-26
углеродных атомов, что наиболее активно протекает в клетках мозга.
Пальмитат и стеарат могут быть с предшественниками двух наиболее распространенных мононенасыщенных (моноеновых) жирных кислот: пальмитолеата, (16:
1, 9), и олеата (18: 1, 9), которые содержат одинарную цис-двойную связь между C-9 и
C-10. Двойная |
связь вводится в цепь кислоты реакцией окисления кислородом, |
|
катализируемой |
оксидазой со смешанной функцией, встроенной в мембрану ЭР. |
В ее |
состав входят: ацил-КоА-9-десатураза, цитохром b5 и NADH-цитохром b5 редуктаза. |
|
|
Образование полиеновых кислот в организме человека не происходит (арахидоновая кислота синтезируется незначительно микрофлорой кисшечника). Комплекс полиеновых высших жирных кислот, в состав которого входят линолевая и линоленовая кислоты,
называют «витамин F».
Регуляция биосинтеза ВЖК
Когда в клетке достаточно метаболического топлива для удовлетворения своих энергетических потребностей, то его избыток превращается в жирные кислоты и хранится
в виде триацилглицеролов.
Реакция, катализируемая ацетил-КоА-карбоксилазой, является стадией,
ограничивающей скорость биосинтеза жирных кислот.
Цитрат играет центральную роль в переключении клеточного метаболизма от потребления (окисления) метаболического топлива к хранению топлива в виде жирных кислот. Когда концентрации митохондриального ацетил-КоА и АТФ увеличиваются,
цитрат транспортируется из митохондрий; затем он становится и предшественником цитозольного ацетил-КоА и аллостерического сигнала для активации ацетил-КоА-
карбоксилазы. В то же время цитрат ингибирует активность фосфофруктокиназы-1, снижая
скорость гликолиза.
Накапливаемый пальмитоил-КоА, (продукт синтеза жирных кислот) ингибирует
ацетил-КоА-карбоксилазу по принципу отрицательной обратной связи.
Ацетил-КоА-карбоксилаза также регулируется ковалентной модификацией.
Фосфорилирование, запускаемое гормонами глюкагоном и адреналином, инактивирует фермент и снижает его чувствительность к активации цитратой, тем самым замедляя синтез жирных кислот. В своей активной (дефосфорилированной) форме ацетил-КоА-
карбоксилаза полимеризуется в длинные нити; фосфорилирование сопровождается диссоциацией на мономерные субъединицы и потерей активности ацетил-КоА-
карбоксилазы. |
|
При длительном потреблении пищи |
с высоким содержанием углеводов повышается |
уровень инсулина, который индуцирует |
синтез АсКоАкарбоксилазы, ВЖК-синтазы, что |
увеличивает и синтез жирных кислот. Низкокалорийная или низкоуглеводная диета с высоким содержанием жиров имеет противоположный эффект.
II -й ресинтез липидов: субстраты, ферменты, последовательность реакций.
Жирные кислоты, синтезированные или поступившие при гидролизе липидов в составе липопротеинов, могут включаться в состав ТАГ или фосфолипидов. Во время роста активируется синтез фосфолипидов, при обильном употреблении пищи – клетка большую часть ВЖК превращает в липиды для хранения. Запасание жиров в жировой ткани -
основная форма депонирования источников энергии в организме человека.
Триацилглицеролы и глицерофосфолипиды синтезируются из одних и тех же предшественников.
Характеристика синтеза ТАГ:
Период активации |
абсорбтивный, при при избыточном поступлении в |
|
организм углеводов |
|
|
Локализация: |
цитозоль клеток: печени, жировой ткани, лактирующей |
|
молочной железы |
|
|
Субстраты |
• глицерол в виде глицерол-3-фосфата и |
для синтеза ТАГ |
• активные формы жирных кислот - ацил-КоА |
|
|
|
|
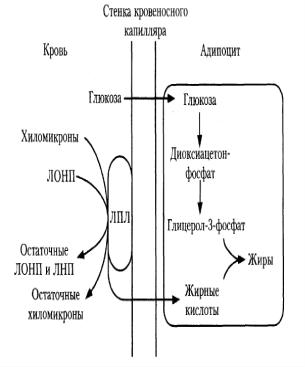
Основными источниками ВЖК в жировой ткани являются:
• |
хиломикроны, |
доставляющие |
|
экзогенные жиры из кишечника |
|
• |
ЛОНП, |
транспортирующие |
|
эндогенные жиры, синтезированные |
|
|
в печени из глюкозы |
|
• |
Ацетил-КоА, образовавшийся при |
|
|
распаде глюкозы. |
|
Скорость освобождения ВЖК из состава липопротеинов зависит от количества и активности липопротеинлипазы (ЛПЛ), которая выходит из адипоцита и фиксируется на поверхности стенки капилляра с помощью гепарансульфата.
Глицерофосфат образуется:
•восстановлением дигидроксиацетонфосфата (метаболита гликолиза) – в печени и жировой ткани;
•из глицерола – только в печени, а в жировой ткани из-за отсутствия глицеролкиназы глицерин не используется.
Триацилглицеролы образуются путем замещения водорода в ОН-группах глицерол-
3-фосфата на ацильные остатки с участием фермента ацилтрансферазы. Насыщенный ацильный остаток занимает положение при первом углероде, ненасыщенные (реже -
насыщенный) -при втором. Образовавшаяся фосфатидная кислота далее дефосфорилируется до диацилглицерина, который затем вновь ацилируется уже третьей молекулой ацил-СоА с образованием триацилглицеринов (рис. 3-8).
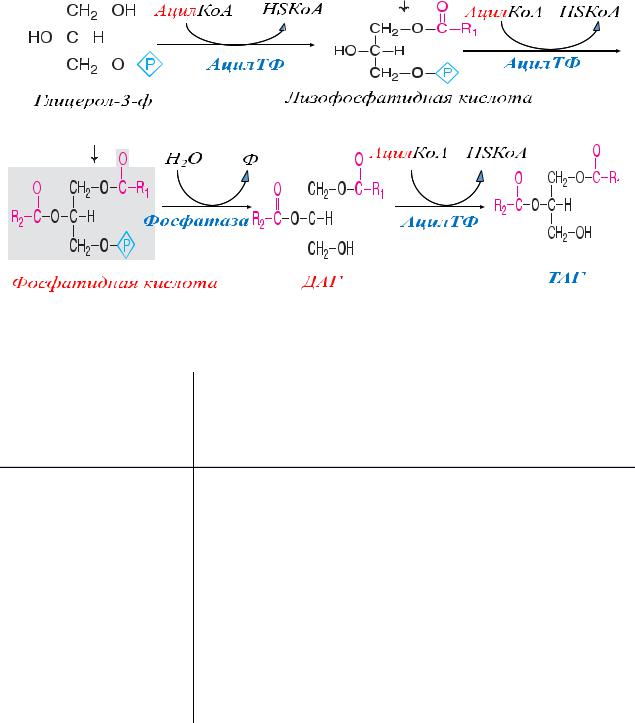
Рис.3-8. Синтез фосфатидной кислоты и ТАГ
|
Синтез фосфолипидов |
|
Локализация |
эндоплазматическая сеть клеток |
многих тканей, особенно: |
|
печени, кишечника, семенников, |
молоч-ной железы |
Период |
быстрого роста, когда для производства новых мембран |
|
требуются фосфолипиды. |
|
|
Субстраты |
- глицеролфосфат, ацил-СоА, из которых синтезируется |
|
общий предшественник – диацилглицерол, |
|
- полярные соединения (полярная «головка»): этаноламин, |
|
фосфатидилхолин, серин, инозит |
|
- ЦТФ (цитидинтрифосфат) |
В зависимости от вида используемых ВЖК, образующаяся фосфатидная кислота
направляется на синтез: |
|
• ТАГ, если в ее состав сходят |
кислоты: пальмитиновая, стеариновая, |
пальмитоолеиновая, олеиновая кислоты,
• Фосфолипидов - при наличии в ее составе полиненасыщенных жирных кислот.
Первые стадии синтеза глицерофосфолипидов и ТАГ, до образования фосфатидной кислоты, протекают одинаково (3-8).
Возможны два пути синтеза глицерофосфолипидов – через активацию:
