
Синтез глюкозы из веществ неуглеводной природы - глюконеогенез, регуляция
.pdfТема: «Синтез глюкозы из веществ неуглеводной природы -
глюконеогенез, регуляция»
Цель занятия: изучить синтез глюкозы в процессе глюконеогенеза,
определить его связь с другими обменами.
План:
1.Глюконеогенез: характеристика процесса, субстраты,
локализация процесса, биологическое значение.
2.Необратимые реакции гликолиза и глюконеогенеза. Схема глюконеогенеза в организме человека, этапы, ферменты.
3.Синтез глюкозы из лактата и глицерина, аминокислот. Циклы:
Кори и глюкозо-аланиновый.
4.Регуляция процессов гликолиза и глюконеогенеза.
1. Глюконеогенез: характеристика процесса, субстраты,
локализация процесса, биологическое значение.
Глюконеогенез – процесс синтеза глюкозы «de novo» из веществ неуглеводной природы.
Некоторые ткани, например мозг, нуждаются в постоянном поступлении глюкозы. Когда поступление углеводов в составе пищи недостаточно,
содержание глюкозы в крови некоторое время поддерживается в пределах нормы за счёт расщепления гликогена в печени. Однако запасы гликогена в печени невелики. Они значительно уменьшаются к 6-10 ч голодания и практически полностью исчерпываются после суточного голодания. В этом случае в печени начинается синтез глюкозы de novo
Биологическая роль глюконеогенеза - поддержание уровня глюкозы в крови в период длительного голодания и интенсивных физических нагрузок.
Локализация: главным образом в печени и менее интенсивно - в
корковом веществе почек, а также в слизистой оболочке кишечника. Эти ткани могут обеспечивать синтез 80-100 г глюкозы в сутки. На долю мозга при голодании приходится большая часть потребности организма в глюкозе. Это

объясняется тем, что клетки мозга не способны, в отличие от других тканей,
обеспечивать потребности в энергии за счёт окисления жирных кислот.
Первичные субстраты глюконеогенеза: лактат, аминокислоты и глицерол.
Включение этих субстратов в глюконеогенез зависит от физиологического состояния организма.
Лактат - образуется при любых состояниях организма в эритроцитах и работающих мышцах. Таким образом, лактат используется в глюконеогенезе постоянно.
Аминокислоты - образуются в результате распада белков мышц и соединительной ткани и включаются в глюконеогенез при длительном голодании или продолжительной мышечной нагрузке.
Глицерол - высвобождается при гидролизе жиров в жировой ткани в постабсорбтивный период или при физической нагрузке;
Рис.1 Включение субстратов в глюконеогенез: связь трех видов обмена веществ
2. Неообратимые реакции гликолиза и глюконеогенеза. Схема
глюконеогенеза в организме человека, этапы, ферменты.
Большинство реакций гликолиза и глюконеогенеза являются обратимыми и катализируются одними и теми же ферментами. Три реакции гликолиза (1,3 и 10-я) являются необратимыми, поэтому существуют обходные стадии глюконеогенеза и гликолиза. На этих стадиях реакции глюконеогенеза протекают другими путями.
I-я обходная стадия: образование ФЕП из пирувата.
II-я обходная стадия: гидролиз фруктозо-1,6-бисфосфата

III-я обходная стадия: гидролиз глюкозо6-фосфата.
I-я обходная стадия: образование фосфоенолпирувата из пирувата состоит из 4-х реакций. В митохондриях пируваткарбоксилаза превращает ПВК в оксалоацетат. Эта реакция идет в клетке постоянно, являясь анаплеротической (пополняюшей) реакцией ЦТК.
СОО |
- |
Пируваткарбоксилаза |
|
- |
||
|
|
|
|
|||
|
СО |
, биотин |
|
СОО |
||
|
|
2 |
|
|
С O |
|
С O |
|
|
|
|
|
|
|
|
|
|
СН |
|
|
|
|
|
|
|
|
|
СН |
|
|
|
|
2 |
- |
3 |
|
АТФ |
АДФ, Н РО |
|
СОО |
|
|
|
4 |
||||
Пируват |
|
3 |
Оксалоацетат |
|||
|
|
|
||||
Мембрана митохондрий непроницаема для оксалоацетата.
оксалоацетата. Зато через мембрану может пройти малат. Повернуть малатдегидрогеназную реакцию ЦТК вспять позволяет избыток НАДН в митохондриях. НАДН поступает из β-окисления жирных кислот,
активируемого в условиях недостаточности глюкозы в гепатоците.
В результате малат накапливается, выходит в цитозоль и здесь превращается обратно в оксалоацетат.
В цитоплазме фосфоенолпируваткарбоксикиназа осуществляет превращение ОАА в ФЕП, для реакции требуется энергия ГТФ. От молекулы отщепляется тот же углерод, что и присоединяется.

После образования фосфоенолпирувата все остальные реакции также протекают в цитозоле вплоть до образования фруктозо-1,6-бисфосфата и катализируются гликолитическими ферментами.
Рис.2 Схема превращения пирувата в ФЕП.
II-я обходная стадия: гидролиз фруктозо-1,6-бисфосфата
Второе препятствие на пути синтеза глюкозы – фосфофруктокиназная реакция – преодолевается с помощью фермента фруктозо-1,6-дифосфатазы.
Этот фермент есть в почках, печени, поперечно-полосатых мышцах. Таким образом, эти ткани способны синтезировать фруктозо-6-фосфат и глюкозо-6-
фосфат.
III-я обходная стадия: гидролиз глюкозо-6-фосфата.
Последняя реакция катализируется глюкозо-6-фосфатазой. Она имеется только в печени и почках, следовательно, только эти ткани могут продуцировать свободную глюкозу.
3.Синтез глюкозы из лактата и глицерина, аминокислот. Циклы:
Кори и глюкозо-аланиновый.
Синтез глюкозы из пирувата. В ходе этого процесса расходуются 6
моль АТФ на синтез 1 моль глюкозы из 2 моль пирувата. Четыре моль АТФ расходуются на стадии синтеза фосфоенолпирувата из оксалоацетата и ещё 2
моль АТФ на стадиях образования 1,3-бисфосфоглицерата из 3-фосфо-
глицерата.
Суммарный результат глюконеогенеза из пирувата выражается следующим уравнением:
2 Пируват + 4 АТФ + 2 ГТФ + 2 (NАDН+ Н+) + 4 H2O →
Глюкоза + 4 АДФ + 2 ГДФ + 6 Н3РО4 + 2 NАD+.
Синтез глюкозы из аминокислот. В условиях голодания часть белков мышечной ткани распадается до аминокислот, которые далее включаются в процесс катаболизма.
Аминокислоты, которые при катаболизме превращаются в пируват или метаболиты цитратного цикла, могут рассматриваться как потенциальные предшественники глюкозы и гликогена и носят название гликогенных.
Например, оксалоацетат, образующийся из аспарагиновой кислоты, является промежуточным продуктом как цитратного цикла, так и глюконеогенеза.
Из всех аминокислот, поступающих в печень, примерно 30% приходится на долю аланина.
Это объясняется тем, что при расщеплении мышечных белков образуются аминокислоты, многие из которых превращаются сразу в пируват или сначала в оксалоацетат, а затем в пируват. Последний превращается в аланин, приобретая аминогруппу от других аминокислот.
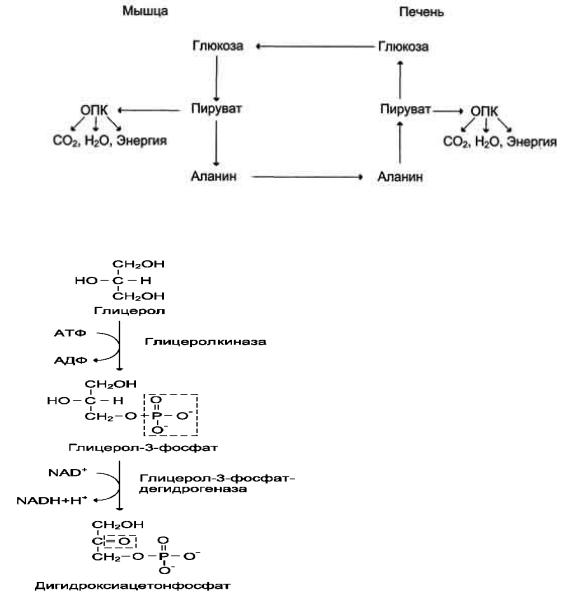
Аланин из мышц переносится кровью в печень, где снова преобразуется в пируват, который частично окисляется и частично включается в глюконеогенез.
Следовательно, существует следующая последовательность событий
(глюкозо-аланиновый цикл): глюкоза в мышцах → пируват в мышцах → аланин в мышцах → аланин в печени → глюкоза в печени → глюкоза в мышцах.
Весь цикл не приводит к увеличению количества глюкозы в мышцах, но он решает проблемы транспорта аминного азота из мышц в печеньи предотвращает лактоацидоз.
Рис.3 Цикл аланин-глюкоза
Синтез глюкозы из глицерола.
Рис.4 Образование дигидроксиацетонфосфата
Глицерол образуется при гидролизе триацилглицеролов,
главным образом в жировой ткани. Использовать его могут только те ткани, в которых имеется фермент глицеролкиназа, например печень, почки. Этот АТФ-
зависимый фермент катализирует превращение глицерола в α-глицерофосфат
(глицерол-3-фосфат).
При включении глицерол-3-фосфата в глюконеогенез происходит его дегидрирование НАД-зависимой дегидрогеназой с образованием дигидроксиацетонфосфата, который далее превращается в глюкозу.
Суммарная реакция синтеза глюкозы из глицерола
2Глицерол+2АТФ+2НАД+2Н2О→глюкоза+2АДФ+2Н3РО4+2НАДН+Н
Синтез глюкозы из лактата. Использование лактата связано с его превращением в печени в пируват (цикл Кори). Лактат как источник пирувата важен не столько при голодании, сколько при нормальной жизнедеятельности организма.

Рис. 5 Общая схема гликолиза и глюконеогенеза
4. Регуляция процессов гликолиза и глюконеогенеза
Процессы гликолиза и глюконеогенеза имеют разное биологическое значение, поэтому скорость каждого из них определяется физиологическим состоянием организма.
Гликолитическое окисление глюкозы как процесс, ведущий к выработке энергии, активируется при недостатке энергии в клетке. Глюконеогенез необходим при гипогликемии и как любой анаболический процесс, наоборот,
идет с затратой энергии.
Превращения метаболитов в глюконеогенезе и гликолизе скоординированы так, что один процесс активен, а другой нет. Если одновременно активны оба процесса, то следует гидролиз четырех молекул нуклеозидтрифосфатов (2 АТФ и 2 ГТФ) в каждом цикле. Оба процесса экзергоничны, поэтому термодинамически невыгодна одновременная их активация.
Переключение метаболизма печени с гликолиза на глюконеогенез и наоборот происходит при помощи:
•- аллостерических механизмов регуляции активности ключевых
ферментов:
•- ковалентной модификации ферментов путем фосфорилирования
(дефосфорилирования) с участием инсулина и глюкагона;
• - индукции (репрессии) синтеза ключевых ферментов,
катализирующих реакции субстратных или «холостых» циклов.
Регуляторные ферменты гликолиза - гексокиназа, глюкокиназа,
фосфофруктокиназа и пируваткиназа.
Регуляторные ферменты глюконкогенеза: глюкозо-6-фосфатаза,
фруктозо-1,6-дифосфатаза (фосфатаза фруктозо-1,6-бифосфата), ФЕП-
карбоксикиназа и пируваткарбоксилаза);
Регуляция гликолиза и глюконеогенеза в печени направлена на необратимые стадии гликолиза и глюконеогенеза, которые формируют три субстратных цикла. Эти циклы обозначены цифрами I, II, III на рис.5. Название
«субстратный цикл» означает объединение реакций синтеза и распада субстрата. Название «холостой» отражает результат работы подобного цикла,
заключающийся в бесполезном расходовании АТФ. Хотя существование
«холостых» циклов нелогично, тем не менее они могут функционировать.
Более того, эти циклы могут быть мишенью регуляторных воздействий, так как составляющие их реакции катализируют разные ферменты. Реципрокное изменение активности этих ферментов предотвращает одновременное протекание противоположных процессов.

Изменение в печени гликолитического направления на глюконеогенез и обратно при смене абсорбтивного состояния на постабсорбтивное или при голодании происходит главным образом в результате регуляции активности ферментов, катализирующих реакции субстратных циклов.
Направление реакций первого субстратного цикла регулируется главным образом концентрацией глюкозы.
При пищеварении (абсорбтивный период) концентрация глюкозы в крови повышается (до 10 ммоль/л). Активность глюкокиназы в этих условиях максимальна. Вследствие этого ускоряется реакция Глюкоза → Глюкозо-6-
фосфат. Поскольку глюкокиназа печени не ингибируется глюкозо-6-
фосфатом (в отличие от гексокиназы мышц), то основная часть глюкозо-6-
фосфата направляется в гликолиз и на синтез гликогена.
Направление реакций второго субстратного цикла зависит от активности фосфофруктокиназы и фруктозо-1,6-бисфосфатзы. Регулирует активность этих ферментов. фруктозо-2,6-бисфосфат,. который одновременно выполняет функцию аллостерического активатора фосфофруктокиназы и аллостерического ингибитора фруктозо-1,6-бисфосфатзы.
Рис. 6 Регуляция реакций II субстратного цикла фруктозо-2,6-бисфосфатом.
Фруктозо-2,6-бисфосфат образуется в абсорбтивный период путем фосфорилирования фруктозо-6-фосфата при участии бифункционального
фермента (БИФ).
Образование фруктозо-2,6-бисфосфата требует затрат АТФ, а при образовании фруктозо-6-фосфата из фруктозо-2,6-бисфосфата высвобождается неорганический фосфат.
БИФ катализирует реакции превращения фруктозо-6-фосфата во фруктозо-2,6-бисфосфат. БИФ может находиться в двух формах:
