
Регуляция скорости ферментативных реакций
.pdfТема: «Регуляция скорости ферментативных реакций»
Цель занятия: изучить типы изменения активности ферментов в зависимости от различных факторов. Ознакомиться с применением ферментов в медицине.
I.Теоретическая часть.
План:
1.Ингибирование активности ферментов: определение, классификация.
2.Виды ингибирования: обратимое, конкурентное, неконкурентное, необратимое.
3.Регуляция скорости ферментативных реакций:
изменением количества молекул фермента в клетке;
доступностью молекул субстрата и кофермента;
локализацией ферментов в определенном отсеке клетки (компартментализация);
4.Аллостерическая регуляция.
5.Регуляция с помощью белок-белковых взаимодействий;
6.Регуляция частичным (ограниченным протеолизом).
7.Регуляция путем фосфорилирования/дефосфорилирования;
8.Энзимопатии.
9.Энзимодиагностика. Изоферменты.
1. Отличительной способностью ферментов является их способность под действием различных факторов изменять свою активность. Активность большинства ферментов подавляется множеством соединений, которые называют ингибиторами.
И н г и б и т о ры - вещества, вызывающие частичное или полное торможение химических реакций.
Снижение активности ферментов в присутствии ингибиторов называется
ингибированием.
Можно выделить два основных направления ингибирования:
по прочности связывания фермента с ингибитором ингибирование бывает: обратимым и необратимым;
по отношению ингибитора к активному центру фермента ингибирование делят на конкурентное и неконкурентное;
2. Обратимое ингибирование.
Обратимые ингибиторы связываются с ферментом слабыми нековалентными связями и при определенных условиях легко отделяются от фермента. Обратимые ингибиторы бывают конкурентными и неконкурентными.
Различают два типа обратимого ингибирования фермента: конкурентное и неконкурентное.
Конкурентное ингибирование.
Когда ингибиторы имеют структуру, аналогичную структуре субстрата, то способны связываться с активным центром фермента. В этом случае наблюдается конкуренция между субстратом и ингибитором за связывание с одним и тем же центром,. Такой вид ингибирования называется конкурентным. Конкурентные ингибиторы обратимо связываются с активным центром фермента и конкурируют с субстратом за активный центр. Если активный центр фермента занят ингибитором, то он не способен связывать субстрат и скорость реакции уменьшается.
Конкурентный ингибитор реагирует с ферментом с образованием комплекса фермент-ингибитор. В отличие от фермент-субстратного комплекса
ингибитор не превращается в продукт. Для конкурентного типа ингибирования справедливы уравнения:
E + S ES --> E + P;
E + I EI;
Скорость реакции ингибирования зависит от соотношения ингибитор:субстрат в реакционной среде. При отношении ингибитор:субстрат = 1: 50 степень ингибирования фермента составляет 50%. Увеличение концентрации субстрата при постоянной концентрации ингибитора снижает степень ингибирования. Напротив, понижение концентрации субстрата увеличивает степень ингибирования.
Классическим примером конкурентного ингибирования является действие малоновой кислоты на сукцинатдегидрогеназу.
Сукцинатдегидрогеназа - это фермент из группы ферментов, катализирующих реакции цикла трикарбоновых кислот (цикл Кребса). Этот фермент катализирует отщепление 2-х атомов водорода от 2-х метиленовых углеродов янтарной кислоты (сукцината).
НООС-СН2-СН2-СООН + акцептор 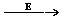 НООС-СН=СН-СООН
НООС-СН=СН-СООН
янтарная кислота |
фумаровая кислота |
Многие соединения, сходные структурно с янтарной кислотой, но не способные дегидрироваться, могут соединяться с ферментом, блокировать его и тормозить протекание нормальной реакции. Такими соединениями могут быть малоновая кислота, глутаровая кислота, щавелевая кислота.
НООС-СООН |
НООС-СН2-СООН |
НООС-СН2-СН2-СН2- |
СООН |
|
|
Щавелевая кислота |
малоновая кислота |
глутаровая кислота |
Из этих трех кислот наиболее мощным ингибитором сукцинатдегидрогеназы является малоновая кислота.
При обратимом ингибировании активность фермента восстанавливается по мере удаления свободного ингибитора из активного центра.
Действие многих лекарственных препаратов основано на конкурентном ингибировании. Например, для лечения некоторых инфекционных заболеваний, вызываемых бактериями, применяют сульфаниламидные препараты – аналоги парааминобензойной кислоты, которую бактериальная клетка использует для синтеза фолиевой кислоты. Благодаря структурному сходству сульфаниламид блокирует действие фермента путем вытеснения парааминобензойной кислоты из активного центра фермента, синтезирующего фолиевую кислоту, что, в конечно итоге, приводит к снижению синтеза нуклеиновых кислот – фактору роста бактерий и вызывает лечебный эффект.
Неконкурентное ингибирование
Если ингибитор по своей структуре не сходен со структурой субстрата и присоединяется к участку, отличному от активного центра, то наблюдается неконкурентное ингибирование. Неконкурентный ингибитор может связываться либо с ферментом, либо с фермент-субстратным комплексом, образуя неактивный комплекс по уравнениям реакций:
Е + I EI ЕS + I ESI
Присоединение неконкурентного ингибитора вызывает изменение конформации молекулы фермента таким образом, что нарушается взаимодействие субстрата с активным центром фермента и снижается скорость ферментативной реакции. Степень неконкурентного ингибирования зависит только от концентрации ингибитора и не зависит от концентрации субстрата, поскольку ингибитор не конкурирует с субстратом за связывание с активным центром фермента и присоединяется к участку, отличному от
центра связывания субстрата. Эффект неконкурентного ингибирования не может быть устранен избытком субстрата, поскольку не влияет на связывание субстрата с ферментом.
Например, синильная кислота связывается с гемовым железом ферментов дыхательной цепи и блокирует клеточное дыхание.
Необратимое ингибирование.
При необратимом ингибировании ингибитор прочно связывается прочными ковалентными связями с функциональными группами фермента, что приводит к безвозвратной потере активности фермента. Чаще всего ингибитор связывается с активным центром фермента, который становится неактивным. Чаще всего необратимое ингибирование вызывают ионы тяжелых металлов (Hg2+, Ag+) и мышьяка (As3+), которые прочно связываются с сульфгидрильными группами (-SH) активного центра фермента. Если концентрации ионов малы, то активность фермента восстанавливается введением веществ, которые более прочно связываются с ними. Вещества, восстанавливающие активность фермента за счет более прочного связывания с ингибитора, называются реактиваторами. При высоких концентрациях токсичных ионов происходит денатурация белковой молекулы фермента с полной потерей активности.
Ингибиторы часто используются для выяснения механизма действия ферментов. С этой целью применяют вещества, блокирующие определенные группы активного центра изучаемого фермента.
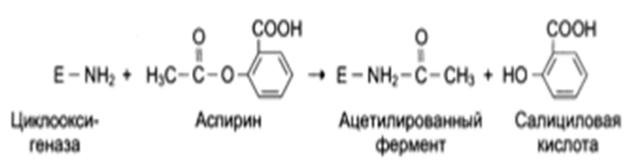
Некоторые лекарственные препараты оказывают свое лечебное действие за счет необратимого ингибирования фермента. Например, аспирин ингибирует фермент циклооксигеназу, катализирующую образование простагландинов из арахидоновой кислоты путем переноса ацетильной группы на активный центр фермента. Уровень простагландинов снижается, а картина воспаления стирается.
Примером необратимого ингибирования может служить инактивация фермента ацетилхолинэстеразы под влиянием ядов нервно-паралитического действия — фосфорорганических соединений.
3. Регуляция скорости ферментативных реакций.
Все биохимические реакций, протекающие в организме, согласованы между собой по месту, времени и интенсивности протекания. Эта согласованность обеспечивается сложными и многообразными механизмами регуляции, к которым относятся:
пространственная локализация ферментов в клетке и ткани;
разнообразные пути превращения субстрата.
изменение скорости ферментативных реакций.
Пространственная локализация ферментов.
Ферменты распределены в клетке и ткани определенным образом. Все ферменты одного метаболического пути находятся в одном отделе клетки. Например, ферменты синтеза высших жирных кислот находятся в цитозоле, а распада – в митохондриях. Ферментный состав клеток различных тканей неодинаков. Например, фермент аргиназа, участвующая в синтезе мочевины, находится только в печени, а ферменты, выполняющие функцию жизнеобеспечения клетки, находятся во всех клетках организма.
Пути превращения субстрата.
Структура метаболических путей разнообразна и может иметь: линейный, разветвленный, циклический, спиральный характер. При линейном пути превращения продукт первой реакции является субстратом другой и так далее до формирования конечного пути.
В роли стадии, определяющей суммарную скорость процесса, часто выступает первая стадия специфического пути биосинтеза соединения
(пусковая стадия).
Регуляция скорости ферментативных реакций осуществляется:
изменением количества молекул фермента (по типу экспрессии гена);
доступностью молекул субстрата и кофермента;
локализацией ферментов в определенном отсеке клетки (компартментализация);
изменением каталитической активности молекулы фермента;
3.1.Регуляция количества молекул фермента в клетке.
Скорость метаболического пути прямо пропорциональна количеству фермента. Некоторые ферменты образуются независимо оттого, в каких условиях находится клетка. Например, ферменты, необходимые для катаболизма глюкозы синтезируются постоянно. Другие ферменты часто синтезируются лишь в следовых количествах. Однако, под действием некоторых сигналов, их синтез изменяется .
Количество фермента можно регулировать изменяя скорость его биосинтеза (регуляция по типу экспрессии гена).
У бактерий обнаружена прямая субстратная регуляция экспрессии генов. Например, при культивировании E.coli в присутствии лактозы образуется ряд ферментов, участвующих в катаболизме этого дисахарида. Гены, кодирующие ферменты деградации лактозы «выключены» белком-репрессором. Репрессор связывается со специфическим участком ДНК и блокирует транскрипцию генов, ответственных за синтез определенных ферментов. Однако индуктор,
связываясь с аллостерическим центром репрессора, вызывает уменьшение сродства репрессора к ДНК и дерепрессию соответствующих генов.
3.2. Регуляция скорости ферментативной реакции доступностью молекул субстрата и коферментов.
Для того, чтобы протекала биохимическая реакция необходимо наличие субстратов метаболического пути, особенно первого. Чем больше концентрация исходного субстрата, тем выше скорость реакции. Например, в цикле Кребса наличие оксалоацетат регулирует скорость процесса. При его недостатке развивается кетоацидоз.
Если исследуемую реакцию катализирует сложный фермент, содержащий кофермент, то необходимо, чтобы в клетке были созданы условия для регенерации данного кофермента. Например, коферментом дегидрогеназы могут быть НАД+, ФАД, ФМН, которые в ходе реакции превращаются в свои восстановленные формы. Чтобы коферменты вновь участвовали в реакции, необходима их регенерация, то есть превращение в окисленную форму.
3.3. Компартментализация.
Компартментализация – это нахождение ферментов и их субстратов в определенном компартменте (отсеке) клетки. Например, ферменты -окисления ВЖК находятся в митхондриях, а субстраты доставляются с помощью челночных механизмов, активность которых регулируется.
Регуляция каталитической активности ферментов.
Основные способы регуляции активности ферментов:
аллостерическая регуляция;
регуляция с помощью белок-белковых взаимодействий;
регуляция путем фосфорилирования/дефосфорилирования;
регуляция частичным (ограниченным протеолизом).
4. Аллостерическая регуляция.
Аллостерическая регуляция имеет большое значение как для процессов синтеза и распада веществ, так и для координации взаимосвязанных метаболических путей. Благодаря этому виду регуляции процессы синтеза и распада в организме человека не протекают параллельно: либо вещество синтезируется, либо катаболизируется.
Аллостерическими ферментами называют ферменты, активность которых регулируется не только количеством молекул субстрата, но и другими низкомолекулярными веществами, называемыми эффекторами.
Эффектор, снижающий активность фермента, называют ингибитором или отрицательным эффектором. А эффектор, повышающий активность фермента – это активатор (положительный эффектор).
Эффекторами могут быть различные промежуточные продукты обмена веществ, называемые м е т а б о л и т а м и. В частности, установлено, что конечный, а иногда и промежуточный продукт многостадийного процесса распада или биосинтеза может служить аллостерическим ингибитором одной из первых его реакций. Этот вид называют гетеротропная регуляция. Значительно реже сам субстрат вызывает активацию фермента (вещество и субстрат и активатор), тогда наблюдается гетеротропная регуляция.
Среди активаторов встречаются самые разнообразные вещества. Особенно часто роль активаторов ферментов выполняют ионы металлов: калия, кальция, магния, цинка, меди, железа, марганца, кобальта, а из анионов - хлора. Для проявления максимальной активности ферментов требуется определнная концентрация ионов-активаторов в среде.
Усиление активности ферментов под действием ионов металлов объясняется тем, что в одних случаях ионы металлов выполняют роль кофактора, в других - облегчают образование фермент-субстратного комплекса, в третьих - способствуют присоединению кофермента к апоферменту, в четвертых обеспечивают становление четвертичной структуры фермента или же действуют иными путями.
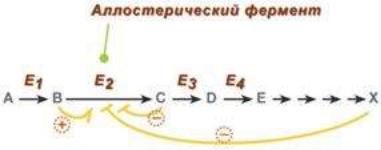
Аллостерические ферменты построены из двух и более субъединиц одни субъединицы содержат каталитический центр, другие имеют аллостерический центр и являются регуляторными. Присоединение эффектора к аллостерической (регуляторной) субъединице изменяет конформацию белка и, соответственно, активность каталитической субъединицы.
Аллостерические ферменты являются олигомерами, содержащими аллостерический центр, удаленный от активного центра фермента. Протомер, содержащий аллостерический центр, называют регуляторным, в отличие от протомера, содержащего каталитический центр –каталитического.
Аллостерические ферменты обладают свойством кооперативности: взаимодействие аллостерического эффектора с аллостерическим центром вызывает последовательное кооперативное изменение конформации всех субъединиц.
Аллостерические ферменты обычно стоят в начале метаболических путей и от их активности зависит течение многих последующих реакций. Поэтому они часто называются ключевыми ферментами.
Когда |
конечный продукт является |
отрицательным регулятором |
фермента, |
то наблюдается ингибирование по типу отрицательной обратной |
|
связи. Реже встречаются метаболические пути, |
в которых одно из исходных |
|
веществ активирует аллостерический фермент и такую регуляцию называют регуляция по типу положительной обратной связи.
5. Белок-белковое взаимодействие.
При данном типе взаимодействия в качестве регулятора выступают не метаболиты биохимических процессов, а специфичные белки.
