
Ферменты как биологические катализаторы
.pdfТема: «Ферменты как биологические катализаторы».
Цель занятия: изучить особые свойства ферментов, связанные с их белковой природой, научиться классифицировать ферменты согласно типу катализируемой реакции и определять тип специфичности действия ферментов.
I. Теоретическая часть.
План.
1.Особенности ферментов как белковых катализаторов.
2.Активный центр фермента: определение, характерстика, свойства.
3.Специфичность действия ферментов: абсолютная, групповая, стереоспецифичность.
4.Номенклатура и классификация ферментов.
5.Строение ферментов: одно-, двухкомпонентные, апофермент, кофактор, простетическая группа, их роль.
6.Механизм действия ферментов.
7.Основы кинетики ферментативных реакций: единицы выражения активности ферментов, зависимость скорости реакции от концентрации фермента.
8.Влияние температуры и рН среды на активность ферментов.
9.Влияние концентрации субстрата на скорость ферментативной реакции. Уравнение Михаэлиса-Ментен.
1.Ферменты участвуют во всех химических процессах, осуществляемых в организме. По определению И.П.Павлова “ферменты есть... возбудители всех химических превращений...”. Ферменты впервые
выделены из живых клеток в 1897 г. германским биохимиком Эдуардом Бухнером (Eduard Buchner 1860 ÷ 1917).
Ферменты (энзимы) - это биологические катализаторы, образующиеся и функционирующие во всех живых организмах. В русской литературе принят
4

термин “ферменты”, а процессы, происходящие с участием этих катализаторов - ферментативные. По химической природе ферменты являются белками.
Ферменты также как и неорганические катализаторы:
катализируют энергетически возможные реакции за счет снижения энергии активации;
не изменяют направление реакции;
ускоряют достижение равновесия, но не сдвигают его;
не расходуются в процессе реакции.
Особые свойства ферментов связаны с их белковой природой - это:
|
высокая эффективность: они могут ускорять реакцию в 108-1012 раз; |
|
|
возможность регуляции их активности |
на генном уровне, условиями |
|
среды, присутствием различных низкомолекулярных веществ; |
|
высокая специфичность по отношению к субстрату и типу катализируемой реакции.
Наибольшая активность ферментов проявляется при физиологических значениях рН, температуре, давлении.
Вещество, превращение которого катализирует фермент, называется субстратом. Субстрат связывается не со всей молекулой фермента, а только с частью, которую назвали активным центом фермента.
2.Активный центр– совокупность аминокислотных остатков,
обеспечивающая |
связывание |
фермента |
с |
молекулой |
субстрата и |
|
осуществляющая |
катализ. |
Он |
образуется |
из |
остатков |
аминокислот, |
находящихся в составе различных участков полипептидной цепи или различных полипептидных цепей, но сближающихся при образовании пространственной структуры белка-фермента. Например, лизоцим – состоит из 129 аминокислотных остатков, из них - 5 остатков аминокислот, занимающих
5
35, 52, 62, 63 и 101 положения, входят в активный центр. Чаще всего в состав активного центра входят остатки полярных аминокислот: серина, гистидина, триптофана, аргинина, цистеина, аспарагиновой кислоты, глутаминовой кислоты и тирозина. Остальные аминокислоты обеспечивают правильную конформацию молекулы фермента для оптимального протекания реакции.
Активный центр обладает следующими особенностями:
является сложной трехмерной структурой и имеет форму узкого углубления или щели, в котором присутствует несколько полярных аминокислотных остатков, необходимых для связывания и катализа.
ориентирует субстраты таким образом, чтобы участвующие в реакции функциональные группы находились в непосредственной близости друг к другу (эффект сближения);
дестабилизирует межатомные связи в молекуле субстрата, что облегчает протекание химической реакции (эффект деформации субстрата)
Свойства активного центра зависят от:
химических свойств аминокислот, входящих в его состав,
их точной взаимной ориентации в пространстве,
условий окружающей среды.
Поэтому любые изменения первичной структуры фермента или условий
среды приводят к изменению структуры активного центра и потере его каталитической активности.
3. Специфичность действия ферментов.
Специфичность, то есть, высокая избирательность действия ферментов, основана на комплементарности структуры субстрата и активного центра фермента. Субстрат должен обладать способностью входить и пространственно совпадать с конформацией активного центра. В зависимости
6
от структуры активного центра фермента различают субстратную и каталитическую специфичности фермента.
Субстратная специфичность – это способность фермента связываться с одним или несколькими субстратами. Выделяют следующие виды субстратной специфичности:
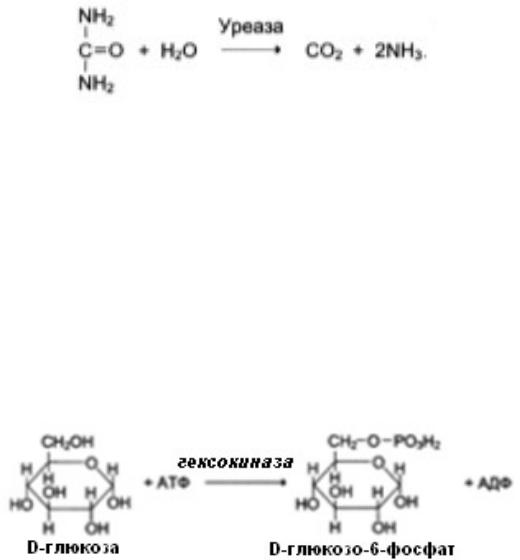
абсолютную специфичность проявляет фермент, когда катализирует превращение только строго определенного вещества. Это происходит в случае комплементарности его активного центра только одному субстрату.
Например, уреаза, катализирующая гидролиз мочевины:
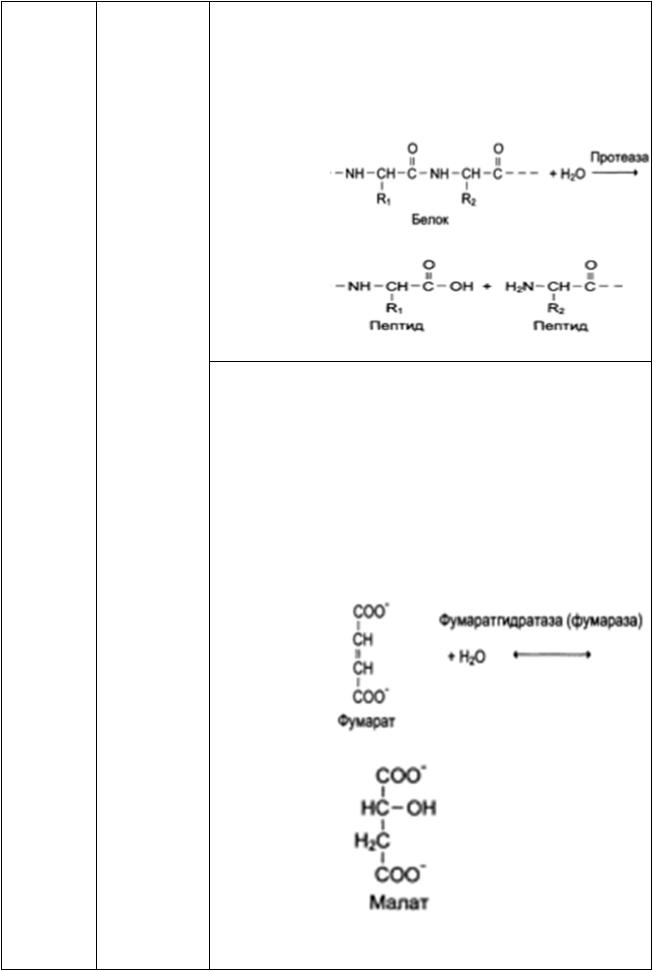
групповая (относительная) специфичность возможна в том случае, когда фермент катализирует превращения группы сходных по структуре веществ. Например, групповой специфичностью обладают протеолитические ферменты, расщепляющие пептидные связи белков.
Стереоспецифичность возможна в том случае, если фермент катализирует
превращение только одного из возможных стереоизомеров. Стереоспецифичность может проявляться по отношению:
к D-сахарам: в организме человека ферменты осуществляют превращение сахаров D-ряда, а не L:
7
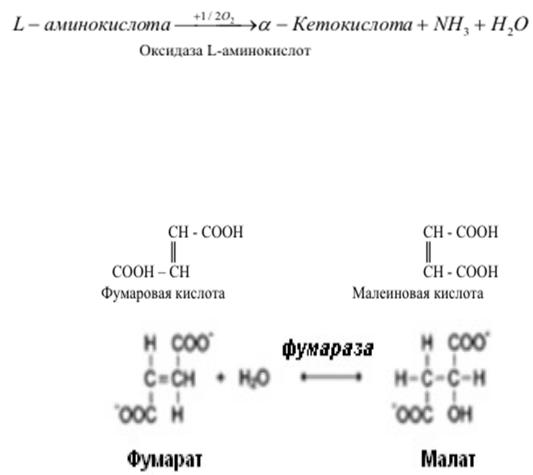
к L-аминокислотам: почти все ферменты человека взаимодействуют с L- аминокислотами;
к цис- и транс-изомерам. Например, фермент фумараза действует только на фумарат (транс-изомер), но не осуществляет катализ малеината (цис изомера):
к - и -гликозидным связям: под действием -амилазы в кишечнике расщепляется гликоген и крахмал, а целлюлоза, содержащая - гликозидные связи не гидролизуется и не может служить источником глюкозы в организме человека.
Каталитическая специфичность - специфичность пути превращения субстрата. Например, пировиноградная кислота может превращаться в лактат под действием лактатдегидрогеназы или ацетил КоА под действием пируватдегидрогеназного комплекса. Эти ферменты имеют различную структуру каталитического центра, поэтому хоть и связываются с одним веществом, но катализируют различные пути превращения пирувата.
8
4. Номенклатура и классификация ферментов.
Любой фермент имеет два названия: рабочее – удобное в использовании и систематическое, применяемое для идентификации фермента.
Рабочее название фермента состоит из названия субстрата, к которому присоединяется окончание (суффикс) «аза». Так, фермент, ускоряющий гидролиз крахмала, получил название амилаза (лат.: amylum - крахмал), гидролиз жиров - липаза (греч.: λίπος - жир) , белков (протеинов)- протеаза и т. п. Однако, для некоторых ферментов сохранилось тривиальное название: пепсин, трипсин.
В1961 году Международный союз по биохимии разработал
систематическую номенклатуру, согласно все ферменты на основании катализируемых реакций разделены на шесть классов, расположенных в следующем порядке: 1) оксидоредуктазы, 2) трансферазы, 3) гидролазы, 4) лиазы, 5) изомеразы, 6) лигазы (синтетазы). Каждый класс подразделяется на подклассы, а каждый подкласс - на подподклассы. Индивидуальный фермент имеет кодовое число (шифр) со стоящими перед ним буквами КФ (англ. ЕС). Шифр каждого фермента содержит четыре числа, разделенных точками. Первое число указывает к какому из шести классов принадлежит данный фермент. Второе число обозначает подкласс. Третье число обозначает подподкласс, а четвертое - порядковый номер фермента в данном подподклассе. Например, фермент КФ.1.1.1.1 имеет рекомендуемое (рабочее) название алкогольдегидрогеназа, систематическое название алкоголь:НАД оксидоредуктаза. Этот фермент относится к классу оксидоредуктаз (1),
действует на СН ОН группу доноров (1.1), акцептором водорода служит НАД (1.1.1); четвертая цифра шифра - порядковый номер фермента в пределах подподкласса.
9
класс |
определение |
подподкласс |
определение, пример |
1.Оксидо |
ускоряют |
дегидрогена |
катализируют реакции |
редуктаз |
окислитель |
зы |
дегидрирования: |
ыновосстановит ельные реакции с участием двух
субстратов |
оксидазы |
катализируют реакции оксиления с |
|
|
|
|
|
участием кислорода как акцептора |
|
|
электронов: |
|
|
оксигеназы |
реакции оксиления с участием |
|
|
(гидроксила |
кислорода, который внедряется в |
|
|
зы) |
субстрат: |
|
|
|
RH+1/2O2 -гидроксилаза->ROH |
2.Трансф |
катализиру |
Аминотранс |
катализируют перенос аминогрупп: |
еразы |
ют перенос |
феразы |
RNH2+R`H<- аминотрансфераза ->RH + |
|
функционал |
|
|
|
|
R`NH2 |
|
|
ьн-ых групп |
|
|
|
|
|
|
|
от одного |
метилтранс |
катализируют перенос метильных |
|
соединения |
феразы |
групп |
|
к другому |
|
RСH3+R`H<- метилтрансфераза ->RH + |
|
|
|
R`СH3 |
 киназы
киназы
10
|
|
|
фосфорной кислоты от АТФ: |
|
|
|
ROH + ATФ –киназа->ROPO3H2+АДФ; |
3.Гидрол |
ускоряют |
протеазы |
гидролиз белков: |
азы |
реакции |
|
|
|
гидролиза |
|
|
|
сложных |
|
|
|
веществ |
|
|
|
фосфатазы |
катализируют гидролиз соединений, |
|
|
содержащих остаток фосфорной |
|
|
кислоты: |
|
|
ROPO3H2+H2O –фосфатаза->ROH + |
|
|
Н3РО4; |
4.Лиазы ускоряют |
декарбокси |
катализирует отщепление СО2: |
негидролит |
лазы |
|
ическое |
|
|
отщепление |
|
|
от |
|
|
субстратов |
|
|
определенн |
|
|
ых групп |
|
|
атомов с |
|
|
образование |
|
|
м двойной |
|
|
связи (или |
|
|
присоединя |
|
|
|
|
11 |

ют группы атомов по двойной связи).
5.Изомер |
катализиру |
изомеразы |
превращение альдоз в кетозы, |
азы |
ют |
|
перемещение двойных связей: |
|
взаимные |
|
глюкоза-6-фосфат <-глюкоизомераза- |
|
превращени |
|
|
|
|
>фруктоза-6-фосфат |
|
|
я изомеров: |
|
|
|
|
|
|
|
|
мутазы |
осуществляют реакции переноса групп |
|
|
|
внутри молекулы: |
|
|
|
глюкоза-6-фосфат <-глюкомутаза- |
|
|
|
>глюкоза-1-фосфат |
6.Лигазы |
катализиру |
синтетазы |
|
(синтетаз |
ют реакции |
|
|
ы) |
присоедине |
|
|
|
ния друг к |
|
|
|
другу двух |
|
|
|
молекул с |
|
|
|
участием |
|
|
|
энергии |
|
|
|
макроэрга. |
|
|
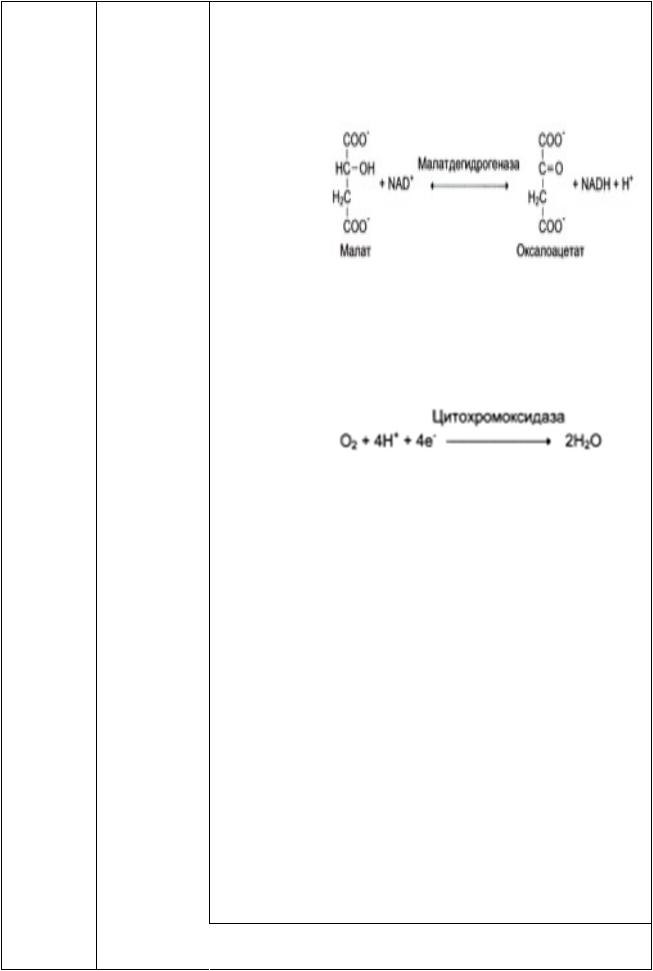
Например, к 1 классу оксидоредуктаз относятся ферменты, катализирующие окислительно-восстановительные реакции. Субстрат, подвергающийся окислению рассматривается как донор водорода.
12
Систематическое название составляется по типу “донор-акцептор - оксидоредуктаза”. В зависимости от природы окисляемых групп в молекуле донора оксидоредуктазы разделили на 19 подклассов. Деление на подподклассы произведено в зависимости от природы акцепторов, которыми могут быть кофермент (НАД или НАДФ), цитохром, молекулярный кислород и т.д.
Если акцептором водорода является любое вещество, кроме кислорода, то такие оксидоредуктазы называют дегидрогеназами Если акцептором служит кислород, то ферменты, катализирующие перенос водорода на него, называют оксидазами. Реакции прямого включения кислорода в молекулу субстрата катализируют оксигеназы; при этом происходит включение либо двух атомов кислорода (диоксигеназы), либо одного атома кислорода (монооксигеназы). Термин пероксидаза относится к ферментам, использующим в качестве окислителя пероксид водорода.
5. Строение фермента.
Ферменты могут иметь как третичную, так и четвертичную структуру. Комплекс нескольких пептидных цепей называют олигомером, а отдельную субъединицу (полипептидную цепь) – протомером.
Подобно белкам ферменты могут быть простыми (однокомпонентными) и сложными (двухкомпонентными). Простые ферменты состоят только из аминокислот и имеют третичную структуру (например: пепсин, трипсин).
Сложные ферменты состоят из белковой и небелковой частей. Их называют холоферментами.
Белковая часть холофермента называется апоферментом, а небелковая часть - кофактором. Кофермент часто называют кофактором или простетической группой в зависимости от прочности его связывания с апоферментом. Кофактор называют:
13
