
БИОХИМИЯ МИОКАРДА. ЛАБОРАТОРНАЯ ДИАГНОСТИКА ЗАБОЛЕВАНИЙ МЫШЦ
.pdfБИОХИМИЯ МИОКАРДА. ЛАБОРАТОРНАЯ ДИАГНОСТИКА ЗАБОЛЕВАНИЙ МЫШЦ.
Вопросы
1.Особенности обмена веществ в миокарде. Энергетические субстраты миокарда и их использование при различных ситуациях. Судьба лактата в скелетных мышцах и в миокарде.
2.Биохимические изменения в миокарде при ишемии.
3.Биохимические основы реперфузионного повреждения миокарда:
кальциевый и кислородный парадокс.
4. Лабораторная диагностика заболеваний скелетных мышц и инфаркта
миокарда.
Особенности метаболизма в миокарде
•Чувствительность к недостатку О2
•В норме аэробный характер гликолиза
•Большой расход АТФ
•Минимальный запас макроэргических соединений
•Различия в потребляемых субстратах для АТФ
•Активный ПФП
Субстраты для получения АТФ в миокарде
•ВЖК
•Глюкоза
•Лактат
•ПВК
•Кетоновые тела (при сахарном диабете и голодании)
Используются в зависимости от :
•энергетических потребностей
•характера питания
•доступности тех или иных субстратов
•состояния миокарда
Использование субстратов для получения АТФ в зависимости от
состояния миокарда
При приеме пищи в абсорбтивный период:
•I – е место глюкоза (аэробный гликолиз)
•II – е место ВЖК (β-окисление)
Впостабсорбтивный период. При выполнении умеренной работы:
•I – е место ВЖК (β-окисление)
•II – е место глюкоза (аэробный гликолиз)
При выполнении тяжелой физической нагрузки (независимо от
приема пищи):
• Лактат – 50%
• ВЖК - 22%
• Глюкоза -17 %
При ишемии глюкоза в процессе анаэробного гликолиза Содержание АТФ и креатинфосфата в сердечной мышце ниже, чем
в скелетной мускулатуре, а расход АТФ велик. В связи с этим ресинтез АТФ в миокарде должен происходить намного интенсивнее, чем в скелетной мускулатуре.
Пути ресинтеза АТФ в скелетных мышцах и миокарде сходны (см выше). Однако регенерация АТФ в процессе анаэробного расщепления
глюкозы в сердце человека практического значения не имеет.

Ишемическая болезнь сердца - патологическое состояние,
характеризующееся абсолютным или относительным нарушением
кровоснабжения миокарда.
Возникает несоответствие между потребностями миокарда в
кислороде и уровнем оксигенации кардиомиоцитов.
В результате возникшего дефицита О2 в клетках сердечной мышцы нарушаются энергообразование, а также другие метаболические процессы, что приводит: к изменению сократительной функции миокарда в зоне ишемии и появлению болевого синдрома (стенокардии).
Инфаркт миокарда – это ограниченный некроз сердечной мышцы
вследствие острого несоответствия коронарного кровотока
потребностям миокарда.
Биохимические нарушения метаболизма в миокарде
при ишемии
• Гипоксия
•Снижение: активности ферментов аэробного дыхания,
синтеза клеточных структур, транспорта субстратов, обмена веществ и катионов
•Перестройка изоферментного спектра
•Изменение ионного равновесия
•Накопление лактата, неокисленных жирных кислот
•Ацидоз
•Снижение количества гликогена и глюкозы
•Активация СРО и накопление токсичных продуктов ПОЛ
•Повреждение клеточных структур, некроз
При ишемии миокарда характерны сниженние окислительное фосфорилирования и повышение анаэробного обмена.
Раннее увеличение гликогенолиза и анаэробного гликолиза за счет имеющегося в сердечной мышце гликогена и глюкозы в начальной стадии ишемии происходит в результате повышения внутриклеточной концентрации катехоламинов и цАМФ, что в свою очередь стимулирует образование активной формы гликогенфосфорилазы и активацию фосфофруктокиназы —ключевого фермента гликолиза.
Однако даже максимально усиленный анаэробный метаболизм не способен длительно защищать уже поврежденный гипоксический миокард. Очень скоро запасы гликогена истощаются, гликолиз замедляется вследствие внутриклеточного ацидоза (за счет накопления лактата), который ингибирует фосфофруктокиназу.
Содержание АТФ и креатинфосфата в клетке резко снижается в результате нарушения окислительного фосфорилирования в митохондриях.
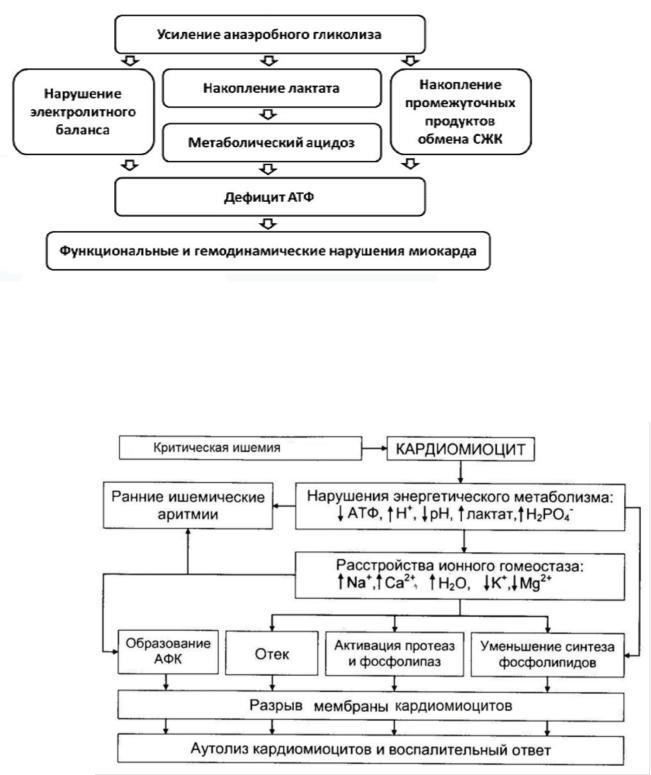
При продолжительной ишемии эти изменения ведут к еще большему нарушению мембранной проницаемости и целостности мембран, что способствует выходу из клетки ионов, в том числе ионов К+ и ферментов.
•
Дефицит энергетических ресурсов и нарушение ионного
состава, существенные изменения различных мембранных
«резервуаров», обеспечивающих контроль за уровнем внутриклеточного
кальция, обусловливают торможение функциональной активности
мышечных клеток и их постепенную гибель.
В этот же период выявляются изменения состава белков миокарда
(резкое снижение содержания миофибриллярных белков и накопление
белков стромы).
Биохимические основы реперфузионного повреждения миокарда:
кальциевый и кислородный парадокс.
Восстановление коронарной перфузии часто бывает недостаточно для полной нормализации сократимости сердца. Более того, в некоторых случаях реперфузия сердца может провоцировать гибель пациентов от желудочковой фибрилляции.
Оказалось, что восстановление коронарного кровотока даже после непродолжительной ишемии может вызвать реперфузионное повреждение сердца, для которого характерны следующие проявления:
•сократительная дисфункция сердца
•нарушения сердечного ритма
•феномен невосстановленного кровотока.
Основными механизмами реперфузионного повреждения миокарда
являются так называемые кальциевый парадокс и кислородный парадокс.
Кальциевый парадокс - это перегрузка кардиомиоцитов ионами кальция. Ионы кальция в избытке проникают через сарколемму кардиомиоцитов, накапливаясь в саркоплазматическом ретикулуме и митохондриях.
Механизм усиленного проникновения Са2+ через клеточную мембрану тесно связан с нарушением Na+/ Са2+ обмена. Если в норме основное поступление Са2+ в клетку происходит через медленные Са2+-каналы, то в условиях реперфузии резко активируется Na+/Са2+-транспорт (обмен внутриклеточного Na+ на внеклеточный Са2+), который осуществляется белком-переносчиком, расположенным на сарколемме.
Схема перегрузки миокардиоцитов кальцием
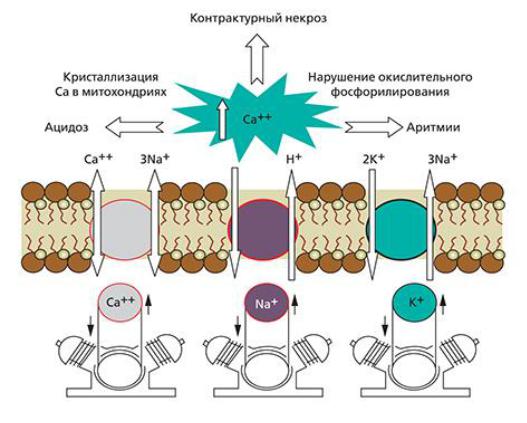
Кальциевая перегрузка кардиомиоцитов ведет к замедлению процесса расслабления сердца (реперфузионная контрактура), что неизбежно сопровождается уменьшением диастолического объема сердца и снижением сердечного выброса.
Патогенез подобной сократительной дисфункции связан не только с замедлением релаксации кардиомиоцитов, но и с энергодефицитом, который вызван тем, что большая часть энергии, образующейся в митохондриях,
расходуется на аккумуляцию Са2+ во внутриклеточных органеллах.
Кислородный парадокс — это токсическое действие кислорода,
которое испытывает миокард в момент реоксигенации после ишемии. Дефицит кислорода приводит к восстановлению переносчиков электронов (НАДН-
дегидрогеназ, убихинон, цитохромы) в дыхательной цепи митохондрий. В
момент реоксигенации эти переносчики становятся донорами электронов для молекул кислорода. Последние при этом превращаются в свободные радикалы
(активные формы кислорода).
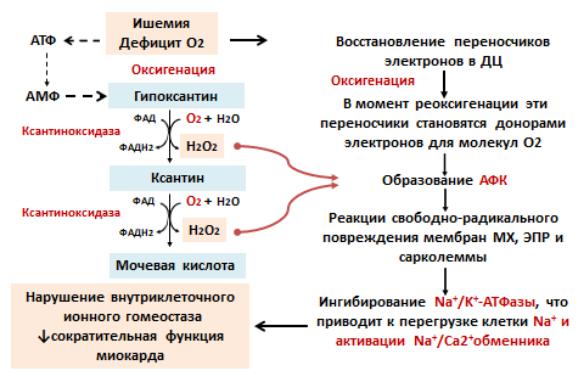
Генерация основного избытка продукция активных форм кислорода,
повреждающих ткани, наступает при реперфузии, когда под действием ксантиноксидазы кислород преобразует гипоксантин в ксантин и мочевую кислоту
Активные формы кислорода повреждают молекулы ферментов,
осуществляющих энергозависимый транспорт ионов в кардиомиоцитах. В
результате происходит нарушение внутриклеточного ионного гомеостаза,
развивается перегрузка кардиомиоцитов Са2+ и, как следствие, страдает сократительная функция сердца.
Лабораторная диагностика инфаркта миокарда
Неферментативная
МyоНb, ТnT, ТnTI, БОФВ
Ферментативная (энзимодиагностика)
ЛДГ1 КК2 (МВ) АсАТ
Наиболее высокоспецифичны для острого инфаркта миокарда
—тропонины и КК(МВ).
Время первого повышения маркеров при остром инфаркте миокарда: для миоглобина и сБСЖК — 1–3 часа, для КК(МВ) и сТнТ —
3–4 часа, для сТнI — 4–6 часов.
Миоглобин при остром инфаркте миокарда
Миоглобин - одно из ключевых соединений, определяющих интенсивность окислительного метаболизма в скелетной мышце и особенно в миокарде.
Этот белок выступает как депо кислорода в мышцах:
депонирование происходит в период покоя, расход — в момент сокращения. Емкость этого депо невелика — при ишемии миокарда адекватное снабжение мышцы кислородом осуществляется лишь в течение 15–20 секунд.
Миоглобин локализуется в различных участках миоцитов.
Благодаря мобильности, малой массе МГ быстро выходит из миоцита при его повреждении, попадает в кровь, а затем в мочу.
В норме уровень МГ в крови не более 100 нг/мл, в моче не более 4
нг/мл. При остром инфаркте миокарда наблюдается повышение МГ в крови через 2–4 часа после появления боли, степень повышения зависит от площади поражения.
Является самым “короткоживущим”маркером инфаркта —
быстро выводится с мочой, примерно за 24 часа. Повторное нарастание
уровня МГ говорит о новых очагах некроза.
Тропонин Т и I при остром инфаркте миокарда
В кардиомиоцитах, как и в скелетной мышце, содержатся тропонины — ТнI, ТнT, ТнC в соотношении 1:1:1 — в составе тропонинового комплекса, связанного с белком тропомиозином. Все три тропонина участвуют в кальцийзависимой регуляции акта сокращения— расслабления.

ТнI и ТнТ существуют в 3 изоформах, уникальных по структуре для каждого типа поперечнополосатых мышц (быстрых, медленных и сердечных).
В диагностике острого инфаркта миокарда используют сердечные изоформы — сТнI и сТнТ, выявляя их в крови методом иммуно ферментного анализа с помощью моноклональных антител.
Оба маркера могут быть обнаружены через 3–6 часов после начала боли в груди, достигая пикового уровня в течение 12–36 часов.
Повышенная концентрация сердечных тропонинов может наблюдаться более недели после начала инфаркта. Считаются наиболее специфическими маркерами острого инфаркта миокарда.
В экстренных ситуациях, на догоспитальном этапе без предварительной подготовки,
врачами бригады скорой помощи используется экспресс-
диагностика тропониновыми тест-
полосками.
Современные биомаркеры инфаркта миокарда и
хронической сердечной недостаточости
•Гомоцистеин (ГЦ) — независимый фактор риска
•ST2 — маркер сердечной недостаточности
•Натрийуретические пептиды сердца
•Сердечный белок, связывающий жирные кислоты (cБСЖК, HDFABP)
Гомоцистеин (ГЦ) - независимый фактор риска заболеваний
коронарных, |
церебральных |
и |
периферических |
артерий. |
Гипергомоцистеинемия (ГГЦ) - накопление гомоцистеина в крови из-за
