
Обмен нуклеотидов, нуклеозидов и азотистых оснований
.pdf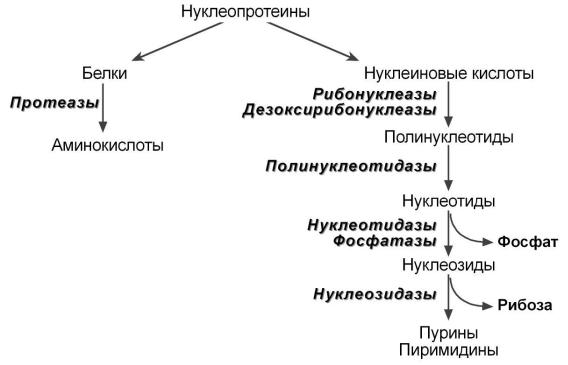
Белки перевариваются обычным порядком, нуклеиновые кислоты с помощью дополнительных ферментов.
Панкреатический сок содержит рибонуклеазы и дезоксирибонуклеазы,
гидролизующие нуклеиновые кислоты до полинуклеотидов.
Схема переваривания нуклеопротеинов
После действия панкреатических нуклеаз полинуклеотидазы (или фосфодиэстеразы) кишечника гидролизуют нуклеиновые кислоты до мононуклеотидов. Далее, под действием нуклеотидаз и фосфатаз
происходит гидролиз нуклеотидов до нуклеозидов, которые либо всасываются, либо под действием нуклеозидаз слизистой кишечника деградируют до пуриновых и пиримидиновых оснований.
В просвете кишечника пуриновые основания могут подвергаться окислению до мочевой кислоты, которая всасывается и затем выделяется с мочой. Большая часть тех пуринов, что всосались, в энтероцитах также окисляется в мочевую кислоту, при этом не происходит их перехода в кровь,
в другие клетки и во вновь образующиеся молекулы нуклеотидов и нуклеиновых кислот.

Как и пурины, свободные пиримидины в основном катаболизируют и
выделяются без их использования в организме.
Таким образом, нуклеиновые кислоты и/или отдельные
полинуклеотиды пищевых продуктов не поступают из кишечника в кровоток и не выступают в роли поставщика непосредственных предшественников ДНК и РНК клеток организма. И хотя млекопитающие потребляют значительные количества нуклеиновых кислот и нуклеотидов, их жизнедеятельность и генотип не зависят от всасывания этих веществ или соответствующих продуктов распада.
Синтез пуриновых нуклеотидов
Синтез пуриновых оснований происходит во всех клетках организма,
главным образом в печени. Исключение составляют эритроциты,
полиморфноядерные лейкоциты, лимфоциты.
Центральное место в синтезе пуриновых и пиримидиновых нуклеотидов занимает фосфорибозилдифосфат (ФРДФ) или фосфорибозилпирофосфат, который образуется из рибозо-5-фосфата и АТФ в реакции, катализируемой ФРДФ-синтетазой:
Источниками рибозо-5-фосфата могут быть пентозофосфатный путь превращения глюкозы или пентозы, образующиеся в тканях при распаде нуклеиновых кислот и нуклеотидов.
Биосинтез пуриновых нуклеотидов происходит путем сборки пуринового гетероциклического основания на остатке рибозо-5-фосфата при участии простых предшественников: глицина, СО2, амидного азота
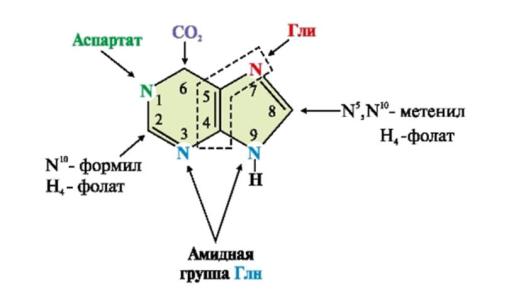
глутамина, α-аминогруппы аспартата и одноуглеродных производных Н4-
фолата. Сначала формируется 5-членное кольцо, а затем - 6-членное с образованием первого пуринового нуклеотида - инозинмонофосфата (ИМФ).
Источником всех 4 атомов азота пурина являются аминокислоты: два атома поступают из Глн, один - из Асп и еще один - из Гли. Два из пяти углеродных атомов принадлежат Гли, два других - производным Н4-фолата и пятый - из СО2.
Рис.5 Происхождение атомов С и N в пуриновом основании
Скорость-лимитирующей и регуляторной стадией процесса является
образование 5-фосфорибозил-1-амина, которую катализирует
амидофосфорибозилтрансфераза
В ходе этой реакции амидная группа Глн переносится на ФРДФ,
замещая пирофосфатный остаток. Синтез первого пуринового нуклеотида -
ИМФ включает 10 стадий и идет с затратой 6 моль АТФ. Все реакции протекают в цитозоле клетки. Остальные пуриновые нуклеотиды - АМФ и ГМФ - образуются из ИМФ в каждом случае в ходе двух последовательных реакций.
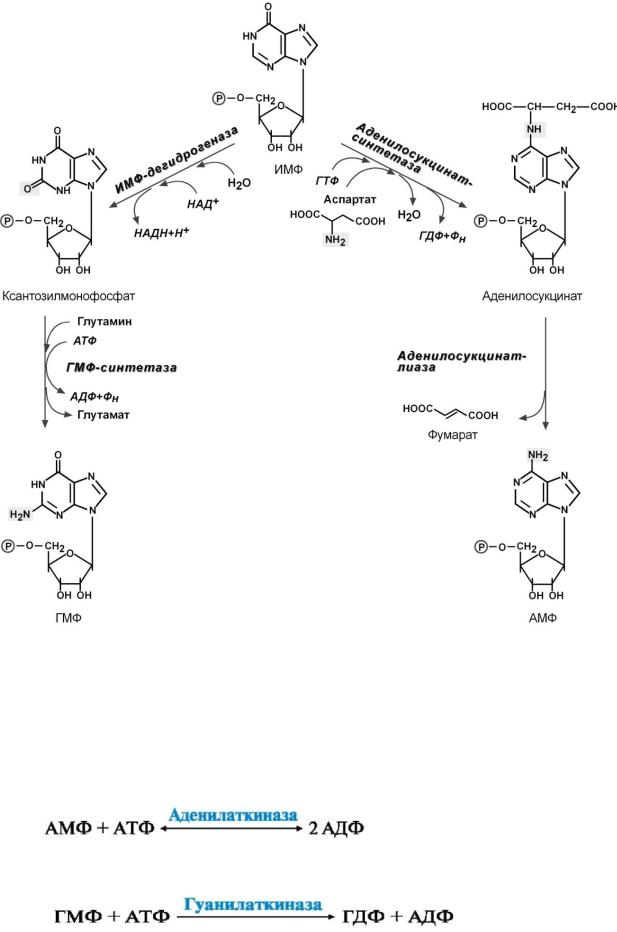
Рис.6 Синтез АМФ и ГМФ Нуклеозидди- и трифосфаты синтезуются при участии АТФ и
ферментов нуклеозидмонофосфаткиназ (НМФ-киназ) и
нуклеозиддифосфаткиназ (НДФ-киназ). Так, АДФ образуется в реакции,
катализируемой аденилаткиназой:
ГДФ - в реакции, которую катализирует гуанилаткиназа

НДФ-киназа осуществляет синтез НТФ, в частности превращает ГДФ в
ГТФ:
Образование АТФ из АДФ в основном происходит за счет окислительного фосфорилирования или частично в реакциях субстратного фосфорилирования гликолиза, цитратного цикла, в процессе использования креатинфосфата в мышцах.
Аллостерическая регуляция синтеза пуриновых нуклеотидов
Регуляторными ферментами являются: ФРДФ-синтетаза,
амидофосфорибозилтрансфераза, ИМФ-дегидрогеназа,
аденилосукцинатсинтетаза.
Регуляция синтеза пуринов происходит по механизму обратной отрицательной связи, т.е. продукт реакции (или совокупности реакций)
ингибирует начальные этапы процесса. Для синтеза пуринов такими ингибиторами являются АМФ и ГМФ. ГМФ блокирует первые две реакции синтеза ИМФ, а также ИМФ-дегидрогеназную реакцию. АМФ блокирует первую реакцию синтеза ИМФ и аденилосукцинатсинтетазную реакцию.
Кроме этого, имеется положительная перекрестная регуляция со стороны АТФ и ГТФ, а именно – как участник реакций каждый из них оказывает стимулирующее влияние на синтез другого нуклеотида. Это заключается в том, что АТФ, принимая участие в ГМФ-синтетазной реакции,
облегчает синтез ГМФ; в свою очередь, ГТФ является донором энергии для синтеза АМФ, участвуя в аденилосукцинат-синтетазной
реакции. Пиримидиновый нуклеотид тимидиндифосфат (ТДФ) также блокирует фермент ФРДФ-синтетазу, что снижает синтез ФРДФ, который используется при синтезе пуринов и пиримидинов.
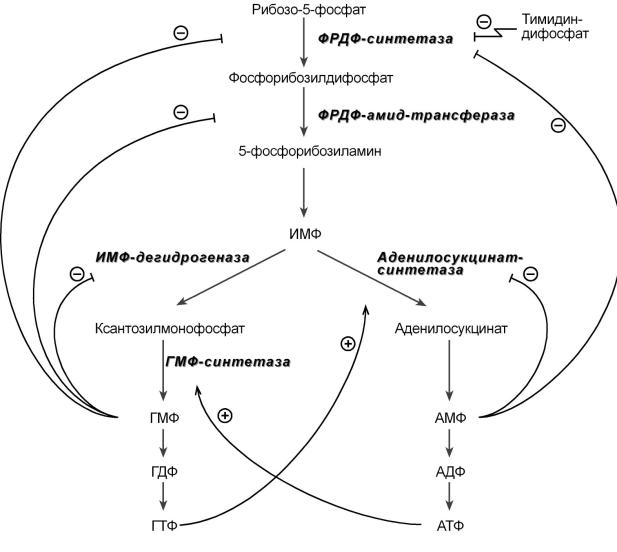
Рис.7 Регуляция синтеза пуриновых нуклеотидов
 Особенности синтеза пуриновых нуклеотидов
Особенности синтеза пуриновых нуклеотидов
• Пуриновое кольцо строится на рибозе (т.е.
рибоза присутствует в структуре всех промежуточных веществ
метаболического пути)
•Пуриновое кольцо строится постепенным добавлением новых атомов в строго определенном порядке
•Инозинмонофосфат (ИМФ) – предшественник всех пуринов, первый пуриновый нуклеотид (хотя он не встречается в ДНК и почти не встречается
вРНК, минорный нуклеотид)
•АМФ и ГМФ образуются из ИМФ
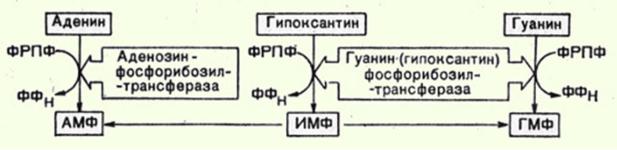
Запасные пути синтеза пуриновых нуклеотидов или
реутилизация пуриновых оснований
В периоды активного роста тканей синтез пуриновых нуклеотидов из простых предшественников не способен полностью обеспечить нуклеиновые кислоты субстратами. Заметную роль в этих условиях играют ферменты запасных путей синтеза или путей спасения нуклеотидов.
Активация «запасных путей» происходит в быстрорастущих тканях
(эмбриональная, регенерирующая, опухолевая), когда активно идет процесс синтеза нуклеиновых кислот и недопустима потеря их предшественников:
•в детском возрасте
•при онкогенезе
•при регенерации тканей
Функция: использовать уже синтезированные азотистые основания и
нуклеозиды
Сущность реутилизации заключается в присоединении к аденину,
гуанину или гипоксантину рибозо-5-фосфата и образовании АМФ, ГМФ или ИМФ. Эту реакцию осуществляют соответствующие трансферазы. Наиболее характерным примером является реутилизация гипоксантина и гуанина под влиянием фермента гипоксантин-гуанин-фосфорибозилтрансферазы. В
качестве источника рибозo-5-фосфата используется фосфорибозилдифосфат.
Рис.8 Запасные пути синтеза пуриновых нуклеотидов
Катаболизм пуриновых нуклеотидов
Наиболее активно катаболизм пуринов идет в печени, тонком кишечнике (пищевые пурины) и почках.
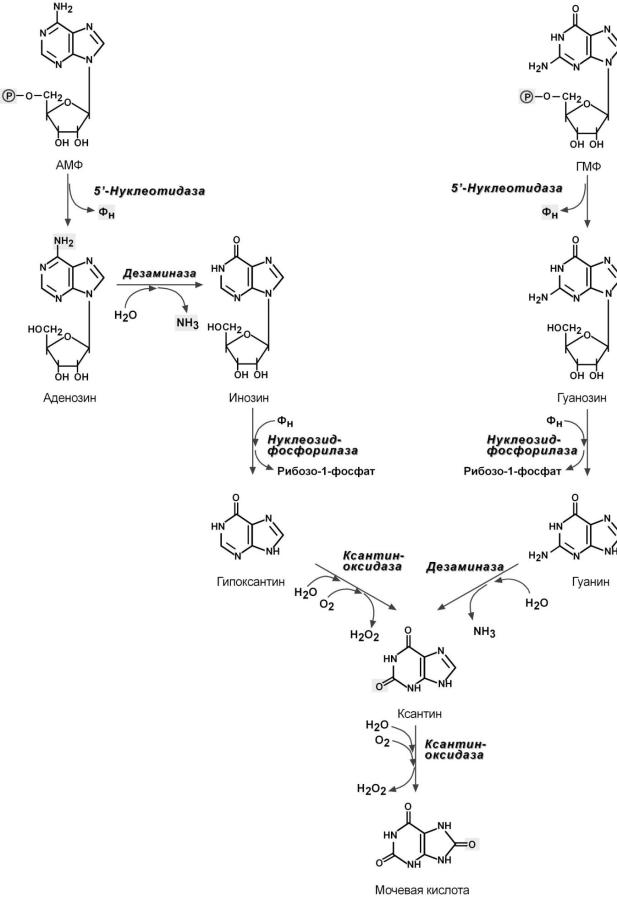
Рис.9 Распад пуриновых нуклеотидов
Катаболизм пуриновых нуклеотидов у человека заканчивается образованием мочевой кислоты. Первоначально нуклеотиды дефосфорилируются в реакциях, катализируемых фосфатазами или нуклеотидазами. Аденозиндезаминируется аденозиндезаминазой с образованием инозина, а затем пуриннуклеозидфосфорилаза расщепляет нуклеозиды до свободных оснований и рибозо- 1-фосфата. Ксантиноксидаза,
используя молекулярный О2, окисляет пуриновые основания в мочевую кислоту. Фермент представляет собой аэробную оксидоредуктазу,
простетическая группа которой включает ионы железа (Fe3+), молибдена и
FAD.
Мочевая кислота образуется главным образом в печени и кишечнике, а
удаляется из организма с мочой и в небольшом количестве через кишечник.
Она является слабой кислотой и в биологических жидкостях находится в недиссоциированной форме в комплексе с белками или в виде мононатриевой соли - урата.
В норме в сыворотке крови ее содержание составляет 0,15-0,47
ммоль/л. Из организма в сутки выводится от 0,4 до 0,6 г мочевой кислоты и
уратов.
Нарушения обмена пуриновых нуклеотидов
Гиперурикемия
Возникает у пациентов, когда концентрация мочевой кислоты в плазме крови превышает норму. Она является причиной развития подагры -
заболевания, при котором кристаллы мочевой кислоты и уратов откладываются в суставных хрящах, связках и мягких тканях с образованием подагрических узлов или тофусов, вызывая воспаление суставов и нефропатию.
Подагра - довольно частое заболевание, ею страдает от 0,3 до 1,7 %
населения. У мужчин сывороточный фонд уратов в 2 раза выше, чем у женщин, поэтому мужчины болеют подагрой в 20 раз чаще, чем женщины.
Заболевание генетически детерминировано и чаще всего вызывается:
•дефектами ФРДФ-синтетазы, сопровождающимися гиперактивацией либо устойчивостью фермента к ингибированию конечными продуктами синтеза
•частичной потерей активности гипоксантин-
гуанинфосфорибозилтрансферазы, уменьшающей повторное использование пуринов
При полной потере активности гипоксантин-
гуанинфосфорибозилтрансферазы развивается тяжелая форма гиперурикемии
- синдром Леша-Нихана, при котором наблюдаются неврологические и психические отклонения. Болезнь наследуется как рецессивный признак,
сцепленный с Х-хромосомой, и встречается только у мальчиков.
Лечение подагры - аллопуринолом (аллопур, милурит, апурин) -
структурным аналогом гипоксантина. Ксантиноксидаза окисляет препарат в оксипуринол, который прочно связывается с активным центром фермента и останавливает катаболизм пуринов на стадии гипоксантина, который в 10 раз лучше растворяется в жидкостях организма, чем мочевая кислота
Биосинтез пиримидиновых нуклеотидов
В отличие от синтеза пуриновых нуклеотидов, при котором азотистое основание формируется на остатке рибозо-5-фосфата, пиримидиновое кольцо первоначально собирается из простых предшественников - глутамина,
аспартата и СО2 и только затем взаимодействует с ФРДФ с образованием уридин-5'-монофосфата (УМФ).
Синтез УМФ протекает в цитозоле клеток и включает 6 стадий.
На первой стадии идет синтез карбамоилфосфата из Глн и СО2 с
использованием 2 молекул АТФ, последующее присоединение Асп и отщепление Н2О сопровождается образованием циклического производного – дигидрооротата.
