
- •Определение биологии как науки. Предмет и методы биологии. Значение достижений фундаментальной биологии - геномики, протеомики, метаболомики для медицины на современном этапе.
- •Основными частными методами в биологии являются:
- •Определение жизни. Фундаментальные свойства живого. Эволюционно-обусловленные уровни организации живого.
- •Клетка как открытая система. Поток информации, энергии и вещества в клетке. Роль внутриклеточных структур в энергетическом и пластическом обмене.
- •Клеточный цикл, его периодизация. Митотический цикл, его механизмы регуляция. Апоптоз и некроз, их значение в медицине
- •Химическая организация генетического материала. Структура днк и рнк. Виды рнк. Уровни компактизации генетического материала и их роль в регуляции функций хромосом.
- •Функции нуклеиновых кислот в процессе реализации наследственной информации. Кодирование наследственной информации в клетке. Генетический код и его свойства.
- •Днк является носителем генетической информации. Функция обеспечивается фактом существования генетического кода.
- •Воспроизведение и передача генетической информации в поколениях клеток и организмов. Функция обеспечивается процессом репликации.
- •Реализация генетической информации в виде белков, а также любых других соединений, образующихся с помощью белков-ферментов. Функция обеспечивается процессами транскрипции и трансляции.
- •Генетический код
- •Этапы реализации генетической информации: Роль транскрипционных, посттранскрипционных и посттрансляционных модификаций в регуляции клеточного обмена. Примеры.
- •Реакции матричного синтеза. Принципы и этапы репликации днк. Последствия нарушения нормального хода репликации днк.
- •Особенности организации генома эукариот. Регуляция экспрессии эукариотических генов.
- •Множественные аллели как результат изменения нуклеотидной последовательности гена. Полиморфизм гена как вариант нормы и патологии. Примеры.
- •Ген, его свойства: дискретность, стабильность, лабильность, полиаллелизм, специфичность, плейотропия. Примеры.
- •Фенотип как результат реализации генотипа в конкретных условиях среды. Среда первого, второго (а и б) и третьего порядка. Экспрессивность и пенетрантность гена.
- •Определение пола. Типы определения пола: прогамный, эпигамный, сингамный. Роль генотипа и среды в развитии признаков пола. Хромосомный механизм определения пола у разных организмов.
- •Типы определения пола:
- •Хромосомный механизм определения пола у разных организмов
- •Пример записи цис- и транс- положения:
- •Связь мутаций с репарацией днк.
- •Дополнение:
- •Изменчивость, её формы. Модификационная изменчивость; адаптивный характер модификаций. Норма реакции генетически детерминированных признаков. Морфозы и фенокопии. Примеры.
- •Мутационная изменчивость. Классификация мутаций (общие принципы). Соматические и генеративные мутации.
- •Хромосомные мутации, их классификация: делеции, дупликации, инверсии, транслокации. Причины и механизмы возникновения. Значение в развитии патологических состояний человека.
- •Геномные мутации: классификация, причины, механизмы возникновения хромосомных синдромов на примере синдрома Дауна.
- •Биохимический метод изучения генетики человека; его значение для диагностики наследственных болезней обмена веществ.
- •Генеалогический метод генетики человека. Основные правила составления и последующего анализа родословных схем. Значение метода в изучении закономерностей наследования признаков.
- •Методы генетики человека: популяционно–статистический; дерматоглифический, генетики соматических клеток, изучения днк; их роль в изучении наследственной патологии человека.
- •Понятие наследственных болезней: моногенные, хромосомные и мультифакториальные болезни человека, механизмы их возникновения и проявления. Примеры.
- •Понятие о болезнях с нетрадиционным наследованием (митохондриальные, болезни импритинга, болезни экспансии тринуклеотидных повторов). Примеры. Общие подходы к лечению наследственных болезней.
- •Медико-генетическое консультирование, его медицинское значение. Виды и этапы консультирования. Методы пренатальной диагностики (инвазивные, неинвазивные) и их возможности.
- •2 Вида мгк:
- •Онтогенез как процесс реализации наследственной информации в определённых условиях среды. Периодизация онтогенеза. Типы онтогенеза как варианты приспособления к условиям существования. Примеры.
- •Прогенез и его роль в онтогенезе. Оплодотворение – начальный этап развития нового организма. Фазы оплодотворения. Биологическая сущность.
- •Биологическая сущность оплодотворения.
- •Характеристика и значение основных этапов эмбрионального развития. Зависимость типы дробления зиготы от строения яйцеклетки. Способы гаструляции. Первичный (нейрула) и вторичные органогенезы.
- •Дробление.
- •Зависимость типы дробления зиготы от строения яйцеклетки.
- •Биологическое значение дробления:
- •Гаструляция.
- •Органогенез.
- •Понятие провизорных органов хордовых. Особенности развития этих органов в группе Anamnia и Amniota. Типы плацент. Нарушение процессов развития и редукции зародышевых оболочек у человека.
- •Постэмбриональный период онтогенеза, его периодизация у человека. Основные процессы: рост, формирование дефинитивных структур, половое созревание, репродукция.
- •Клеточная дифференцировка; генетические и негенетические механизмы; стадии. Опыты д. Гердона по доказательству равных генетических потенций ядер соматических клеток.
- •Целостность онтогенеза. Эмбриональная индукция и эмбриональная регуляция. Концепции морфогенеза (физиологических градиентов, позиционной информации, морфогенетических полей).
- •Влияние факторов среды на онтогенез. Критические периоды в онтогенезе человека. Тератогенез и канцерогенез. Значение нарушений частных и интегративных механизмов онтогенеза в формировании впр.
- •Врождённые аномалии и пороки развития. Определение, классификация, механизмы возникновения: гаметопатии, бластотопатии,эмбриопатии и фетопатии, механизмы и причины их возникновения. Примеры.
- •Генофонд популяции; генетическая гетерогенность; генетическое единство, динамическое равновесие. Частоты аллелей и генотипов. Закон Харди-Вайнберга.
- •Популяционная структура человечества. Демографическая характеристика. Особенность действия элементарных эволюционных факторов (мутаций, миграций) в человеческих популяциях.
- •Специфика действия естественного отбора и изоляции в генетических популяциях. Демы. Изоляты. Дрейф генов. Особенности генофондов изолятов.
- •Особенности генофондов малочисленных популяций:
- •Общие закономерности в эволюции органов и систем. Основные принципы эволюционного преобразования органов и функций: дифференциация и интеграция; модусы преобразования органов и функций. Примеры.
- •Филогенез покровов тела и опорно – двигательной системы хордовых животных. Онтофилогенетические пороки. Примеры.(стр. 86-106)
- •Сравнительная характеристика покровов тела хордовых
- •Эволюционные преобразования и модусы покровов у хордовых животных:
- •Смена функций:
- •Онтофилогенетические пороки и аномалии развития покровов тела человека:
- •Сравнительная характеристика опорно-двигательной системы позвоночных животных
- •Онтофилогенетические пороки и аномалии развития пищеварительной системы:
- •Сравнительная характеристика дыхательной системы хордовых животных
- •Онтофилогенетические пороки и аномалии развития дыхательной системы:
- •Филогенез кровеносной системы хордовых животных. Онтофилогенетические пороки сердца и кровеносных сосудов. Примеры. (115-125)
- •Cравнительная характеристика кровеносной системы хордовых животных
- •Онтофилогенетические пороки и аномалии развития кровеносной системы:
- •Филогенез мочеполовой системы позвоночных. Эволюция нефрона и мочеполовых протоков. Онтофилогенетические пороки. Примеры.(стр. 125-131)
- •Сравнительная характеристика выделительной системы хордовых
- •Онтофилогенетические пороки и аномалии развития выделительной системы:
- •Основные направления эволюции и модусы половой системы:
- •Онтофилогенетические пороки и аномалии развития половой системы:
- •Филогенез эндокринной и нервной систем хордовых животных. Онтофилогенетические пороки. Примеры.
- •Онтофилогенетические врождённые пороки систем органов человека. Классификация; их место и значение в развитии патологии у человека. Примеры.
- •Каждая большая раса подразделяется намалые расы, или антропологические типы.
- •Предмет, структура и методы экологии. Эндоэкология, аутэкология. Аутэкологические понятия и законы: реакция организма, адаптация
- •Пути адаптации организма к окружающей среде:
- •Принято выделять три механизма адаптаций:
- •Предмет и содержание экологии человека, ее связь с науками о здоровье человека, основные этапы развития. Антропоэкосистема, ее структура и основные характеристики.
- •Медико-демографические признаки:
- •Влияние окружающей среды на заболевания.
- •Влияние климато-метеорологических факторов на здоровье человека. Макрогеографические подтипы и локальные варианты популяционного здоровья. Адаптация и акклиматизация. Примеры.
- •Влияние факторов гидросферы на здоровье человека. Факторы воды, вызывающие заболевания человека. Основные источники антропогенного загрязнения водоемов.
- •Промышленные стоки.
- •Бытовые стоки.
- •Бытовой мусор.
- •Сельское хозяйство.
- •Биологические ритмы в природе, их характеристика и роль в формировании адаптационных реакций человека. Хронобиологические основы здоровья человека. Основы хронодиагностики и хрономедицины.
- •По длине периода
- •По источнику происхождения
- •Паразитарные природно-очаговые трансмиссивные и нетрансмиссивные болезни, их критерии. Учение е.Н. Павловского о природной очаговости заболеваний. Структура природного очага.
- •Учение Павловского.
- •Структура природного очага.
- •Пути и способы заражения паразитарными болезнями: алиментарный, геооральный, инокулятивный, контаминативный, контактный, аспирационный, гемический. Примеры.
- •Морфологическая характеристика:
- •Жизненный цикл:
- •Патогенное действие:
- •Диагностика:
- •Профилактика:
- •Клиника:
- •Лабораторная диагностика:
- •Профилактика:
- •Систематика, морфология и биология возбудителей лейшманиозов, трипаносомозов, лямблиоза, трихомоноза. Обоснование лабораторной диагностики и профилактики.
- •Морфология паразита:
- •Хозяева:
- •Локализация:
- •Патогенез. Клиника:
- •Лабораторная диагностика:
- •Профилактика:
- •Урогенитальная трихомонада (Trichomonas vaginalis).
- •Циклразвития.
- •Медицинское значение:
- •Морфология паразита:
- •Жизненный цикл:
- •Хозяева:
- •Лабораторная диагностика:
- •Профилактика:
- •Морфология паразита:
- •Хозяева:
- •Локализация:
- •Патогенез. Клиника:
- •Лабораторная диагностика:
- •Профилактика:
- •Урогенитальная трихомонада (Trichomonas vaginalis). Тип: Mastigophora.
- •Клиника:
- •Лабораторная диагностика:
- •Циклразвития.
- •Медицинское значение:
- •Морфология паразита:
- •Жизненный цикл:
- •Хозяева:
- •Морфология паразита:
- •Хозяева:
- •Жизненный цикл:
- •Клиника:
- •Малярией болеют не все:
- •Профилактика малярии:
- •Лабораторная диагностика:
- •Профилактика:
- •Токсоплазма, балантидий. Систематическое положение, морфология, циклы развития, пути инвазии, обоснование методов лабораторной диагностики.
- •Лабораторная диагностика:
- •Профилактика:
- •Клиника:
- •Диагностика:
- •Клиника:
- •Диагностика:
- •Профилактика:
- •Морфология паразита:
- •Хозяева:
- •Жизненный цикл:
- •Диагностика:
- •Общая характеристика ленточных червей. Цестоды, жизненный цикл которых связан с водной средой.
- •Общая характеристика ленточных червей. Цестоды, жизненный цикл которых связан с водной средой. См. Выше
- •Клиническая картина:
- •Диагностика:
- •Профилактика.
- •Диагностика:
- •Карликовый цепень; лентец широкий. Систематическое положение, морфология, циклы развития, пути инвазии, обоснование методов лабораторной диагностики, профилактика.
- •Клиническая картина.
- •Диагностика:
- •Профилактика:
- •Клиническая картина.
- •Диагностика:
- •Профилактика.
- •Эхинококк и альвеококк. Систематическое положение, морфология, цикл развития, пути заражения, ларвальные гельминтозы. Обоснование методов лабораторной диагностики, профилактика.
- •Клиническая картина.
- •Лечение:
- •Диагноз.
- •Профилактика:
- •Профилактика:
- •Клиника.
- •Диагностика:
- •Профилактика.
- •Клиническая картина.
- •Диагноз.
- •Профилактика.
- •Клиническая картина.
- •Диагностика:
- •Особенности современных методов диагностики гельминтозов. Методы овогельминтоскопии.
- •Метод нативного мазка
- •Метод толстого мазка (метод Като и Миура)
- •Тип Членистоногие. Классификация. Характерные черты организации. Клещи. Систематическое положение. Морфология, развитие, медицинское значение.
- •Класс Паукообразные. Классификация. Характерные черты организации. Клещи, возбудители болезней человека. Клещи, резервуарные хозяева и переносчики болезней человека.
- •Стадии развития (на примере таежного клеща):
- •Классификация насекомых:
- •Вши, блохи. Систематическое положение, морфология, развитие, эпидемиологическое значение, меры борьбы.
- •Комары; москиты Систематическое положение, строение, цикл развития, медицинское значение, меры борьбы.
Пример записи цис- и транс- положения:

Цис-положение - расположение тесно сцепленных рецессивных аллелей двух или нескольких локусов в одной из хромосом гомологичной пары, а доминантных — в другой.
Транс-положение - локализация 2 данных аллелей (генов) на разных гомологичных хромосомах.
«Цис» и «транс» формы сцепления
![]()
![]()
Форма сцепления генов влияет на процент фенотипического кроссоверного и некроссоверного соотношения в потомстве. Например: расстояние между генами АВ равно 10 морганид. Определить некроссоверные и кроссоверные гаметы для «цис» и
«транс» сцепления генов.
«ЦИС»АВ = 10 морганид. некроссоверные гаметы = АВ и ав.(100 – 10)/2 по 45%,
1 морганида = 1% кроссоверные гаметы аВ и Ав по 5%
«ТРАНС»АВ = 10 морганид некроссоверные гаметы аВ и Ав 100 – 10 = 90 : 2 по 45%,
кроссоверные гаметы АВ и ав по 5%
Результаты американского ученого генетика Т. Морганане опровергают законы независимого наследования Г. Менделя. Т. Морган изучал наследование двух пар признаков на новом объекте генетических исследований – плодовой мушке дрозофиле. Он провёл дигибридное скрещивание и получил отклонения от опытов Г. Менделя. Анализируя полученные результаты, он отрыл закон сцепленного наследования:«гены, локализованные в одной хромосоме, наследуются сцеплено».Он делает вывод, что гены анализируемых признаков – цвета тела и длины крыльев находятся в одной хромосоме, принадлежат
одной группе сцепления и поэтому наследуются сцеплено
Тогда как Г. Мендель открыл закон независимого наследования признаков, потому что анализируемые признаки у гороха - цвет и форма горошин контролируются генами,
расположенными
в
разных
негомологичных
хромосомах
![]() .
.
Негомологичные хромосомы, а значит и гены, в них локализованные комбинируются независимо друг от друга в анафазе мейоза, обнаруживая в потомстве гибридов независимое сочетание признаков.
Кроссинговер, перекрест, взаимный обмен участками парных хромосом, происходящий в результате разрыва и соединения в новом порядке их нитей — хроматид; приводит к перераспределению (рекомбинации) сцепленных генов. Важнейший механизм, обеспечивающий комбинаторную изменчивость, а следовательно, — один из главных факторов эволюции. К. , как правило, имеет место в профазе первого деления половых клеток, когда их хромосомы представлены четырьмя нитями.
Кроссинговер. Этот процесс происходит в профазе I мейоза в то время, когда гомологичные хромосомы тесно сближены в результате конъюгации и образуют биваленты. В ходе кроссинговера осуществляется обмен соответствующими участками между взаимно переплетающимися хроматидами гомологичных хромосом (рис. 3.72). Этот процесс обеспечивает перекомбинацию отцовских и материнских аллелей генов в каждой группе сцепления. В разных предшественниках гамет Кроссинговер происходит в различных участках хромосом, в результате чего образуется большое разнообразие сочетаний родительских аллелей в хромосомах.
Понятно, что кроссинговер как механизм рекомбинации эффективен лишь в том случае, когда соответствующие гены отцовской и материнской хромосом представлены разными аллелями. Абсолютно идентичные группы сцепления при кроссинговере не дают новых сочетаний аллелей.
Кроссинговер происходит не только в предшественницах половых клеток при мейозе. Он наблюдается также в соматических клетках при митозе. Соматический кроссинговер описан у дрозофилы, у некоторых видов плесеней. Он осуществляется в ходе митоза между гомологичными хромосомами, однако его частота в 10 000 раз меньше частоты мейотического кроссинговера, от механизма которого он ничем не отличается. В результате митотического кроссинговера появляются клоны соматических клеток, различающихся по содержанию в них аллелей отдельных генов. Если в генотипе зиготы данный ген представлен двумя разными аллелями, то в результате соматического кроссинговера могут появиться клетки с одинаковыми либо отцовскими, либо материнскими аллелями данного гена (рис. 3.73).
Генети́ ческая ка́рта — схема взаимного расположения структурных генов, регуляторных элементов игенетических маркеров, а также относительных расстояний между ними на хромосоме. Генетические карты составляют для каждой пары гомологичных хромосом. Каждой паре присваивается номер (I, II, III и т.д.), группы сцепления номеруются в порядке их обнаружения. Кроме номера в каждой из групп сцепления указывают полное или сокращенное название генов, расстояние этих генов в единицах перекреста от одного из концов хромосомы, а также место расположения центромеры. Следует отметить, что длина хромосомы не обязательно является показателем ее генетической активности. Для генетических карт применяется термин «локус» для обозначения места гена в хромосоме или на ее карте.
Если иметь в виду, что при образовании половых клеток в профазе первого деления мейоза гомологичные хромосомы обмениваются участками (рекомбинация путем кроссинговера), причем частота таких обменов для каждой пары генов (локусов) - величина постоянная и может быть представлена в процентах половых клеток с признаками прошедшего кроссинговера (кроссоверные гаметы, см. п. 4.3.5.2), указанное генетическое явление можно использовать для определения порядка расположения генов по длине хромосомы, а также расстояния между генами, т. е. для составления генетических карт хромосом.
Расстояние между парой генов на генетической карте выражается в морганидах - М (в зарубежной генетической литературе более часто используют термин сантиморганиды - сМ). Если два гена расположены в хромосоме на расстоянии в одну морганиду (сантиморганиду), это означает, что кроссинговер между ними случается (т. е. эти гены рекомбинируют) в 1% делений клетки. Гены одной группы сцепления, если они располагаются в хромосоме на расстоянии в 50 морганид (сан-тиморганид) и более, наследуются независимо друг от друга. Благодаря новым методическим возможностям в настоящее время осуществляется составление физических карт хромосом, характеризующихся в сравнении с генетическими картами большей разрешающей способностью. Расстояние между анализируемыми сайтами ДНК (генами) при физическом картировании выражается в парах нуклеотидов. Генетическое расстояние в 1 М(сМ) соответствует физической дистанции примерно в 1 млн п.н. или 1 мегабазе - Мб (Mb). Составление полных физических карт хромосом является главной целью проекта «Геном человека».
Цитоплазматическая наследственность. Плазмогены. Закономерности наследования внеядерных генов. Плазмиды; их роль в передаче наследственной информации у прокариот.
Закономерности наследования внеядерных генов. Цитоплазматическое наследование
Наличие некоторого количества наследственного материала в цитоплазме в виде кольцевых молекул ДНК митохондрий и пластид, а также других внеядерных генетических элементов дает основание специально остановиться на их участии в формировании фенотипа в процессе индивидуального развития. Цитоплазматические гены не подчиняются менделевским закономерностям наследования, которые определяются поведением хромосом при митозе, мейозе и оплодотворении. В связи с тем что организм, образуемый вследствие оплодотворения, получает цитоплазматические структуры главным образом с яйцеклеткой, цитоплазматическое наследование признаков осуществляется по материнской линии. Такой тип наследования был впервые описан в 1908 г. К. Корренсом в отношении признака пестрых листьев у некоторых растений (рис. 6.21).
Как было установлено позднее, развитие этого признака обусловлено мутацией, возникающей в ДНК хлоропластов и нарушающей синтез хлорофилла в них. Размножение в клетках нормальных (зеленых) и мутантных (бесцветных) пластид и последующее случайное распределение их между дочерними клетками приводят к появлению отдельных клеток, совершенно лишенных нормальных пластид. Потомство этих клеток образует обесцвеченные участки на листьях. Фенотип потомства, таким образом, зависит от фенотипа материнского растения. У растения с зелеными листьями потомство абсолютно нормально. У растения с бесцветными листьями потомство имеет такой же фенотип. У материнского растения с пестрыми листьями потомки могут иметь все описанные фенотипы по данному признаку. При этом внешний вид потомства не зависит от признака отцовского растения.
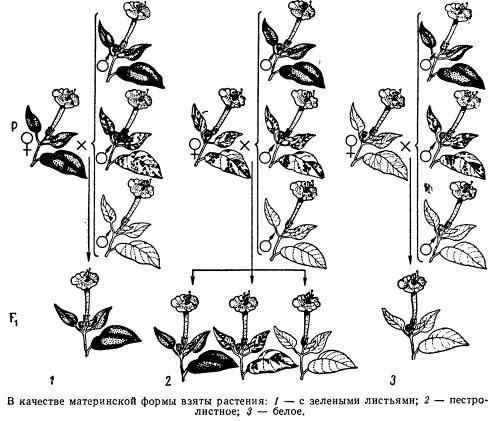
Рис. 6.21. Наследование пестролистости у ночной красавицы:
а —зеленые листья, б—пестрые листья, в —белые листья; I, II, Ш—результаты скрещивания различных материнских растений (а, б, в) с разными отцовскими
Другим примером цитоплазматического наследования признаков могут служить некоторые патологические состояния, описанные у человека, причиной которых является первичный дефект митохондриальной ДНК (мтДНК) (см. гл. 4.1 и гл. 6.4.1.4).
Наряду с описанными выше типами и вариантами наследования ядерных и цитоплазматических генов в последнее время внимание ученых привлекает нетрадиционное наследование некоторых признаков и патологических состояний у человека.
Дополнение: Порядка 10% ДНК эукариотической клетки связано не с ядерными структурами (хромосомами), а с внутриклеточными образованиями преимущественно цитоплазматической локализации, в частности с митохондриями и пластидами (растительные клетки). Внеядерные (внехромосомные) генетические элементы также участвуют в формировании фенотипических признаков в процессе индивидуального развития и жизнедеятельности организма. Вместе с тем наследование признаков, контролируемых генетическими элементами внеядерной локализации (цитоплазматическими генами, цитоплазматической ДНК), характеризуется своими
особенностями - цитоплазматическая наследственность. Оно не следует правилам наследования признаков (см. табл. 4.3), установленным Г. Менделем - неменделевское наследование - и вытекающим из закономерного поведения хромосом при митозе, мейозе и оплодотворении (см. п. 4.3.2 и 4.3.2.1). Так как организм, развивающийся из зиготы, образующейся в результате оплодотворения, получает цитоплазматические структуры, в частности митохондрии, исключительно от яйцеклетки, цитоплазматическое наследование соответствующих признаков осуществляется по материнской линии.
Цитоплазматический тип наследования характерен для признака «пестрые листья» у некоторых растений. Наличие названного признака обусловлено мутацией в ДНК хлоропластов, фенотипически проявляющейся в нарушении образования зеленого пигмента хлорофилла. Размножение в растительных клетках нормальных (зеленых) и мутантных (бесцветных) пластид с последующим их случайным распределением между дочерними клетками приводит к появлению единичных клеток, совершенно лишенных окрашенных хлоропластов. Потомство (клон) этих клеток образует обесцвеченные зоны в листьях. Фенотип потомков по анализируемому признаку зависит от фенотипа материнского растения. У растения с зелеными листьями потомство нормальное. У растения с бесцветными листьями потомство имеет такой же фенотип - листья неокрашены. У материнского растения с пестрыми листьями потомки могут иметь все возможные фенотипы по указанному признаку - листья от полностью зеленых до полностью бесцветных, а также всевозможные переходные (промежуточные) формы. При этом состояние листьев растений-потомков не зависит от фенотипа листьев отцовского растения. Цитоплазматический тип наследования признаков, обусловленный митохондриальной ДНК (мтДНК, хромосома М), характеризуется своими особенностями прежде всего в связи с тем, что принципиальные структурно-функциональные параметры указанных органелл либо находятся под генетическим контролем ядерных генов, либо требуют адекватного взаимодействия элементов ядерного и митохондриального геномов (см., например, п. 4.3.1.3). В современной медицинской генетике существует самостоятельный раздел - митохондриальные наследственные болезни.
Генетическая система клетки: ядерные гены и плазмогены
Хромосомная теория наследственности указывает на ведущую роль ядра в передаче наследственных признаков. По мере развития генетики накапливались данные о возможности прямого участия в явлениях наследственности цитоплазмы. Такая форма наследственности определяется органоидами клетки, способными к самовоспроизведению, благодаря наличию в них ДНК: митохондриями и пластидами. Наследственность, при которой материальной основой наследования являются элементы цитоплазмы, называется цитоплазматической. Такая форма наследственности не подчиняется законам Менделя. Цитоплазматическое наследование, в отличие от хромосомного, осуществляется по материнской линии, т. к. цитоплазмой богата яйцеклетка, а не сперматозоид. Наследственные факторы цитоплазмы и органелл называются плазмотип или плазмон. Единица цитоплазматической наследственности — плазмоген. У прокариот носителями цитоплазматической наследственности является ДНК плазмид. Плазмотип эукариот состоит из наследственного аппарата пластид и митохондрий. Цитоплазматические наследственные структуры распределяются неравномерно в дочерние клетки, в отличие от ядерных ДНК.
Среди типов цитоплазматической наследственности выделяют:
Собственно цитоплазматическое наследование.
пластидное;
митохондриальное;
цитоплазматическая мужская стерильность
Предетерминация цитоплазмы.
Наследование через инфекции.
Пластидная наследственность. Наследование пестролистности у растений является примером такого типа. Пестролистность у цветка ночной красавицы наблюдается только у женского растения. Признак пестролистности связан с мутациями ДНК в хлоропластах, что приводит к их обесцвечиванию.
Митохондриальная наследственность. Митохондриальные гены кодируют 2 группы признаков, связанных:
с работой дыхательной системы;
с устойчивостью к антибиотикам.
В митохондриях дрожжевых клеток обнаружены гены дыхательных ферментов. Эти гены находятся в плазмидах. У бактерий выделяют 3 типа плазмид:
содержащие половой фактор F;
фактор R;
фактор col — колициногенный.
Бактерии с фактором F являются мужскими. При конъюгации фактор F переходит в женскую особь и она становится мужской. Фактор R обеспечивает устойчивость к антибиотикам и также передается при конъюгации. Фактор col содержится в плазмидах, ДНК которых кодирует белкиколицины, убивающие бактерии, не содержащие таких плазмид.
Цитоплазматическая мужская стерильность (ЦМС) — разновидность внеядерной наследственности. Характеризуется присутствием в ДНК митохондрий и пластид цитоплазматического гена (плазмогена), угнетающего формирование хромосом при образовании пыльцы. В результате появляется нежизнеспособная (стерильная) пыльца, не образующая спермиев. ЦМС играет большую роль в селекции и семеноводстве для исключения самоопыления и последующего получения гетерозисных гибридов (кукуруза, лук, пшеница, свекла и др.)
Предетерминация цитоплазмы. В цитоплазме яйцеклетки присутствует негенетические факторы (ферменты, белки-репрессоры), влияющие на экспрессию ядерных генов. Возникает «материнский эффект» — влияние генотипа матери на развитие потомства, передаваемое через цитоплазму яйцеклетки. Так наследуется направление закручивания спирали раковины прудовика, детерминируемое генотипом матери, а не зародыша.
Материальным субстратом цитоплазматической наследственности выступают гены ядерной ДНК, пластид, митохондрий и какие-то пока не установленные факторы. Система генетического аппарата клетки включает генотип ядра и плазмотип (плазмон) цитоплазмы. Генетический аппарат клетки дискретен. В генотипе ядра он представлен хромосомами и генами, входящими в состав хромосом, в плазмотипе цитоплазмы — плазмогенами, которые являются фрагментами пластидной и митохондриальной ДНК.
Характеризуя наследственный материал прокариотической клетки в целом, необходимо отметить, что он заключен не только в нуклеоиде, но также присутствует в цитоплазме в виде небольших кольцевых фрагментов ДНК — плазмид.
Плазмиды — это широко распространенные в живых клетках внехромосомные генетические элементы, способные существовать и размножаться в клетке автономно от геномной ДНК. Описаны плазмиды, которые реплицируются не автономно, а только в составе геномной ДНК, в которую они включаются в определенных участках. В этом случае их называют эписомами.
В прокариотических (бактериальных) клетках обнаружены плазмиды, которые несут наследственный материал, определяющий такие свойства, как способность бактерий к конъюгации, а также их устойчивость к некоторым лекарственным веществам.
Репарация генетического материала. Фотореактивация. Темновая репарация. Этапы. Мутации, связанные с нарушением репарации. Примеры.
Механизмы репарации на примере пострадиационного восстановления структуры ДНК
Репарация или исправление повреждённых участков одной из цепей ДНК рассматривается как ограниченная репликация. Наиболее изучен процесс репарации при повреждении цепи ДНК ультрафиолетовым (УФ) излучением.
В клетках существуют несколько ферментных систем репарации, сформировавшихся в ходе эволюции. Поскольку все организмы развились и существуют в условиях УФ-облучения, то в клетках имеется отдельная система световой репарации, наиболее изученная в настоящее время. При повреждении молекулы ДНК УФ-лучами образуются тиминовые димеры, т.е. «сшивки» между соседними тиминовыми нуклеотидами. Эти димеры не мо- гут выполнять функцию матрицы, поэтому их исправляют ферменты световой репарации, имеющиеся в клетках. Эксцизионная репарация восстанавливает повреждённые участки как УФ-облучением, так и другими факторами. Эта система репарации имеет несколько ферментов: репарационные эндонуклеаза и экзонуклеаза, ДНК-полимераза, ДНК-лигаза. Пострепликативная репарация является неполной, так как идёт «в обход», и повреждённый участок из
молекулы ДНК не удаляется. Изучите механизмы репарации на примере фотореактивации, эксцизионной репарации и пострепликативной репарации (рис. 1).
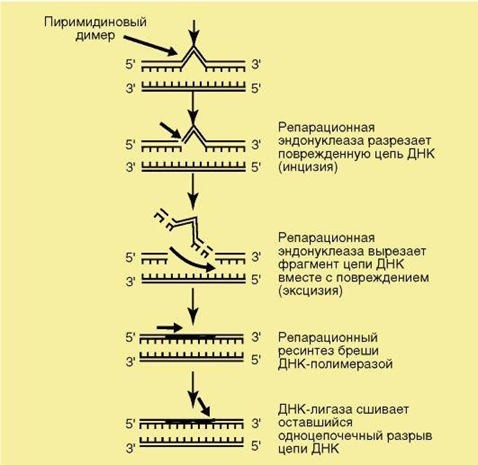
Рис. 1. Репарация
Главным антимутационным барьером рассматривается выработавшая в процессе эволюции способность к репарации наследственного материала. Её сущность - в устранении из наследственного материала клетки изменённого участка.
Различают 3 системы репарации генетического материала:
эксцизионная репарация (репарация путём «вырезания»);
фоторепарация;
пострепликативная репарация;
Эксцизионная репарация - удаление повреждённых азотистых оснований из ДНК и последующее восстановление нормальной структуры молекулы по комплементарной цепи. Ферментативная система удаляет короткую однонитевую последовательность двунитевой ДНК, содержащей ошибочно спаренные или поврежденные основания, и замещает их путём синтеза последовательности, комплементарной оставшейся нити.
Фоторепарация (фотореактивация) - является наиболее простым механизмом репарации ДНК. Заключается в расщеплении ферментом (дезоксирибо-пиримидинфотолиазой),
активируемым видимым светом, циклобутановых димеров, возникающих в ДНК под действием ультрафиолетового излучения.
Пострепликативная репарация - пострепликативная репарация «включается» тогда, когда эксцизионная репарация «не справляется» с устранением всех повреждений, возникших в ДНК до её репликации. При репликации во второй спирали ДНК возникают бреши - однонитевые пробелы, соответствующие изменённым нуклеотидам первой спирали. Бреши заполняются участками цепи с нормальной последовательностью нуклеотидов уже в ходе пострешгикативной репарации при участии ДНК-полимеразы.
Позднее была обнаружена и темновая репарация, т. е. свойство клеток ликвидировать повреждения ДНК без участия видимого света. Темновая репарация осуществляется комплексом из пяти ферментов:
узнающего химические изменения на участке цепи ДНК;
осуществляющего вырезание поврежденного участка;
удаляющего этот участок;
синтезирующего новый участок по принципу комплементарности взамен удаленного фрагмента;
соединяющего концы старой цепи и восстановленного участка.
При световой репарации исправляются повреждения, возникшие только под воздействием ультрафиолетовых лучей, при темновой — повреждения, появившиеся под влиянием жесткой радиации, химических веществ и других факторов. Темновая репарация обнаружена как у прокариот, так и в клетках эукариот. У последних она изучается в культурах тканей. Вопрос о том, почему одни повреждения репарируются, а другие нет, остается открытым. Если репарация не наступает, то клетка либо гибнет, либо наступает мутация.
Механизм репарации основан на наличии в молекуле ДНК двух комплементарных цепей. Искажение последовательности нуклеотидов в одной из них обнаруживается специфическими ферментами. Затем соответствующий участок удаляется и замещается новым, синтезированным на второй комплементарной цепи ДНК. Такую репарацию называют эксцизионной, т.е. с «вырезанием» (рис. 3.15). Она осуществляется до очередного цикла репликации, поэтому ее называют также дорепликативной.
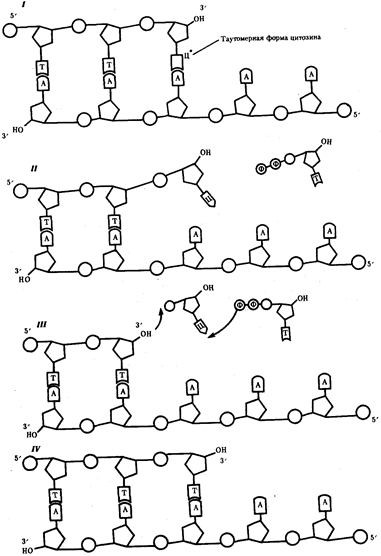
Рис. 3.14. Схема процесса коррекции при синтезе ДНК:
I—включение в цепь ДНК нуклеотида с измененной (таутомерной) формой цитоэина, который «незаконно» спаривается с аденином; II — быстрый переход цитозина в обычную форму нарушает его спаривание с аденином; неспаренный 3'—ОН-конец синтезируемой цепи препятствует дальнейшему ее удлинению под действием ДНК-полимеразы; III — ДНК-полимераза удаляет незаконный нуклеотид, в результате чего вновь появляется спаренный с матрицей 3 '—ОН-конец; IV — ДНК-полимераза продолжает наращивание цепи на 3'—ОН-конце
Восстановление исходной структуры ДНК требует участия ряда ферментов. Важным моментом в запуске механизма репарации является обнаружение ошибки в структуре ДНК. Нередко такие ошибки возникают во вновь синтезированной цепи в процессе репликации. Ферменты репарации должны обнаружить именно эту цепь.
У многих видов живых организмов вновь синтезированная цепь ДНК отличается от материнской степенью метилирования ее азотистых оснований, которое отстает от синтеза. Репарации при этом подвергается неметилированная цепь. Объектом узнавания ферментами репарации могут также служить разрывы в цепи ДНК. У высших организмов, где синтез
ДНК происходит не непрерывно, а отдельными репликонами, вновь синтезируемая цепь ДНК имеет разрывы, что делает возможным ее узнавание.
Восстановление структуры ДНК при утрате пуриновых оснований одной из ее цепей предполагает обнаружение дефекта с помощью фермента эндонуклеазы, которая разрывает фосфоэфирную связь в месте повреждения цепи. Затем измененный участок с несколькими примыкающими к нему нуклеотидами удаляется ферментом экзонуклеазой, а на его месте в соответствии с порядком оснований комплементарной цепи образуется правильная нуклеотидная последовательность (рис. 3.15).
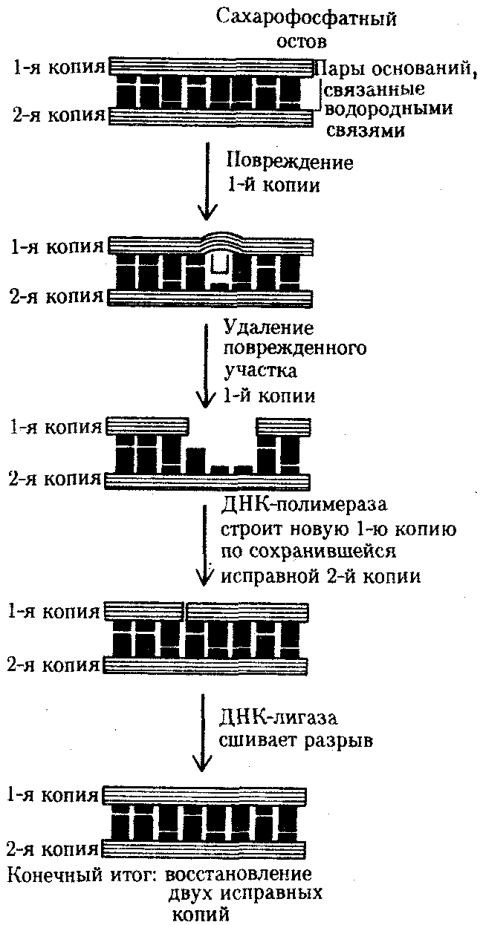
Рис. 3.15. Схема эксцизионной, дорепликативной репарации ДНК
При изменении одного из оснований в цепи ДНК в восстановлении исходной структуры принимают участие ферменты ДНК-гликозилазы числом около 20. Они специфически узнают повреждения, обусловленные дезаминированием, алкилированием и другими структурными преобразованиями оснований. Такие модифицированные основания
удаляются. Возникают участки, лишенные оснований, которые репарируются, как при утрате пуринов. Если восстановление нормальной структуры не осуществляется, например в случае дезаминирования азотистых оснований, происходит замена одних пар комплементарных оснований другими —пара Ц—Г может заменяться парой Т—А и т.п. (см. разд. 3.4.2.3).
Образование в полинуклеотидных цепях под действием УФ-лучей тиминовых димеров (Т—Т) требует участия ферментов, узнающих не отдельные измененные основания, а более протяженные повреждения структуры ДНК. Репаративный процесс в этом случае также связан с удалением участка, несущего димер, и восстановлением нормальной последовательности нуклеотидов путем синтеза на комплементарной цепи ДНК.
В том случае, когда система эксцизионной репарации не исправляет изменения, возникшего в одной цепи ДНК, в ходе репликации происходит фиксация этого изменения и оно становится достоянием обеих цепей ДНК. Это приводит к замене одной пары комплементарных нуклеотидов на другую либо к появлению разрывов (брешей) во вновь синтезированной цепи против измененных участков. Восстановление нормальной структуры ДНК при этом может произойти и после репликации.
Пострепликативная репарация осуществляется путем рекомбинации (обмена фрагментами) между двумя вновь образованными двойными спиралями ДНК. Примером такой пострепликативной репарации может служить восстановление нормальной структуры ДНК при возникновении тиминовых димеров (Т—Т), когда они не устраняются самопроизвольно под действием видимого света (световая репарация) или в ходе дорепликативной эксцизионной репарации.
Ковалентные связи, возникающие между рядом стоящими остатками тимина, делают их не способными к связыванию с комплементарными нуклеотидами. В результате во вновь синтезируемой цепи ДНК появляются разрывы (бреши), узнаваемые ферментами репарации. Восстановление целостности новой полинуклеотидной цепи одной из дочерних ДНК осуществляется благодаря рекомбинации с соответствующей ей нормальной материнской цепью другой дочерней ДНК. Образовавшийся в материнской цепи пробел заполняется затем путем синтеза на комплементарной ей полинуклеотидной цепи (рис. 3.16). Проявлением такой пострепликативной репарации, осуществляемой путем рекомбинации между цепями двух дочерних молекул ДНК, можно считать нередко наблюдаемый обмен материалом между сестринскими хроматидами (рис. 3.17).
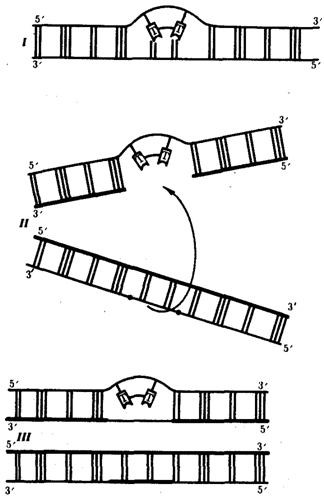
Рис. 3.16. Схема пострепликативной репарации ДНК:
— возникновение тиминового димера в одной из цепей ДНК;
— образование «бреши» во вновь синтезируемой цепи против измененного участка материнской молекулы после репликации (стрелкой показано последующее заполнение
«бреши» участком из соответствующей цепи второй дочерней молекулы ДНК);
— восстановление целостности дочерней цепи верхней молекулы за счет рекомбинации и в нижней молекуле за счет синтеза на комплементарной цепи
В ходе дорепликативной и пострепликативной репарации восстанавливается большая часть повреждений структуры ДНК. Однако, если в наследственном материале клетки возникает слишком много повреждений и часть из них не ликвидируется, включается система индуцируемых (побуждаемых) ферментов репарации (SOS-система). Эти ферменты заполняют бреши, восстанавливая целостность синтезируемых полинуклеотидных цепей без точного соблюдения принципа комплементарности. Вот почему иногда сами процессы репарации могут служить источником стойких изменений в структуре ДНК (мутаций). Названная реакция также относится к SOS-системе.
Если в клетке, несмотря на осуществляемую репарацию, количество повреждений структуры ДНК остается высоким, в ней блокируются процессы репликации ДНК. Такая клетка не делится, а значит, не передает возникших изменений потомству.
Вызываемая повреждениями ДНК остановка клеточного цикла в сочетании с невозможностью молекулярной репарации измененного наследственного материала может с участием белка, синтез которого контролируется геном р53, приводить к активации процесса самоликвидации (апотпоз) дефектной клетки с целью устранения ее из организма.
Таким образом, обширный набор различных ферментов репарации осуществляет непрерывный «осмотр» ДНК, удаляя из нее поврежденные участки и способствуя поддержанию стабильности наследственного материала. Совместное действие ферментов репликации (ДНК-полимераза и редактирующая эндонуклеаза) и ферментов репарации обеспечивает достаточно низкую частоту ошибок в молекулах ДНК, которая поддерживается на уровне 1 · 10-9 пар измененных нуклеотидов на геном. При размере генома человека 3 · 109 нуклеотидных пар это означает появление около 3 ошибок на реплицирующийся геном. Вместе с тем даже этот уровень достаточен для образования за время существования жизни на Земле значительного генетического разнообразия в виде генных мутаций.
