
Ответы на экзаменационные вопросы по химии. Версия №2
.pdf
1. Понятие о пространственной изомерии
Стериоизомеры - молекулы с одинаковой последовательностью атомов, но их различным расположением в пространстве.
Пространственная изомерия:
-оптическая -геометрическая (цис-, транс-изомерия)
Энантиомеры – молекулы, содержащие один ассиметрический атом углерода, существуют в виде двух стериоизомеров, относящиеся друг к другу как предмет к своему зеркальному изображению.
Энантиомеры – стериоизомеры, являющиеся зеркальными аниподами
Диастеомеры – стериоизомеры, не являющиеся энантиомерами.
(Один из стериозомеров молекул с четным числом ассиметрических атомов углерода может иметь плоскость симметрии и быть совместимым со своим зеркальным изображением)
Мезоформа – стериоизомер, молекула которого имеет плоскость симметрии и совместима со своим зеркальным изображением
Проекция формулы Фишера, для получения которых необходимо:
1. Расположить:
-вертикально главную углеродную цепь молекулы с С-1 вверху
-ассиметрический атом углерода в точке пересечения линий без указания его символа
-неуглеродные заместители (-Н, -ОН, -NH) при хиральном центре – горизонтально в любом порядке.

2. Нарисовать энантиомер, поменяв местами горизонтально расположеннве атомы или группы атомов.
Геометрическая изомерия – характерна для соединений, содержащих двойные связи или циклы, в которых не возможен взаимный переход изомеров без разрыва связей между молекулами
В транс-форме одинаковые группы распологаются по разные стороны, а в цис – по одну сторону.
2. D, L – Система обозначения относительной конфигурации стериоизомеров. Абсолютная конфигурация. Оптичская активность, рецемические смеси.
За конфигурационный стандарт принят глицериновый альдегид. ОН – группа находится слева - L конфигурация, ОН –группа справа – D конфигурация

Если в соединении несколько хиральных центров, то принадлежность изомеров определяют по последнему ассиметрическому атому углерода

Абсолютная конфигурация (истинное расположение заместителей у хирального центра) – абсолютная конфигурация D- и L- глицериновых альдегидов действительно такая, какая им была первоначально приписана.
Оптическая активность – свойство вещества вращать плоскость поляризации луча.
Вещества, растворы которых вращают плоскость поляризации луча – оптически активные
Оптическую активность измеряют с помощью прибора – поляример
Энантиомеры вращают плоскость луча на одинаковый угол, но в противопложные стороны, поэтому раствор, приготовленный из равных опряжено энантиомеров не отклоняют плоско поляризованный луч и такую смесь называют рацемической.
3. Конформационная изомерия. Аксиальные и экваториальные связи.
Конформации – это разлечные геометрические формы молекулы которые возникают при вращении атомов относительно сигма – связей.
Конформеры – стериоизомеры, которые образуются при вращении атомов относительное сигма – связей. Они легко переходят друг в друга без разрыва химических связей и не могут быть опряжен в индивидуальном виде.
Для изображения пространственного стороения органических соединений на плоскости

используют проекционные формулы Ньюмена, при строении которых:
-молеулу рассматривают в направлении одной С-С – связи таким образом, чтобы атомы, образующие данную связь, заслоняли друг друга. Из выбранной пары ближний к наблюдателю атом углерода изображают точкой, а дальний – окружностью
-химические связи ближнего атома углерода с другими атомами представляют линиями, берущими начало от точки в центре круга, а дальнего – от окружности.
Аксиальные связи – связи расположенные параллельно вертикальной оси симметрии.
Экваториальные связи – связи ореинтированные под углом 109,5 градусов относительно оси симметрии.
4. Взаимное расположение П – связей в молекуле. Сопряжение. Понятие об ароматичности.
Двойные связив молекуле могут быть опряжено ы:
-изолированно, если они отделены друг от друга несколькими гамма связями, как например в молекуле пентадиен – 1,4: СН2=СН-СН2-СН=СН2; Пары р-орбиталей, участвующие в образовании, удалены друг от друга, дополнительно между собой не перекрываются, а электроны п-связей принадлежат только двум парам атомов углерода и называются – локализованными.
-опряжено, если каждая п-связь чередуется только с одной гамма связью (=-=). Электроны распологаются вдоль всей оси сопряжения и называются – делокализованными.
Сопряжение – это выравнивание связей и зарядов в молекуле по всей цепи сопряжения, приводящее к образованию единого делокализованного электронного облака.
Виды сопряжения:
-п,п сопряжение: если перекрываются р-орбитали сопряженных п-связей. Например, в молекулах 5-аминопентадиен-1,3 и бензол
-р,п сопряжение: если перекрываются р-орбитали п-связей с р-орбиталью гетероатома, который:
-имеет неподеленную пару электронов и
-отделен от п-связи только одной сигма-связью
этот вид сопряжения чаще всего проявляется в соединениях, содержащих структурный фрагмент -СН=СН-Х, где Х - гетероатом, имеющий неподеленную пару электронов.
Циклические сопряженные системы обладают повышенной термодинамической устойчевостью по сравнению с открытыми и их объединяют общим понятием - ароматичность.
Ароматические соединения имеют:
-плоский замкнутый цикл
-сопряженную систему всех атомов цикла
-число обобщенных п-электронов, равно одному из чисел ряда: (4n+2), где n= 1,2,3..., т.е. число электронов, участвующих в сопряжении должно быть равно одному из чисел ряда Хюккеля: 6,10,14...
Простейшим представителем ароматических углеводородов является бензол и нафталин.
5. Электронные эффекты заместителей. Влияние заместителей на реакционную способность соединений.
Индуктивный эффект - передача электронного влияния заместителя по цепи сигма-связи.
Обозначается буквой I, графически изображают стрелкой вдоль сигма-связей, направляя ее к более электроотрицательному атому. Индуктивный эффект может быть +/-. Знак эффекта определяют по тому знаку, котрый приобретает заместитель в результате смещения электронов к более электроотрицательному атому.
По способности смещать электроны заместителей делятся на:
электроноакцепторы: притягивают к себе электронную плотность. Проявляют отрицательный индуктивный эффект. К ним относят большинство функциональных групп: -ОН, -NH2, -COOH, -NO2 и катионных групп, например -NH3.
электронодонорные: отталкивают от себя электронную плотность, проявляют положительный индуктивный эффект. К ним относят: СН3-, С2Н5-, С3Н7-.
Мезомерный эффект - передача электронного влияния заместителя, по цепи сопряжения.
Знак заместителя определяется по знаку, который приобретает заместитель в результате смещеия электронной пары. Смещение электронной плотности обозначается изогнутой стрелкой, направленной к тому отому, к которому смещается электронная пара.
электродоноры: передают пары электронов в общую сопряженную систему, повышая ее электрическую плотность. Проявляют положительный мезомерный эффект. К ним относятся заместители, содержащие атомы с неподеленной парой электронов. Или целым отрицательным зарядом: -NH2, -OH, -SH, -OCH3.
электроноакцепторы: оттягивают электронную плотность на себя и проявляют отрицательный мезомерный эффект. В оставшейся части молекулы электронная плотность понизается. К ним относят: -CHO, -COOH, -NH2, -CN.
Мезомерный эффект в отличии от индуктивного, практически не затухает. Один и тот же заместитель может обладать мезомерным и индуктивным эффектом. Зная электронные эффекты заместителей в молекуле можно прогнозировать ее свойства. Электронодоноры активируют бензольное кольцо в реакциях замещения,а электроноакцепроры оказывают противополоное действие.

11. Катехоламины (дофамин, норадреналин, адреналин): структура, биологическая роль.
12. Классификация карбоновых кислот по: числу карбоксильных групп (основности), насыщенности, наличию функциональной группы, числу углеродов в цепи. Номенклатура ВЖК. Изомерия карбоновых кислот: структурная и пространственная.
Карбоновые кислоты – производные углеводородов, в которых один или несколько атомов водорода замещены на карбоксильную группу.
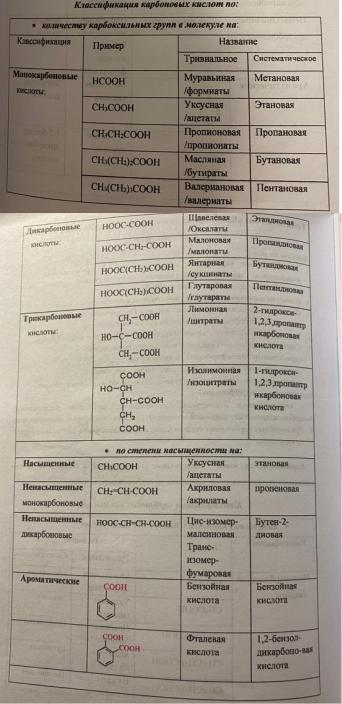

Природные ВЖК, как правило, содержат четное число углеродов. Условно их состав обозначается: С16:0 – это означает, что в состав молекулы входят 16 атомов углерода и отсутствуют двойные связи. Положение двойной связи в жирных кислотах обозначается знаком (треугольником) с надстрочным индексом, соответствующим минимальному номера атома углерода при двойной связи.
У полиненасыщенных кислот атомы углерода нумеруются в обратном порядке: последнему атому углерода присваивается номер 1 и его же обозначают греческой буквой w (омега).Положение двойных связей указывают по отношению к w-углероду.
