
- •Изменение рН среды
- •Механизм эффекта Бора
- •Кооперативное взаимодействие
- •Схема кооперативного взаимодействия субъединиц гемоглобина
- •Изменение формы субъединиц гемоглобина при присоединении кислорода
- •Роль 2,3-дифосфоглицерата
- •Реакции шунта Раппопорта
- •Расположение 2,3-дифосфоглицерата в гемоглобине
ОТВЕТЫ НА ЭКЗАМЕНАЦИОННЫЕ ВОПРОСЫ ПО ХИМИИ «ОБЩАЯ ХИМИЯ»
1. Основные понятия термодинамики. Термодинамические системы: определение, классификация
Термодинамика – это наука, изучающая общие закономерности протекания процессов, сопровождающихся выделением, поглощением и превращением энергии.
Химическая термодинамика изучает взаимные превращения химической энергии и других ее форм – тепловой, световой, электрической и т.д., устанавливает количественные законы этих переходов, а также позволяет предсказать устойчивость веществ при заданных условиях и их способность вступать в те или иные химические реакции. Объект термодинамического рассмотрения называют термодинамической системой или просто системой.
Типы термодинамических систем:
I. По характеру обмена веществом и энергией с окружающей средой:
1.Изолированная система – не обменивается со средой ни веществом, ни энергией (Δm = 0; ΔE = 0) - термос.
2.Закрытая система – не обменивается со средой веществом, но может обмениваться энергией (закрытая колба с реагентами).
3.Открытая система – может обмениваться со средой, как веществом, так и энергией (человеческое тело).
II. По агрегатному состоянию:
1.Гомогенная – отсутствие резких изменений физических и химических свойств при переходе от одних областей системы к другим (состоят из одной фазы).
2.Гетерогенная – две или более гомогенные системы в одной (состоит из двух или нескольких фаз).
Фаза – это часть системы, однородная во всех точках по составу и свойствам и отделенная от других частей системы поверхностью раздела. Примером гомогенной системы может служить водный раствор. Но если раствор насыщен и на дне сосуда есть кристаллы солей, то рассматриваемая система – гетерогенна (есть граница раздела фаз). Другим примером гомогенной системы может служить простая вода, но вода с плавающим в ней льдом – система гетерогенная.
Фазовый переход - превращения фаз (таяние льда, кипение воды).
Термодинамический процесс - переход термодинамической системы из одного состояния в другое, который всегда связан с нарушением равновесия системы.
Классификация термодинамических процессов:
Изотермический - постоянная температура – T = const Изобарный - постоянное давление – p = const Изохорный - постоянный объем – V = const
Основные понятия термодинамики:
Внутренняя энергия U - общий запас энергии, включая движение молекул, колебания связей, движение электронов, ядер и др., т.е. все виды энергии кроме кинетической и потенциальной энергии системы в целом.
Нельзя определить величину внутренней энергии какой-либо системы, но можно определить изменение внутренней энергии ΔU, происходящее в том или ином процессе при переходе системы из одного состояния (с энергией U1) в другое (с энергией U2):
ΔU= U2- U1
ΔU зависит от вида и количества рассматриваемого вещества и условий его существования.
Суммарная внутренняя энергия продуктов реакции отличается от суммарной внутренней энергии исходных веществ, т.к. в ходе реакции происходит перестройка электронных оболочек атомов взаимодействующих молекул.
Энергия может передаваться от одной системы к другой или от одной части системы к другой в форме теплоты или в форме работы.
Теплота (Q) – форма передачи энергии путем хаотического, неупорядоченного движения частиц.
Работа (А) – форма передачи энергии путем упорядоченного перемещения частиц под действием каких-либо
сил.
2. Кинетика химических реакций, классификация
Классификация реакций, применяющихся в кинетике Гомогенная реакция происходит в гомогенной системе и осуществляется во всем объеме этой системы.
Гетерогенная реакция происходит между веществами, образующими гетерогенную систему. Она проходит только на поверхности раздела фаз этой системы. Например:
Fe + 2НСl→FeCl2 + Н2
Растворение металла в кислоте может происходить только на поверхности металла, так как только здесь контактируют друг с другом оба реагирующих вещества.
Микрогетерогенный катализ - это такой тип катализа, когда катализатор и реагенты находятся в коллоиднодисперсном состоянии. Размеры частичек ферментов близки к размерам мицелл коллоидных растворов – 1-100 нм. По отношению к субстратам, частички которых часто намного меньше, катализаторы являются гетерогенными.
Различают простые и сложные реакции. Простыми, элементарными являются одностадийные реакции. Напри-
мер:
Н2 + I2 → 2HI, СH3-N=N-CH3 → C2H6 + N2
Простых реакций мало, большинство процессов - сложные. Сложными называются многостадийные реакции. Сложные, или многостадийные, реакции могут быть параллельными, последовательными, сопряженными, цеп-
ными, фотохимическими и т. д.

Параллельные - это реакции, в результате которых из одного или нескольких веществ в зависимости от условий образуются различные продукты, например, при термическом разложении хлората калия одновременно идут два превращения:
KCl + O2
KClO3
KClO4 + KCl
В организме параллельно с биологическим окислением глюкозы может происходить ее молочнокислое или спиртовое брожение. В биосистемах таких случаев много. Организм должен найти оптимальные доли каждого из направлений.
Последовательные (консекутивные) - это реакции, которые протекают в несколько стадий. Продукты, образовавшиеся в первой стадии, являются исходными веществами для второй и т. д.:
k1 |
k2 k3 |
A → B |
→ C → D |
Примерами последовательных реакций в организме могут быть биологическое окисление глюкозы, гидролиз АТФ и др. Скорость процесса определяется скоростью самой медленной стадии, которую называют лимитирующей.
Сопряженные - это частный случай параллельных реакций: A + B → E;
A + C → F;
из которых первая протекает лишь совместно со второй, т.е. индуцируется второй реакцией. Первая реакция не происходит до тех пор, пока не введено в систему вещество С - индуктор. Явление химической индукции впервые исследовал в 1905 г. русский ученый А.Н. Шилов.
В биологических системах все эндергонические реакции протекают по механизму сопряженных реакций. Клеточное окисление углеводов или липидов в организме приводит к синтезу аденозинфосфорной кислоты, которая, в свою очередь, индуцирует другие превращения, в частности биосинтез белков и нуклеиновых кислот.
Цепные - это реакции, происходящие с участием свободных радикалов (остатков молекул, имеющих неспаренные электроны и проявляющих вследствие этого очень высокую реакционную способность).
Примером цепной реакции может быть синтез хлороводорода:
H2+Cl2 → 2HCl.
Под действием кванта энергии молекула Сl2 образует два радикала.
Реакция начинается при облучении смеси исходных веществ ультрафиолетовым светом:
|
hv |
С12 |
Cl· + Cl· (зарождение цепи). |
Далее происходит развитие цепи: Cl· + Н2 → НСl+ Н·;
Н· + Сl2 → НСl + Cl·.
Это пример неразветвленной цепной реакции.
В разветвленной цепной реакции взаимодействие свободного радикала с молекулой исходного вещества вызывает образование не одного, а двух или большего числа новых радикалов:
2Н2 + О2 → 2Н2О;
Н2 + О2 → ОН· + ОН·;
ОН· + Н2 → Н2О + H·; H· + О2 → ОН· + O·; O· + Н2 → ОН· + H·.
Обрыв цепи может происходить при рекомбинации свободных радикалов, а также при взаимодействии их с посторонними веществами.
Токсические вещества часто действуют по цепному механизму, обусловливая в организме необратимые изменения. Вещества, способные обрывать разветвленное цепное окисление и таким образом предотвращать окислительные процессы, называются антиоксидантами.
Примером антиоксиданта, препятствующего в организме окислению ненасыщенных липидов и предохраняющего биологические мембраны от разрушения, является витамин Е. Его биологическая активность основана на способности образовывать устойчивые свободные радикалы в результате отщепления атома водорода от гидроксильной группы. Эти радикалы вступают во взаимодействие с другими свободными радикалами, которые способствуют образованию органических пероксидов.
Цепные реакции играют важную роль в ряде патологических биопроцессов: канцерогенез, лучевая болезнь и др. К цепным процессам принадлежат ядерные реакции, взрывы, реакции полимеризации и др.
Химическая кинетика или кинетика химических реакций — раздел физической химии, изучающий закономерности протекания химических реакций во времени, зависимости этих закономерностей от внешних условий, а также механизмы химических превращений
3. Скорость химической реакции, факторы на нее влияющие
Скорость химической реакции определяется изменением концентрации (с) любого из веществ, вступающих в реакцию или образующихся во время реакции, за единицу времени (τ). При этом концентрацию выражают в молях на литр (моль/л), время - в секундах, минутах, часах и т.д.

• Факторы, влияющие на скорость химических реакций.
1. Природа реагирующих веществ. Большую роль играет характер химических связей и строение молекул реагентов. Реакции протекают в направлении разрушения менее прочных связей и образования веществ с более прочными связями. Так, для разрыва связей в молекулах H2 и N2 требуются высокие энергии; такие молекулы мало реакционноспособны. Для разрыва связей в сильнополярных молекулах (HCl, H2O) требуется меньше энергии, и скорость реакции значительно выше. Реакции между ионами в растворах электролитов протекают практически мгновенно. Примеры:
Фтор с водородом реагирует со взрывом при комнатной температуре, бром с водородом взаимодействует мед-
ленно |
и |
при |
нагревании. |
Оксид кальция вступает |
в реакцию с водой энергично, |
с выделением тепла; оксид меди |
- не реагирует. |
2. Концентрация. С увеличением концентрации (числа частиц в единице объема) чаще происходят столкновения молекул реагирующих веществ - скорость реакции возрастает.
3. Температура. При повышении температуры на каждые 10°C скорость реакции возрастает в 2-4 раза (Правило ВантГоффа).
4. Поверхность соприкосновения реагирующих веществ. Для гетерогенных систем (когда вещества находятся в разных агрегатных состояниях), чем больше поверхность соприкосновения, тем быстрее протекает реакция. Поверхность твердых веществ может быть увеличена путем их измельчения, а для растворимых веществ - путем их растворения.
4. Зависимость скорости химической реакции от концентрации реагирующих веществ. Закон действующих масс
С увеличением концентрации (числа частиц в единице объема) чаще происходят столкновения молекул реагирующих веществ - скорость реакции возрастает
ЗАКОН ДЕЙСТВУЮЩИХ МАСС (ЗДМ)
Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ в степенях, равных их стехиометрическим коэффициентам.
Следует обратить внимание, что концентрация продуктов реакции не влияет на скорость реакции!
5. Зависимость скорости реакции от температуры. Энергия активации. Температурный коэффициент скорости и его особенности для биохимических процессов.
Влияние температуры на количество столкновений молекул может быть показано с помощью модели. В первом приближении влияние температуры на скорость реакций определяется правилом Вант-Гоффа (сформулировано Я. Х. ВантГоффом на основании экспериментального изучения множества реакций):
В интервале температур от 0оС до 100оС при повышении температуры на каждые 10 градусов скорость химической реакции возрастает в 2-4 раза
Энергия активации в химии и биологии — минимальное количество энергии, которое требуется сообщить системе (в
химии выражается в джоулях на моль), чтобы произошла реакция |
|
Температурный коэффициент реакции химической и ферментативной |
|
Термолабильность ферментов. Скорость химических реакций зависит |
от температуры, поэтому катализируе- |
мые ферментами реакции также чувствительны к изменениям температуры. |
Установлено, что скорость большин- |
ства биохимических реакций повышается в 2 раза при повышении температуры на 10°С и, наоборот, снижается в 2 раза при понижении температуры на 10°С. Этот показатель получил название температурного коэффициента. Однако вследствие белковой природы фермента тепловая денатурация при повышении температуры будет снижать эффективную концентрацию фермента с соответствующим снижением скорости реакции. Так, при температуре, не превышающей 45— 50°С, скорость реакции увеличивается согласно теории химической кинетики. При температуре выше 50° С на скорость реакции большое влияние начинает оказывать тепловая денатурация белка-фермента, приводящая к полному прекращению ферментативного процесса. Температурные коэффициенты скорости большинства реакций довольно близки друг к другу, колеблясь в указанных выше пределах (у = 2 4). Однако известно значительное число отступлений. Например, при инверсии свекловичного сахара в кислой среде у больше 4, а при гидролизе метилацетата меньше 2 (в последней реакции у найдена равной 1,82). Особенно высокие значения температурных коэффициентов скорости химических реакций найдены при изучении влияния температуры на энзиматические (ферментативные) процессы. В этих случаях у может достигать 7 и выше.
6. Химическое равновесие. Обратимые и необратимые реакции. Константа химического равновесия. Прогнозирование смещения химического равновесия. Принцип Ле-Шателье-Брауна
Химическое равновесие — состояние химической системы, в которой протекает одна или несколько химических реакций, причём скорости в каждой паре прямой-обратной реакции равны между собой.
Химические реакции, в результате которых исходные вещества практически полностью превращаются в конечные продукты, называются необратимыми. К ним откосятся как гетерогенные, так и гомогенные реакции. Например, реакции горения простых веществ — фосфора, угля, железа и сложных — метана СН4, сероуглерода СS2. Как вы знаете, реакции горения относятся к экзотермическим реакциям. Чаще всего к экзотермическим будут относиться реакции соединения, например реакция гашения извести:
СаО + Н2О = Са(ОН)2 + Q (теплота выделяется).
Однако необратимых реакций не так много. Большинство реакций обратимы.
Эту реакцию используют при получении серкой кислоты. Обратимыми являются также реакции синтеза аммиака
Химические реакции, которые протекают одновременно а двух противоположных направлениях — прямом и обратном
— называются обратимыми.
Константа химического равновесия — характеристика химической реакции, по значению которой можно судить о направлении процесса при исходном соотношении концентраций реагирующих веществ, о максимально возможном выходе продукта реакции при тех или иных условиях.
Перевод равновесной химической системы из одного состояния равновесия в другое называется смещением (сдвигом) химического равновесия, которое осуществляется изменением термодинамических параметров системы − температуры, концентрации, давления При смещении равновесия в прямом направлении достигается увеличение выхода продуктов, а при смещении в обратном направлении −уменьшение степени превращения реагента. И то, и другое может оказаться полезным в химической технологии.
Направление сдвига химического равновесия определяется принципом Ле-Шателье: если на систему в состоянии ис-
тинного равновесия воздействовать извне, изменяя термодинамические параметры, то равновесие сместится в том направлении, которое ослабит эффект внешнего воздействия.
При́нцип Ле Шателье́— Бра́уна — если на систему, находящуюся в устойчивом равновесии, воздействовать извне, изменяя какое-либо из условий равновесия (температура, давление, концентрация, внешнее электромагнитное поле), то в системе усиливаются процессы, направленные на компенсацию внешнего воздействия.
7. Катализ гомогенный и гетерогенный . Особенности ферментативного катализа
Различают гомогенный и гетерогенный катализ. При гомогенном катализе катализатор находится в одной фазе с реагирующими веществами. При гетерогенном катализе катализатор - самостоятельная фаза, отделенная от реагирующей системы границей раздела, где и происходит реакция. Рель катализатора обычно сводится к участию в образовании лабильных промежуточных соединений с исходным веществом. В процессе реакции осуществляется многократное повторение циклов, включающих поочередное связывание и регенерацию катализатора.
ФЕРМЕНТАТИВНЫЙ КАТАЛИЗ (биокатализ), ускорение биохим. р-ций при участии белковых макромолекул, назы-
ваемых ферментами (энзимами) |
|
|
|
|
|
|
Удивительная особенность |
ферментативного |
катализа состоит |
в |
том, |
что фермент |
специфиче- |
ским образом связывает субстрат и все реакции протекают внутри фермент-субстратного комплекса. Таким образом, чтобы понять, как работает фермент, необходимо знать структуру не только нативного фермента, ной комплексов фермента с субстратами, а также промежуточных соединений и продуктов. Только в этом случае мы сможем понять, как происходит связывание субстрата, какие каталитические группы участвуют в этом процессе и какие структурные изменения происходят в субстрате и ферменте при образовании фермент-субстратного комплекса. Основная трудность на этом пути связана с тем, что реакции в фермент-субстратных комплексах и образование продуктов протекают за доли секунды, тогда как для снятия рентгенограммы требуется, как правило, несколько часов. В связи с этим обычно определяют структуру комплексов ферментов с продуктами реакции, ингибиторами или аналогами субстратов.
8. Физико-химические свойства воды, определяющие её роль в природе и организме. Биологически важные свойства воды. Примеры водородных связей в биологических системах ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА ВОДЫ — параметры, определяющие физико-химические особенности при-
родных вод. К ним относятся показатели концентрации водородных ионов (рН) и окислительно-восстановительный потенциал (Eh).
Организм взрослого человека на 65% состоит из воды, а новорождённого – на 75%. ⅔ от общего количества воды составляет внутриклеточная вода, ⅓ - внеклеточная.
Вода поступает в организм двумя путями: 1) алиментарным (еда, питьё) – 1,5-2,0 литра в сутки; 2) эндогенным (вода, образующаяся при метаболических превращениях) – 0,35-0,4 л в сутки.
Вода в организме участвует в:
1.процессах метаболизма;
2.терморегуляции как теплоноситель и хладагент;
3.трансформации энергии (синтез и гидролиз макроэргических соединений);
4.процессе диссоциации электролитов как полярный растворитель;
5.растворении минеральных и органических веществ, газов, жидкостей. Свойства воды объясняются строением её молекул и структурированностью.
Водородная связь - это взаимодействие атома водорода с более электроотрицательным атомом, имеющее частично
донорно-акцепторный, частично электростатический характер. Любая химическая связь характеризуется энергией ее образования. По энергии водородная связь занимает промежуточное положение между ковалентной (200 - 400 кДж/моль) и ионной химическими связями и слабыми ван-дер-ваальсовыми взаимодействиями, находясь в пределах 12 - 30 кДж/моль.
Необычная структура воды обусловливает ее уникальные физико-химические свойства. Все биохимические процессы в организме протекают в водной среде. Вещества, находящиеся в водном растворе, имеют водную оболочку, которая образуется в результате взаимодействия полярных молекул воды с заряженными группами макромолекул или ионов. Чем больше такая оболочка, тем лучше растворимо вещество.
По отношению к воде молекулы или их части делят на гидрофильные (водорастворимые) и гидрофобные (водонерастворимые). Гидрофильными являются все органические и неорганические соединения, диссоциирующие на ионы, биологические мономеры и биополимеры, имеющие полярные группы. К гидрофобным следует отнести соединения, молекулы которых содержат неполярные группы или цепи (триацилглицерины, стероиды и др.). Молекулы некоторых соединений содержат как гидрофильные, так и гидрофобные группы; такие соединения называют-
ся амфифильными (от греч. amphy - двоякий). К ним относятся жирные кислоты, фосфолипиды и др. Из вышесказанного следует, что диполи воды способны взаимодействовать не только между собой, но и с полярными молекулами органических и неорганических веществ, локализованных в клетке организма. Этот процесс получил название гидратации веществ.
Физико-химические свойства воды определяют ее биологические функции:
•Вода является прекрасным растворителем.
•Вода выполняет функцию регулятора теплового баланса организма, так как ее теплоемкость значительно превышает теплоемкость любого биологического вещества. Поэтому вода может долго сохранять тепло при изменении температуры окружающей среды и переносить его на расстояние.
•Вода способствует сохранению внутриклеточного давления и формы клеток (тургор).
•В определенных биохимических процессах вода выступает в качестве субстрата.
Большое значение водородные связи имеют в таких биологически важных природных веществах , как белки, фермен-
ты, целлюлоза, а также в синтетических полиамидах. Водородная связь играет большую роль э свойствах многих органических соединений и биологически важных веществ , например таких, как белки и нуклеиновые кислоты. Водородная связь служит причиной некоторых важных особенностей воды — вещества, играющего огромную роль в процессах, протекающих в живой и неживой природе. Она в значительной мере определяет свойства и таких биологически важных веществ как белки и нуклеиновые кислоты.
9. Растворы. Коллигативные свойства растворов. Закон Рауля
Коллигативные свойства – это свойства растворов, зависящие только от числа растворённых частиц в единице массы растворителя и от абсолютной температуры, и не зависящие от их природы. Например, все одномоляльные растворы неэлектролитов (содержащие 1 моль растворённого вещества на 1 кг растворителя), имеют одинаковые отличия в температуре замерзания и кипения от чистых растворителей, и одинаковое осмотическое давление.
Кколлигативным свойствам относятся:
1.диффузия;
2.понижение давления насыщенного пара растворителя над раствором, по сравнению с насыщенным паром растворителя над чистым растворителем;
3.повышение температуры кипения раствора, по сравнению с чистым растворителем;
4.понижение температуры замерзания раствора, по сравнению с чистым растворителем;
5.осмотическое давление.
Все биологические жидкости (лимфа, сыворотка и плазма крови) – растворы, поэтому они обладают коллигативными свойствами. Осмотическое давление в биологических жидкостях зависит как от растворённых в них минеральных веществ, так и от ВМС (белков, нуклеиновых кислот, полисахаридов). Осмотическое давление крови человека постоянно и при 37°С составляет 7,4-7,8 атм. (0,74-0,78 МПа). Учитывая это, в медицинской практике во избежание осмотических конфликтов широко используют различные изотонические растворы.
Следствием закона Рауля являются два свойства растворов: температура замерзания растворов ниже, а температура кипения – выше, чем у чистых растворителей. Причём повышение температуры кипения и понижение температуры замерзания растворов неэлектролитов прямо пропорциональны их моляльной концентрации. В результате при атмосферном давлении, например, водные растворы кипят при температуре выше 100°С и замерзают при температуре ниже 0°С.
10. Диффузия и осмос. Осмотическое давление. Закон Вант-Гоффа. Осмолярность биологических жидкостей. Ос- мотически-активные компоненты плазмы крови
Диффузия – это самопроизвольный процесс выравнивания концентрации растворённого вещества в объёме.
Она обусловлена 2 факторами: 1) наличием рыхлой структуры и пустот в растворителе (например, в 1 л воды её молекулами занято только примерно 370 мл), 2) тепловым движением частиц раствора.
Диффузия прекращается, если концентрация во всех частях раствора становится одинаковой. Скорость диффузии зависит от:
1.абсолютной температуры;
2.градиента концентрации;
3.вязкости растворителя;
4.размера диффундирующих частиц.
Скорость диффузии возрастает при повышении температуры и градиента концентрации и уменьшается при увеличении вязкости растворителя, размера и массы диффундирующих частиц. Поэтому растворы высокомолекулярных соединений (ВМС - белков, полисахаридов и др.) имеют очень низкий коэффициент диффузии.
Осмос – это односторонняя диффузия растворителя через полупроницаемую мембрану в сторону раствора с большей концентрацией растворённого вещества.
Осмос вызывается осмотическим давлением – силой, отнесённой к единице поверхности мембраны. Осмотическое давление имеется у любого раствора. Оно обусловлено стремлением частиц растворителя путём диффузии распределиться в максимально большем объёме.
Осмотическое давление растворов неэлектролитов пропорционально молярной концентрации (при постоянной температуре) и абсолютной температуре (при постоянной концентрации) раствора:
Росм = RCT,
где: R – универсальная газовая постоянная равная 8,31 Дж/(моль×К), C – молярная концентрация раствора, T – его абсолютная температура.
Закон Вант-Гоффа: учитывая, что С = n/V, получаем: РосмV = nRT. Для растворов электролитов вводится поправочный коэффициент i, показывающий во сколько раз истинная концентрация растворённых частиц, осмотическое давление, понижение температуры замерзания, повышение температуры кипения, понижение давления насыщенного пара растворителя больше, чем в эквивалентном растворе неэлектролита
Осмоляльность крови в значительной степени зависит от концентрации ионов натрия и хлора, в меньшей степени глюкозы и мочевины. В норме осмоляльность сыворотки крови 275-296 мосмоль/кг Н2О, осмоляльность мочи обусловлена мочевиной, ионами натрия, калия, аммония. Осмоляльность мочи колеблется значительно: от 50 до 1400 мосмоль/кг Н2О. При суточном диурезе около 1,5 л осмоляльность мочи здорового человека составляет 600-800 мосмоль/кг Н2О.
При патологических состояниях осмоляльность крови может как снижаться, так и повышаться. Гипоосмоляльность характеризует снижение концентрации натрия в крови при передозировке диуретиков, избыточной продукции антидиуретического гормона, при хронической сердечной недостаточности, циррозе печени с асцитом, глюкокортикоидной недостаточности. Гиперосмоляльность связана с гипернатриемией и наблюдается при сахарном диабете, недостаточности калия, гиперкальциемии, при декомпенсированном сахарном диабете (гипергликемической коме), при гиперальдостеронизме, избыточном введении кортикостероидов, при хронической почечной недостаточности наблюдается увеличение концентрации мочевины (каждые 5 ммоль/л мочевины увеличивают осмоляльность крови на 5 мосмоль/кг Н2О), параллельно происходит снижение концентрации натрия в крови, поэтому осмоляльность крови значительно не меняется.
11. Биологическое значение осмотического давления. Поведение эритроцитов в растворах различной концентрации. Применение в медицине растворов различной осмолярности
Явление осмоса играет важную роль во многих химических и биологических системах. Благодаря осмосу регулируется поступление воды в клетки и межклеточные структуры. Упругость клеток (тургор), обеспечивающая эластичность тканей и сохранение определенной формы органов, обусловлена осмотическим давлением
Изотонический раствор – раствор какого-либо вещества в воде, осмотическое давление которого равно осмотическому давлению крови. Например, 0,85% раствор NaCl, 5% раствор глюкозы. В изотонических растворах эритроциты не изменяют свою форму, т.к. Росм изотонического раствора равно Росм эритроцита, поэтому потоки Н2О в эритроцит и из него уравновешены. Изотонические растворы используют в качестве кровезаменителей при небольших потерях крови или для внутривенного введения растворённых в них лекарственных веществ.
Существуют и неизотонические растворы: гипотонические и гипертонические. Раствор, осмотическое давление которого ниже изотонического, называется гипотоническим. Раствор, осмотическое давление которого выше изотонического, называется гипертоническим.
Введение в организм значительных объёмов неизотонических растворов может привести к осмотическим конфликтам. Росм гипертонического раствора больше Росм эритроцитов. В результате ток воды направлен из эритроцитов в окружающую среду (в сторону раствора с большей концентрацией). Наступает обезвоживание эритроцитов и, как следствие, их сморщивание (плазмолиз).
Росм гипотонического раствора меньше Росм эритроцита. В результате ток воды направлен в эритроцит из окружающей среды (в сторону раствора с большей концентрацией). Наступает набухание эритроцита и, как следствие, его разрыв (гемолиз). Тем не менее, неизотонические растворы применяют в медицине.
Например:
1.при повышении внутриглазного давления (глаукоме) небольшое количество гипертонического раствора вводят внутривенно, чтобы «оттянуть» избыточное количество воды из передней камеры глаза и, тем самым, снизить внутриглазное давление;
2.повязки с гипертоническим раствором NaCl (10% водный раствор) используют для лечения гнойных ран – ток раневой жидкости направляется по марле наружу, что способствует постоянному очищению раны от гноя, микроорганизмов и продуктов распада;
3.гипертонические растворы MgSO4 и Na2SO4 используют в качестве слабительных средств, эти соли плохо всасываются в ЖКТ, что вызывает переход Н2О из слизистой в просвет кишечника; в результате, увеличивается объём кишечного содержимого, раздражаются рецепторы слизистой, усиливается перистальтика, и ускоряется эвакуация кишечного содержимого;
4.введение гипотонических растворов входят в программу лечения гиперосмолярной комы – тяжёлого осложнения сахарного диабета.
Часть осмотического давления, которое обусловлено только растворёнными белками, называется онкотическим давлением. Оно составляет примерно 0,5% от общего осмотического давления и равно 0,04 атм или 30-40 см водного столба.
12. Коллоидно-осмотическое давление крови. Гипотеза Старлинга как один из механизмов возникновения отеков Онкотическое давление — коллоидно-осмотическое давление, доля осмотического давления, создаваемая высокомолекулярными компонентами раствора. В плазме крови человека составляет лишь около 0,5 % осмотического давления (3—4 кн/м², или 0,03—0,04 атм).
Согласно гипотезе Старлинга, в крови, в артериальной и венозной частях капилляров, соотношение между гидростатическим давлением, обусловленным работой сердца (45 и 15 см водного столба соответственно), и онкотическим давлением (30 см водного столба) различно. Разница давлений одинакова и составляет 15 см водн. ст., но в артериальной области преобладает Ргидр, а в венозной области – Ронк.

Таким образом, в артериальной части, где преобладает Ргидр, это способствует выходу безбелковой части плазмы и с ней веществ из крови в межклеточную жидкость. Оттуда питательные вещества поступают в клетки. В венозной части более высокое Ронк вызывает движение тока жидкости и с ней веществ по осмотическому градиенту из клеток окружающих тканей в кровь. Происходит выведение метаболитов и продуктов распада из клеток. В физиологических условиях отток безбелковой части плазмы равен притоку, т.к. разность давлений в артериальной и венозной части одинаковая.
При нарушении этого равновесия может развиваетсяся отёк. Отёк – накопление внесосудистой жидкости. Одна из причин отёка – гипопротеинемия – уменьшение концентрации белков в плазме, ведущая к снижению онкотического давления. Она возникает вследствие длительного голодания («голодные отёки»), нарушения синтеза белков для плазмы в печени, потери с мочой при заболеваниях почек, обширных ожогах и т.п.
13. Ионное произведение воды и водородный показатель. Методы определения pН растворов. Индикаторы и их свойства
Ионное произведение воды показывает, чему равнопроизведение концентраций ионов водорода и гидроксид-ионов в воде
Водородный показатель — (рН) величина, характеризующая активность или концентрацию ионов водорода в растворах; численно равна отрицательному десятичному логарифму концентрации, выраженной в грамм ионах на литр
pH можно приблизительно оценивать с помощью индикаторов, точно измерять pH-метром или определять аналитически путём, проведением кислотно-основного титрования.
1. Для грубой оценки концентрации водородных ионов широко используются кислотно-основные индикаторы - органические вещества-красители, цвет которых зависит от pH среды. К наиболее известным индикаторам принадлежат лакмус, фенолфталеин, метиловый оранжевый (метилоранж) и другие. Индикаторы способны существовать в двух поразному окрашенных формах - либо в кислотной, либо в основной. Изменение цвета каждого индикатора происходит в своём интервале кислотности, обычно составляющем 1-2 единицы . Их преимуществом является дешевизна, быстрота и наглядность исследования.
Изменение цвета кислотно-основных индикаторов в зависимости от pH раствора
|
Цвет индикатора в среде |
|
|
|
|
|
|
|
|
Название |
Кислая [H+] > [OH-] |
Нейтральная |
Щелочная [OH-] > [H+] |
|
[H+] = [OH-] |
||||
|
||||
|
рН < 7 |
рН > 7 |
||
|
рН = 7 |
|||
|
|
|
||
Лакмус |
Красный |
фиолетовый |
синий |
|
|
|
|
|
|
Фенолфталеин |
бесцветный |
бесцветный |
малиновый |
|
|
|
|
|
|
Метилоранж |
Розовый |
оранжевый |
желтый |
|
|
|
|
|
Этот метод недостаточно точен, требует введения солевых и температурных поправок, дает значительную погрешность при очень малой минерализации исследуемой воды (менее 30 мг/л) и при определении pH окрашенных и мутных вод. Метод нельзя применять для сред, содержащих сильные окислители или восстановители. Используется обычно в полевых условиях и для ориентировочных определений.
2. Для расширения рабочего интервала измерения pH используют так называемый универсальный индикатор, представляющий собой смесь из нескольких индикаторов. Универсальный индикатор последовательно меняет цвет с красного через жёлтый, зелёный, синий до фиолетового при переходе из кислой области в щелочную. Индикатор изменяет окраску в интервале рН 1,0-10,0
Изменение цвета универсального индикатора в зависимости от pH раствора
рН |
Окраска |
рН |
Окраска |
1,0 |
красно-фиолетовая |
6,0 |
зеленовато-желтая |
2,0 |
розово-оранжевая |
7,0 |
желто-зеленая |
3,0 |
Оранжевая |
8,0 |
зеленая |
4,0 |
желто-оранжевая |
9,0 |
сине-зеленая |
5,0 |
Желтая |
10,0 |
серовато-синяя |
3. Использование специального прибора - pH-метра - позволяет измерять pH в более широком диапазоне и более точно (до 0,01 единицы pH), чем с помощью индикаторов. Ионометрический метод определения pH основывается на измерении милливольтметром ионометром ЭДС гальванической цепи, включающей специальный стеклянный электрод, потенциал которого зависит от концентрации ионов H+ в окружающем растворе. Способ отличается удобством и высокой точностью, особенно после калибровки индикаторного электрода в избранном диапазоне рН, позволяет измерять pH непрозрачных и цветных растворов и потому широко используется.
Стеклянный электрод представляет собой стеклянную трубку с выдутым на ее конце шариком с очень тонкой стенкой, в которую залита суспензия AgCl в растворе HCl и погружена серебряная проволока. Таким образом, внутри трубки с шариком находится хлорсеребряный электрод. Для измерения pH стеклянный электрод погружают в испытуемый раствор (тем самым не внося в него никаких посторонних веществ). В этот же раствор напрямую или через электролитический ключ погружают электрод сравнения. В полученной системе перенос электронов от хлорсеребрянного электрода к электроду сравнения, происходящий под действием непосредственно измеряемой разности потенциалов, неизбежно сопровождается переносом эквивалентного количества протонов из внутренней части стеклянного электрода в испытуемый раствор. Если считать концентрацию ионов H+ внутри стеклянного электрода постоянной, то измеряемая ЭДС является функцией только активности ионов водорода, т.е. pH исследуемого раствора.
4. Аналитический объёмный метод - кислотно-основное титрование - также даёт точные результаты определения кислотности растворов. Раствор известной концентрации (титрант) по каплям добавляется к исследуемому раствору. При их смешивании протекает химическая реакция. Точка эквивалентности - момент, когда титранта точно хватает, чтобы полностью завершить реакцию, - фиксируется с помощью индикатора. Далее, зная концентрацию и объём добавленного раствора титранта, вычисляется кислотность раствора.
14. Роль концентрации водородных ионов в биологических процессах. Понятие о кислотно-основном состоянии организма (КОС): нормы pН крови, представление об ацидозе и алкапоз и возможные причины их развития
Роль концентрации водородных ионов в биологических процессах.
Постоянство концентрации водородных ионов является одной из существенных констант внутренней среды
организмов. |
Так, |
pH крови |
человека составляет |
7,36. |
Как известно, каждый ион играет |
особую роль в различных биологических процессах, |
однако водородные |
||
ионы занимают особое положение среди других. Концентрация водородных ионов является одной из важных кон-
стант |
внутренней. |
Роль |
концентрации водородных ионов в биологических процессах. Развитие внутренней среды организ- |
мов в большой степени связано с концентрацией водородных ионов. Специфика процессов, протекающих в тканях, и активность этих процессов (особенно ферментативных) в большой степени зависят от pH. Изменение интервала pH может изменить направление ферментативного процесса. Так, например, тканевые катепсины в нейтральной среде катализируют синтез белка, а при кислой реакции его расщепляют.
Понятие о кислотно-основном состоянии организма: рН крови, ацидоз, алкалоз, щелочной резерв крови
В поддержании кислотно-основного гомеостаза (баланс оптимальных концентраций кислотных и основных компонентов физиологических систем) участвуют все буферные системы организма. Действия их взаимосвязаны и находятся в состоянии равновесия. Наиболее связан со всеми буферными системами гидрокарбонатный буфер. Нарушения в любой буферной системе сказываются на концентрациях его компонентов, поэтому изменение параметров гидрокарбонатной буферной системы может достаточно точно характеризовать КОС организма.
КОС крови в норме характеризуется следующими метаболическими показателями:
рН плазмы 7,4±0,05; [НСО3-]=(24,4±3) моль/л ― щелочной резерв кови;
рСО2=40 мм рт.ст.- парциальное давление СО2 над кровью.
Из уравнения Гендерсона-Гассельбаха для гидрокарбонатного буфера очевидно, что при изменении концентрации или парциального давления СО2 происходит изменение КОС крови.
Поддержание оптимального значения реакции среды в различных частях организма достигается благодаря согласованной работе буферных систем и органов выделения. Сдвиг реакции среды в кислую сторону называют ацидоз, а в оснóвную – алкалоз. Критическими значениями для сохранения жизни являются: сдвиг в кислую сторону до 6,8, а в оснóвную – 8,0. По происхождению ацидоз и алкалоз могут быть дыхательными или метаболическими.
Метаболический ацидоз развивается вследствие: а) повышенной продукции метаболических кислот; б) в результате потери гидрокарбонатов.
Повышенная продукция метаболических кислот происходит при:
1.сахарном диабете I типа, длительном, полном голодании или резком сокращении доли углеводов в рационе;
2.лактатацидозе (шок, гипоксия, сахарный диабет II типа, сердечная недостаточность, инфекции, отравление ал-
коголем).
Повышенная потеря гидрокарбонатов возможна с мочой (почечный ацидоз), или с некоторыми пищеварительными соками (панкреатический, кишечный).
Дыхательный (респираторный) ацидоз развивается при гиповентиляции лёгких, которая, независимо от вызвавшей её причины, приводит к росту парциального давления СО2 более 40 мм рт. ст. (гиперкапния). Это бывает при заболеваниях органов дыхания, гиповентиляции легких, угнетении дыхательного центра некоторыми препаратами, например, барбитуратами.
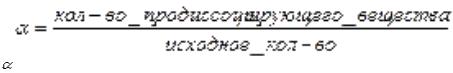
Метаболический алкалоз наблюдается при значительных потерях желудочного сока вследствие повторной рвоты, а также в результате потери протонов с мочой при гипокалиемии, при запорах (когда накапливаются щелочные продукты в кишечнике; ведь источником бикарбонат-анионов является поджелудочная железа, протоки которой открываются в 12-перстную кишку), а также при длительном приеме щелочной пищи и минеральной воды, соли которой подвергаются гидролизу по аниону.
Дыхательный (респираторный) алкалоз развивается вследствие гипервентиляции лёгких, приводящей к избыточному выведению СО2 из организма и понижению его парциального давления в крови менее 40 мм. рт. ст. (гипокапния). Это бывает при вдыхании разреженного воздуха, гипервентиляции легких, развитии тепловой одышки, чрезмерного возбуждения дыхательного центра вследствие поражения головного мозга.
При ацидозах в качестве экстренной меры используют внутривенное вливание 4 – 8 % гидрокарбоната натрия, 3,66%- ного раствора трисамина Н2NC(CH2OH)3 или 11 % лактата натрия. Последний, нейтрализуя кислоты, не выделяет СО2, что повышает его эффективность.
Алкалозы корректируются сложнее, особенно метаболические (связанные с нарушением систем пищеварения и выделения). Иногда используют 5 % раствор аскорбиновой кислоты, нейтрализованный бикарбонатом натрия до рН 6 –
7.
Щелочной резерв - это количество бикарбоната (NaHCО3) (точнее объем СО2, который может быть связан плазмой крови). Эту величину лишь условно можно рассматривать как показатель кислотно-щелочного равновесия, так как, несмотря на повышенное или пониженное содержание бикарбоната, при наличии соответствующих изменений Н2СО3 рН может оставаться совершенно нормальным.
Так как компенсаторные возможности посредством дыхания, первоначально используемые организмом, ограничены, решающая роль в поддержании постоянства переходит к почкам. Одной из основных задач почек является удаление из организма Н+-ионов в тех случаях, когда вследствие каких-либо причин в плазме наступает сдвиг в сторону ацидоза.
Ацидоз не может быть скорригирован, если не будет удалено соответствующее количество Н+-ионов. Почки используют при этом 3 механизма:
1.Обмен ионов водорода на ионы натрия, которые, соединяясь с образующимися в канальцевых клетках анио-
нами НСО3, полностью подвергаются обратному всасыванию в виде NaHCO3,
Предпосылкой выделения Н+-ионов с помощью этого механизма является активируемая карбоангидразой реакция СО2 + Н2О = Н2СО3, причем Н2СО3 распадается на ионы Н+ и НСО3-. При этом обмене ионов водорода на ионы натрия происходит обратное всасывание всего отфильтрованного в клубочках бикарбоната натрия.
2.Выделение с мочой ионов водорода и обратное всасывание ионов натрия происходит также путем превращения в дистальных отделах канальцев щелочной соли фосфата натрия (Na2HPО4) в кислую соль дифосфата натрия
(NaHaPO4).
3.Образование солей аммония: аммиак, образующийся в дистальных отделах почечных канальцев из глутамина
идругих аминокислот, способствует выделению Н+-ионов и обратному всасыванию ионов натрия; происходит образова-
ние NH4Cl вследствие соединения аммиака с HCl. Интенсивность образования аммиака, необходимого для нейтрализации сильной НСl, тем больше, чем выше кислотность мочи.
15. Реакция среды в растворах слабых кислот и оснований. Константа диссоциации. Реакция среды в растворах солей. Закон разведения Оствальда
Слабые кислоты: H2S, HF, CH3COOH, HNO2 (HnЭOm m-n<2)
Слабые основания: NH4OH, Me(OH)n (Me-  , кроме щелочных и щелочно земельных).
, кроме щелочных и щелочно земельных).
Слабые кислоты и основания диссоциируют обратимо, равновесно, по ступеням, причём каждая последующая ступень протекает слабее предыдущей. Количественно диссоциацию слабых электролитов выражают с помощью α:
- степень электролитической диссоциации, Kд - константа диссоциации (константа равновесия). Константа диссоциации - вид константы равновесия, которая показывает склонность к диссоциации.
•<<1 и Kд<1
Диссоциация протекает с участием полярных молекул Н2О. Чем их больше, тем в большей степени протекает диссоциация.
Диссоциация слабой кислоты:
1.Диссоциация CH3COOH происходит в 1 стадию:
CH3COOH↔CH3COO-+Н+; 
2.Дисоциация H3AsO4 протекает в 3 стадии:
1ст. H3AsO4↔H++ H2AsO4-
Кд1= C(H2AsO4-)×C(H+)/C(H3AsO4)=6×10-3 2ст. H2AsO4↔H++ HAsO4-2
Кд2=1×10-8
3ст. HAsO4↔H++ AsO4-3
Кg3=3×10-12
Кд1> Кд2 >Кд3>

α1> α2> α3
Диссоциация слабых оснований протекает аналогично
NH4OH↔NH4++OH-
Кд=1,7×10-5
Закон разбавления Оствальда.
Закон:  -степень электролитической диссоциации слабых электролитов, увеличивается при разбавлении раствора.
-степень электролитической диссоциации слабых электролитов, увеличивается при разбавлении раствора.
;
Со – исходные вещества;  – продиссоциированные вещества Со-
– продиссоциированные вещества Со-  - не диссоциированные вещества;
- не диссоциированные вещества; 
Константа диссоциации — вид константы равновесия, которая характеризует склонность объекта диссоциировать (разделяться) обратимым образом на частицы, как, например, когда комплекс распадается на составляющие молекулы, или когда соль диссоциирует в водном растворе на ионы.
16. Буферные системы: определение понятия, типии буферной системы. Буферная емкость и pН буферной системы Буферные системы — это биологические жидкости организма. Их защитная роль в поддержании нормального рН крови
чрезвычайно велика. Любая буферная система представляет собой смесь слабой кислоты и ее соли, образованной сильным основанием
Слабые кислоты и основания, в отличие от сильных (диссоциирующих практически полностью), распадаются на ионы в очень небольшой степени. Поэтому, например, в растворе слабой кислоты, можно выделить:
•общую кислотность – концентрация растворённой кислоты, которую можно определить титрованием раствором щёлочи до полной нейтрализации;
•активную кислотность – концентрации свободных протонов в растворе;
•потенциальную или резервную кислотность, заключённоую в недиссоциированных молекулах кислоты. Аналогично, слабые основания обладают тремя видами щёлочности.
Кроме того, слабые электролиты подчиняются закону разведения Оствальда, согласно которому степень диссоциа-
ции слабого электролита обратно пропорциональна корню квадратному из его концентрации:
α = 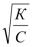 ,
,
где К – константа диссоциации, С – молярная концентрация; или прямо пропорциональна корню квадратному из его разведения:
α = |
, |
где V – разведение |
|
Как вы помните из курса средней школы, реакция среды в растворах солей определяется их способностью к гид- |
|
ролизу. Так, соли, образованные слабой кислотой и сильным основанием, подвергаясь гидролизу по аниону, смещают равновесие диссоциации воды в сторону образования гидроксид-анионов. Среда становится щелочной. Например:
СН3СОО- + Na+ + Н2О → СН3СООН + Na+ + ОН-
Соли, образованные слабым основанием и сильной кислотой, подвергаясь гидролизу по катиону, смешает равновесие диссоциации воды в сторону образования протонов.
Например: NН4+ + Сl- + Н2О → NН4ОН + H+ + Cl-
Буферные системы (БС) – водные растворы, препятствующие изменению рН при добавлении небольших количеств сильных кислот, оснований, а также при разбавлении и концентрировании.
Состав любой БС включает в себя 2 компонента в следующих вариантах: а) слабая кислота и её соль, образованная сильным основанием; б) слабое основание и его соль, образованная сильной кислотой.
Пример БС первого типа – ацетатный буфер: СН3СООН/СН3СОО-+Na+
где СН3СООН – слабая кислота, а СН3СОО-+Na+ - соль, образованная сильным основанием (NaOH). Пример БС второго типа – аммиачный буфер:
NH4OH/NH4+ + Cl-
где NH4OH – слабое основание, NH4+ + Cl- - его соль, образованная сильной кислотой (HCl).
Важнейшим компонентом БС является именно слабый электролит. Он обеспечивает резервную кислотность или основность.
Классификация кислотно-основных буферных систем:
Буферные системы могут быть четырех типов: 1. Слабая кислота и ее анион А- /НА:
ацетатная буферная система СН3СОО-/СН3СООН в растворе СН3СООNa и СН3СООН, область действия рН = 3,8-5,8. Водород-карбонатная система НСО3-/Н2СО3 в растворе NaНСО3 и Н2СО3, область её действия – рН = 5,4-7,4. 2. Слабое основание и его катион В/ВН+:
аммиачная буферная система NH3/NH4+ в растворе NH3 и NH4Cl, область ее действия – рН = 8,2-10, 2.
3. Анионы кислой и средней соли или двух кислых солей:
карбонатная буферная система СО32-/НСО3- в растворе Na2CO3 и NaHCO3, область ее действия рН = 9,3-11,3. фосфатная буферная система НРО42-/Н2РО4- в растворе Nа2НРО4 и NаН2РО4, область ее действия рН = 6,2-8,2. Эти солевые буферные системы можно отнести к 1-му типу, т.к. одна из солей этих буферных систем выполняет
функцию слабой кислоты. Так, в фосфатной буферной системе анион Н2РО4- является слабой кислотой.
4. Ионы и молекулы амфолитов. К ним относят аминокислотные и белковые буферные системы. Если аминокислоты или белки находятся в изоэлектрическом состоянии (суммарный заряд молекулы равен нулю), то растворы этих соединений не являются буферными. Они начинают проявлять буферное действие, когда к ним добавляют некоторое количество кислоты или щелочи. Тогда часть белка (аминокислоты) переходит из ИЭС в форму «белок-кислота» или соответственно в форму «белок-основание» Буферная ёмкость – это количество молей любой сильной кислоты или щёлочи, которое необходимо добавить к 1 л
буферного раствора для смещения его рН на 1. Буферная ёмкость тем выше, чем больше концентрация компонентов и чем ближе их соотношение к единице.
Буферная емкость зависит от ряда факторов:
1.Чем выше концентрации компонентов буферного раствора, тем больше его буферная емкость.
2.Буферная емкость зависит от отношения концентраций компонентов, а, следовательно, и от рН буфера. При рН=рКа буферная емкость максимальна.
3.Установлено, что достаточное буферное действие наблюдается, если концентрация одного из компонентов превышает концентрацию другого не более, чем в 10 раз.
Интервал рН=рКа±1 называется зоной буферного действия.
4.При разбавлении буферного раствора величина буферной емкости уменьшается вследствие снижения концентрации компонентов раствора.
17.Механизм действия буферных систем. Буферные системы крови
Механизм буферного действия рассмотрим на примере ацетатной БС: СН3СООН/СН3СОО- +Na+, где СН3СООН – слабая кислота, а СН3СОО-+Na+ - соль, образованная сильным основанием (NaOH). При добавлении:
а) сильной кислоты (избытка протонов) ацетат-анион связывает этот избыток протонов (т.е. проявляет свойства основания) с образованием эквивалентного количества слабой уксусной кислоты:
СН3СОО- + Н+ ↔ СН3СООН Несмотря на увеличение общей кислотности, активная кислотность вырастет мало, так как оно произошло за счёт
увеличения концентрации слабой кислоты, степень диссоциации которой понизится согласно закону Оствальда. б) сильного основания (щёлочи, избытка ОН--анионов) она нейтрализуется за счёт резервной кислотности: СН3СООН + ОН- ↔ СН3СОО- + Н2О.
Активная кислотность при этом изменяется незначительно, так как согласно закону Оствальда уменьшение концентрации слабой кислоты приводит к росту степени её диссоциации.
Обратите внимание, что катион металла, входящего в состав соли, не принимает участие в буферном действии. При разбавлении и концентрировании рН не изменяется, так как остаётся прежним соотношение компонентов БС
Буферные системы крови: гидрокарбонатная, фосфатная, гемоглобиновая, белковая Бикарбонатная (гидрокарбонатная) БС (Н2СО3/НСО3-) – мощная система плазмы крови, составляющая при-
мерно 10% от её общей буферной ёмкости. В норме соотношение компонентов (гидрокарбонат-анион / угольная кислота) равно 20.
Механизм действия бикарбонатной БС в организме аналогичен таковому ацетатной БС, с той лишь разницей, что при увеличении концентрации угольной кислоты, она интенсивно разлагается под действием фермента карбангидразы: Н2СО3 ↔ Н2О + СО2↑.
Образующийся при этом углекислый газ удаляется с выдыхаемым воздухом.
Фосфатная БС. Образована двумя ионами: гидро- и дигидрофосфат-анионами: НРО42-/Н2РО4- Первый из них выполняет роль соли, второй – слабой кислоты. На долю фосфатной БС приходится примерно 1%
буферной ёмкости крови. Механизм её действия аналогичен описанному выше.
Белковая БС имеет меньшее значение в поддержании рН. Благодаря амфотерным свойствам белков, состав белковой БС условно можно представить, как белок-кислоту (НООС–Pr–NH3+) и белок-основание (-ООС–Pr–NH2), где Pr – протеин (белок). При добавлении в систему протонов они последовательно будут связываться с оснόвными группами:
-ООС–Pr–NH2+ Н+ → -ООС–Pr–NH3+, -ООС–Pr–NH3+ + Н+ → НООС–Pr–NH3+.
При добавлении в систему гидроксид-ионов они последовательно будут нейтрализоваться протонами, отщепляющимися от кислотных групп:
НООС–Pr–NH3+ + ОН- → -ООС–Pr–NH3+ + Н2О, -ООС–Pr–NH3+ + ОН- → -ООС–Pr–NH2 + Н2О.
Гемоглобиновая БС – самая мощная в организме. Она действует в эритроцитах, обеспечивая примерно 76% буферной ёмкости крови. Она состоит из 2 сопряжённых кислотно-основных пар:
HHb и H++HbO2- K++Hb- и K++HbO2-,
где HHb – дезоксигемоглобин, K++Hb- - его калиевая соль; H++ HbO2- - оксигемоглобин, являющийся более сильной кислотой, чем дезоксигемоглобин, а K++HbO2- - калиевая соль оксигемоглобина. Действует гемоглобиновая БС согласованно в периферических тканях и лёгких. В лёгочных капиллярах при высоком парциальном давлении кислорода гемоглобин на 98% насыщается кислородом, образуя оксигемоглобин. Оксигемоглобин как более сильная кислота, чем угольная, вытесняет её из гидрокабонат-аниона, поступающего из периферических тканей. Выделившаяся угольная кислота под действием фермента карбангидразы разлагается на воду и углекислый газ, удаляемый с выдыхаемым воздухом:
HHb + О2 → H+ + HbO2-
H+ + HbO2- + К+ + НСО3- → K+ + HbO2- + Н2СО3; Н2СО3 →Н2О + СО2↑.
В капиллярах периферических тканей, при низком парциальном давлении кислорода последний освобождается и используется в процессах биологического окисления. Дезоксигемоглобин, будучи более слабой кислотой, чем угольная, образует молекулярную форму:
K++H++HbO2- → K+ + HHb + О2.
Источником протонов и гидрокарбонат-анионов является угольная кислота, образующаяся в периферических тканях из продуктов метаболизма – воды и углекислого газа. Следует обратить внимание, что гемоглобиновая БС является плазменно-клеточной и действует совместно с бикарбонатной.
18. Типы окислительно-восстановительных (редокс) реакций в организме Окислительно-восстановительными называются реакции, протекающие с изменением степени окисления двух
или более веществ.
Степень окисления – это условный заряд на атоме, если считать, что молекула создана по ионному механизму (или – это количество принятых или отданных электронов).
Восстановители – атомы, молекулы, ионы – отдающие электроны. Окислители - атомы, молекулы, ионы – принимающие электроны.
Восстановители участвуют в процессе окисления, повышая свою степень окисления. Окислители - участвуют в процессе восстановления, понижая свою степень окисления.
Виды окислительно-восстановительных реакций:
1.Межмолекулярные - реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах разных веществ, например:
Н2S + Cl2 → S + 2HCl
2.Внутримолекулярные - реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молеку-
лах одного и того же вещества, например:
2H2O → 2H2 + O2
3.Диспропорционирование (самоокисление-самовосстановление) - реакции, в которых один и тот же элемент выступает и как окислитель, и как восстановитель, например:
Cl2 + H2O → HClO + HCl
4.Репропорционирование (конпропорционирование, контрдиспропорционирование) - реакции, в которых из двух различных степеней окисления одного и того же элемента получается одна степень окисления:
Типы окислительно-восстановительных реакций в организме человека:
1.Реакция дегидрирования: SH2 + HAD+ → S + HADH+H+
2.Потеря электрона:O20 + 1e → O2-
3.Перенос 2Н+ от восстановленного субстрата на молекулярный кислород: SH2 + O20 +2e → S + H2O
4.Присоединение кислорода к субстрату: SH2 + ½O20 +2ē → HO-S-H
19.Строение комплексных соединений. Классификация и номенклатура Ко́мплексные соединения — частицы (нейтральные молекулы или ионы), которые образуются в результате
присоединения к данному иону (или атому), называемому комплексообразователем, нейтральных молекул или других ионов, называемых лигандами.
Классификация комплексных соединений
Существует несколько систем классификации комплексных соединений, которые основываются на различных принципах.
1. По знаку заряда комплекса:
1.Катионные комплексы образованы в результате координации вокруг положительного иона нейтральных молекул (H2O, NH3 и др.).
[Zn(NH3)4]Cl2 - хлорид тетраамминцинка (II) [Co(NH3)6]Cl2 - хлорид гексаамминкобальта (II)
2.Анионные комплексы: в роли комплексообразователя выступает атом с положительной степенью окисления, а лигандами являются простые или сложные анионы.
K2[BeF4] – тетрафторобериллат (II) калия Li[AlH4] – тетрадигдроалюминат (III) лития K3[Fe(CN)6] – гексацианоферрат (III) калия
3.Нейтральные комплексы образуются при координации молекул вокруг нейтрального атома, а также при одновременной координации вокруг положительного иона - комплексообразователя отрицательных ионов и молекул. [Ni(CO)4] – тетракарбонилникель
[Pt(NH3)2Cl2] – дихлородиамминплатина (II)
Комплексное соединение [Pt(NH3)2Cl2] внешней сферы не имеет и заряд комплекса равен 0.
2. По принадлежности комплексного соединения к определенному классу соединений:
Есть и вещества, не диссоциирующие на ионы, т.е. неэлектролиты
3. По природе лиганда:
-аквакомплексы (лигандом выступает вода: [Co(H2O)6]Cl2, [Al(H2O)6]Cl3 и др.),
-аммиакаты (лигандом выступает аммиак, например: [Cu(NH3)4]SO4, [Co(NH3)6]Cl3, [Pt(NH3)6]Cl4 и др.),
-ацидокомплексы (анионы - кислоты). К ним относятся комплексные соли: K2[PtCl4], комплексные кислоты:
H2[CoCl4], H2[SiF6].
-гидроксокомплексы (ОН), например: Na2[Zn(OH)4], Na2[Sn(OH)6] и др.
-карбонилы - комплексные соединения, в которых лигандами являются молекулы оксида углерода (II):
[Fe(CO)5], [Ni(CO)4].
-комплексы с макроциклическими лигандами, внутри которых размещается центральный атом (хлорофилл, гемоглобин, цианокобаламин).
4. По внутренней структуре комплекса:
-моноядерные – если комплекс содержит только один атом металла --комплексообразователя (пример, PdCl4 – имеет один атом палладия);
-многоядерные или полиядерные – если он содержит два или более атомов металла (комплекс платины [Pt2(NH3)2Cl4] – содержащий два атома платины.
Если полиядерные комплексы содержат атомы металла одинаковой химической природы, то они называются гомометаллическими:
Если же в полиядерном комплексе имеются атомы металла-комплексообразователя разной химической природы, то такие комплексы называются гетерометаллическими. Так, из двух биядерных комплексов:
Для комплексных соединений, содержащих во внутренней сфере различные лиганды, характерна геометрическая изомерия, когда при одинаковом составе внутренней сферы лиганды в ней располагаются по-разному относительно друг друга.
Геометрические изомеры комплексных соединений отличаются не только по физическим и химическим свойствам, но и биологической активностью. Цис-изомер Pt(NH3)2Cl2 имеет ярко выраженную противоопухолевую активность, а транс-изомер – нет.
Номенклатура комплексных соединений.
Название комплексных солей образуют по общему правилу: сначала называют анион, а затем – катион в родительном падеже
Названия комплексных соединений образуются аналогично названиям обычных солей с той лишь разницей, что указываются лиганды и степень окисления центрального атома. К названиям лигандов-анионов добавляют суффикс -о (сульфато-, хлоро-, бромо-, циано-, и т.д.). Наиболее важные лиганды-молекулы: Н2О - аква, NН3 - аммин, СО - карбонил.
Число монодентатных лигандов указывают греческими числительными: 1 - моно (часто не приводится), 2 - ди, 3 - три, 4 - тетра, 5 - пента, 6 - гекса. Для полидентатных лигандов (например, этилендиамин, оксалат) используют бис-, трис-, тетракис- и т.д.
Затем называют комплексообразователь, используя корень его латинского названия и окончание -ат (примеры: цинкат, хромат, феррат), после чего римскими цифрами указывают (в скобках) степень окисления комплексообразователя.
После обозначения состава внутренней сферы называют внешнюю сферу.
В названии нейтральных комплексных частиц комплексообразователь указывается в именительном падеже, а степень его не указывается, так как она однозначно определяется, исходя из электронейтральности комплекса.
Если присутствуют несколько лигандов, они перечисляются в алфавитном порядке и префиксы не изменяют этот порядок, например [CrCl2(H2O)4]+- тетрааквадихлорохром (III)-ион (хотя рекомендуют сначала указывать название отрицательно заряженных лигандов, а затем названия нейтральных молекул).
Примеры:
K3[Fe(CN)6] – гексацианоферрат (III) калия
(NH4)2[PtCl4(OH)2] – дигидроксотетрахлороплатинат (IV) аммония [Сr(H2O)3F3] - трифторотриаквахром
[Сo(NH3)3Cl(NO2)2] - динитритохлоротриамминкобальт [Pt(NH3)4Cl2]Cl2 - хлорид дихлоротетраамминплатины (IV) [Li(H2O)4]NO3 - нитрат тетрааквалития
20. Понятие о хелатных соединениях. Хелатообразующие лиганды, примеры
Хелатные комплексы – это циклические комплексные соединения, образуемые би- и полидентатными лигандами. Органические хелатообразующие лиганды широко используются в аналитической практике как осадители ионов металлов. Растворимость хелатных комплексов этого типа зависит прежде всего от свойств лигандов, заряда, устойчивости и структуры образующегося комплекса.
Предполагается, что в определении стереохимии значительная роль принадлежит лиганду, являющемуся партнером в образовании координационной связи. Координационное число иона металла по отношению к монодентатным лигандам определяется главным образомразмером лиганда и числом потенциальных донорных атомов. Детальная стереохимия для данного координационного числа в большинстве случаев зависит от требований иона металла (эффекты кристаллического поля) и в изменяющейся степени от стереохимии лиганда, хелатообразующих свойств и природы донорных
атомов, принимающих участие в образовании связи. |
|
Группу атомов (молекулу или ион), которая может связываться с одним и тем же |
ионом металла несколькими из |
своих атомов, называют хелатообразующей или полидентатным лигандом. Известны хелатообразующие агенты, координирующиеся двумя, тремя, четырьмя, пятью, шестью и даже восемью донорными атомами чаще всего встречаются агенты с двумя донорными атомами. Такие полидентатные лиганды называют соответственно би-, три-, тетра-, пента- и гексадентатными.
21. Представление о строении гемопротеидов ГЕМОПРОТЕИДЫ — сложные окрашенные белки, содержащие в качестве небелкового компонента гем. К
гемопротеидам относятся гемоглобин, миоглобин, некоторые окислительные ферменты Гемопротеиды, сложные белки, содержащие окрашенную простетическую группу - гем. Относятся
к хромопротеидам. Кроме дыхательных пигментов - гемоглобина и миоглобина, Г. включают широко распространённые дыхательные ферменты - цитохромы, и окислительные ферменты тканей - пероксидазу, катализирующую окисление органических веществ перекисью водорода, катализу и леггемоглобин (легоглобин) - пигмент, обнаруженный в корневых клубеньках бобовых растений.
22. Сорбция. Понятия адсорбции и абсорбции. Физическая и химическая адсорбция. Зависимость величины адсорбции от различных факторов
Благодаря поверхностному натяжению жидкость при отсутствии внешних силовых воздействий принимает форму шара, отвечающую минимальной величине поверхности и, следовательно, наименьшему значению свободной поверхностной энергии. Одним из путей понижения свободной поверхностной энергии является сорбция.
Сорбция (от лат. sorbeo – поглощаю) − поглощение твёрдым телом или жидкостью вещества из окружающей среды. Поглощающее тело называется сорбентом, поглощаемое им вещество − сорбатом (или сорбтивом). Различают поглощение вещества всей массой жидкого сорбента – это абсорбция; поверхностным слоем твёрдого или жидкого сор-
бента − это адсорбция.
Абсорбция − поглощение веществ из газовой смеси жидкостями. В технике абсорбция обычно пользуется для извлечения из газовой смеси какого-либо компонента. Абсорбция улучшается с повышением давления и понижением температуры.
Адсорбция − процесс концентрирования вещества из объема фаз на границе их раздела.
Адсорбент – вещество, способное адсорбировать другое вещество. Адсорбтив – вещество, которое может адсорбироваться. Адсорбат – адсорбированное вещество.
Процесс адсорбции является избирательным и обратимым. Адсорбция из растворов на твердом теле (имеющая поверхность раздела) бывает двух видов:
1.Молекулярная – адсорбция из растворов молекул слабых электролитов.
2.Ионная – это адсорбция из растворов ионов.
Десорбция − удаление адсорбированного вещества с поверхности адсорбента. Десорбция обратна адсорбции и происходит при уменьшении концентрации адсорбируемого вещества в среде, окружающей адсорбент.
Различают два вида адсорбции – физическая и химическая адсорбция. Физическая адсорбция вызвана Ван – дер
– ваальсовыми силами взаимодействия между молекулами адсорбата и адсорбента. Эти силы невелики и поэтому теплота физической адсорбции составляет ~ 10 – 30 кДж/моль. Химическая адсорбция, или хемосорбция, обязана химической связи, возникающей между адсорбатом и адсорбентом. При этом образуются поверхностные соединения. Теплота хемосорбции составляет ~ 100 – 400 кДж/моль, а сам процесс хемосорбции носит активационный характер. Молекулы адсорбата и адсорбента должны обладать энергией, которая превышает некоторое пороговое значение (энергия активации). Энергетические характеристики этих двух видов адсорбции и обуславливают их основные отличия

23. Дисперсные системы, их классификации
Дисперсные системы, рассматриваемые в коллоидной химии, гетерогенны, поэтому состоят как минимум из двух фаз. Одна из них является сплошной и называется дисперсионной средой. Другая фаза раздроблена и распределена в первой; её называют дисперсной фазой.
Наиболее общая классификация дисперсных систем основана на определении агрегатного состояния дисперсной фазы и дисперсионной среды. Сочетания трёх агрегатных состояний (твёрдое, жидкое и газообразное) позволяют выделить девять типов дисперсных систем (табл.6.1). Для краткости их условно обозначают дробью, числитель которой указывает на агрегатное состояние дисперсной фазы, а знаменатель – дисперсионной среды, например обозначение Т/Ж показывает, что система состоит из твёрдой дисперсной фазы и жидкой дисперсионной среды (твёрдое в жидкости).
Классификация дисперсных систем по агрегатному состоянию фаз
Дисперсионная |
Дисперсная |
Условное обозначение |
Название системы и примеры |
|
среда |
фаза |
системы |
||
|
||||
Твёрдая |
Твёрдая |
Т/Т |
Твёрдые гетерогенные системы: минералы, сплавы, бе- |
|
|
|
|
тон, композиционные материалы |
|
|
Жидкая |
Ж/Т |
Капиллярные системы: жидкость в пористых телах, ад- |
|
|
|
|
сорбентах; влажные почвы, грунты |
|
|
Газообразная |
Г/Т |
Пористые тела: адсорбенты и катализаторы |
|
Жидкая |
Твёрдая |
Т/Ж |
Суспензии и золи: промышленные суспензии, пульпы, |
|
|
|
|
взвеси, пасты, илы |
|
|
Жидкая |
Ж/Ж |
Эмульсии: природная нефть, кремы, молоко |
|
|
Газообразная |
Г/Ж |
Газовые эмульсии и пены |
|
Газообразная |
Твёрдая |
Т/Г |
Аэрозоли: пыли, дымы. |
|
|
|
|
Порошки |
|
|
Жидкая |
Ж/Г |
Аэрозоли: туманы, в том числе промышленные облака |
|
|
Газообразная |
Г/Г |
Коллоидная система не образуется |
Все дисперсные системы также можно разделить на два класса по кинетическим свойствам дисперсной фазы: свободнодисперсные системы, в которых дисперсная фаза подвижна, и связнодисперсные системы – системы с твердообразной дисперсионной средой, в которой частицы дисперсной фазы не могут свободно перемещаться.
И еще эти системы классифицируют по степени дисперсности. Свободнодисперсные системы подразделяют на ультрамикрогетерогенные, размер частиц которых лежит в пределах от 10-9 до 10-7 м (от 1 до 100 нм), микрогетерогенные с размером частиц от 10-7 до 10-5 м (от 0,1 до 10 мкм) и грубодисперсные с частицами, размеры которых превышают 10-
5 м.
24. Грубодисперсные системы: классификация, применение в медицине
Грубодисперсные системы делятся на три группы: эмульсии, суспензии и аэрозоли.
Эмульсии – это дисперсные системы с жидкой дисперсионной средой и жидкой дисперсной фазой. Их можно также разделить на две группы:
1.прямые – капли неполярной жидкости в полярной среде (масло в воде);
2.обратные (вода в масле).
Изменение состава эмульсий или внешнее воздействие могут привести к превращению прямой эмульсии в обратную и наоборот. Примерами наиболее известных природных эмульсий являются молоко (прямая эмульсия) и нефть (обратная эмульсия). Типичная биологическая эмульсия – это капельки жира в лимфе. В химической технологии широко используют эмульсионную полимеризацию как основной метод получения каучуков, полистирола, поливинилацетата и др.
Суспензии – это грубодисперсные системы с твердой дисперсной фазой и жидкой дисперсионной средой.
Особую группу составляют грубодисперсные системы, в которых концентрация дисперсной фазы относительно высока по сравнению с ее небольшой концентрацией в суспензиях. Такие дисперсные системы называют пастами. Например, вам хорошо известные из повседневной жизни зубные, косметические, гигиенические и др.
Аэрозоли – это грубодисперсные системы, в которых дисперсионной средой является воздух, а дисперсной фазой могут быть капельки жидкости (облака, радуга, выпущенный из баллончика лак для волос или дезодорант) или частицы твердого вещества (пылевое облако, смерч).
Коллоидные системы занимают промежуточное положение между грубодисперсными системами и истинными растворами. Они широко распространены в природе. Почва, глина, природные воды, многие минералы, в том числе и некоторые драгоценные камни, – все это коллоидные системы. Большое значение имеют коллоидные системы для биологии и медицины. В состав любого живого организма входят твердые, жидкие и газообразные вещества, находящиеся в сложном взаимоотношении с окружающей средой. С химической точки зрения организм в целом – это сложнейшая совокупность многих коллоидных систем.
Коллоидные системы подразделяют на золи (коллоидные растворы) и гели (студни).
Большинство биологических жидкостей клетки (цитоплазма, ядерный сок – кариоплазма, содержимое вакуолей) и живого организма в целом являются коллоидными растворами (золями).
Для золей характерно явление коагуляции, т.е. слипания коллоидных частиц и выпадение их в осадок. При этом коллоидный раствор превращается в суспензию или гель. Некоторые органические коллоиды коагулируют при нагревании (яичный белок, клеи) или при изменении кислотно-основной среды (пищеварительные соки).
Гели – это коллоидные системы, в которых частицы дисперсной фазы образуют пространственную структуру. Гели – это дисперсные системы, которые встречаются вам в повседневной жизни.
Со временем структура гелей нарушается – из них выделяется жидкость. Происходит синерезис – самопроизвольное уменьшение объема геля, сопровождающееся отделением жидкости. Синерезис определяет сроки годности пищевых, медицинских и косметических гелей. Очень важен биологический синерезис при приготовлении сыра, творога.
25. Коллоидные растворы: строение коллоидной частицы, устойчивость коллоидных систем. Факторы, влияющие на устойчивость коллоидных систем. Коагуляция Коллоидная частица не имеет определенного состава, поэтому ее строение может быть изображено лишь схематически.
Рассмотрим образование золя и строение его частиц на примере иодида свинца PbI2. Уравнение реакции имеет вид:
Pb2+ + 2I— = PbI2
Образование золя возможно, если к раствору Pb(NO3)2 постепенно прибавлять раствор KI или если к раствору KI постепенно прибавлять раствор Pb(NO3)2. При этом строение коллоидных частиц будет отличаться.
1. Предположим, что золь PbI2 образуется при постепенном прибавлении раствора KI к раствору Pb(NO3)2. Вначале образуется агрегат (PbI2)m из ионов Pb2+ и I—.
Далее на поверхности агрегата адсорбируются ионы, входящие в его состав и находящиеся в растворе в избытке. В нашем примере это ионы свинца.
В результате этого, агрегат (PbI2)m с адсорбированным слоем Pb2+ приобретает положительный заряд. Адсорбированные на поверхности агрегата ионы и придающие ему заряд, называются потенциалопределяющими. А сам агрегат (PbI2)m с потенциалопределяющими ионами Pb2+, образуют ядро.
Далее, к ядру притягиваются противоположно заряженные ионы – противоионы, которые компенсируют заряд твердой фазы и образуют адсорбционный слой. Противоионами будут служить, ионы содержащиеся в растворе, но не входящие в состав агрегата. В данном примере – это нитрат-ионы NO3–.
Ядро и противоионы адсорбционного слоя образуют коллоидную частицу или гранулу, знак которой определяется знаком заряда потенциалопределяющих ионов. Те же противоионы (NO3–), образуют и диффузный слой. По мере удаления от ядра, их содержание постепенно снижа-
ется. |
|
|
|
|
|
|
|
Коллоидная частица вместе с противоионами диффузного слоя называется мицеллой. |
|
|
|||||
Мицела |
в |
целом |
электронейтральна |
и не |
имеет строго |
определенных |
размеров. |
Агрегат сравнительно прочно удерживает (связывает) противоионы адсорбционного слоя, а противоионы диффузного слоя испытывают действие электростатического притяжения разноименно заряженных ионов, удерживающее их вблизи ядра, и броуновского движения, стремящегося распределить их в дисперсионной среде.
Устойчивость коллоидных систем связана с зарядом поверхности (первичная устойчивость) и с эффектом отталкивания коллоидных частиц (вторичная устойчивость). Первичная устойчивость определяется общим потейциалом частиц твердого вещества, вторичная — в основном электрокинетическим потенциалом. Лиофильные коллоидные системы более устойчивы, чем лиофобные.
Фактором, вызывающим коагуляцию, может быть любой агент, нарушающий агрегативную устойчивость системы, например изменение температуры (сильное нагревание или охлаждение вплоть до замораживания), механическое воздействие (интенсивное встряхивание, перемешивание, перекачивание по трубам), действие света и различного рода излучений, действие электрических разрядов. Однако наиболее важным фактором является действие электролитов. Электролиты, добавляемые к золям, чрезвычайно быстро и резко влияют на толщину ДЭС и на -потенциал, являющийся одним из главных факторов устойчивости гидрофобных коллоидных систем.

Коагуляцией называется процесс слипания коллоидных частиц с образованием более крупных агрегатов из-за потери коллоидным раствором агрегативной устойчивости.
В результате коагуляции укрупненные частицы дисперсной фазы легко седиментируют, и происходит расслоение системы. Таким образом, причиной коагуляции является потеря агрегативной устойчивости коллоидным раствором, а следствием коагуляции - уменьшение его седиментационной устойчивости.
Практически коагуляцию можно вызвать различными внешними воздействиями: добавлением небольших количеств электролита, концентрированием коллоидного раствора, изменением температуры, действием ультразвука, электромагнитного поля и др.
Явление коагуляции лежит в основе многих патологических процессов, протекающих в живых системах. Коагуляция коллоидных растворов фосфата кальция и холестерина в крови приводит к образованию осадков и отложению их на внутренней поверхности кровеносных сосудов (атеросклеротические изменения сосудов).
Коагуляция проявляется в процессе свертывания крови. Свертывание крови играет в организме две противоположные роли: с одной стороны, уменьшает потерю крови при повреждении ткани, с другой - вызывает образование тромбов в кровеносной системе. Свертывание крови - очень сложный ферментативный процесс. Одновременно в крови действует антисвертывающая система, основой которой является гепарин - антикоагулянт крови.
26. Роль дисперсных систем в организме
ОТВЕТЫ НА ЭКЗАМЕНАЦИОННЫЕ ВОПРОСЫ ПО ХИМИИ «ОРГАНИЧЕСКАЯ ХИМИЯ»
1 КЛАССИФИКАЦИЯ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ ПО ЧИСЛУ И ТИПУ ФУНКЦИОНАЛЬНЫХ ГРУПП
БИОЛОГИЧЕСКИ ВАЖНЫЕ КЛАССЫ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ, ПРИМЕРЫ.
Название класса соеди- |
Функциональная группа |
Пример соединения: |
Название соединения: |
нений: |
или наличие кратной |
|
|
|
связи: |
|
|
Алканы, СпН2п+2 |
Все связи С-С одинар- |
СН3-СН3 |
Этан |
|
ные |
|
|
Алкены, СпН2п |
Одны двойная связь |
СН2=СН2 |
Этен (этилен) |
|
С=С |
|
|
Алкины, СпН2п-2 |
Одны тройная связь |
СН≡СН |
Этин (ацетилен) |
|
С≡С |
|
|
Алкадиены, СпН2п-2 |
Две двойные связи |
СН2=СН-СН=СН2 |
Бутадиен-1,3 |
Спирты |
-ОН гидроксильная |
СН3-СН2-ОН |
Этанол |
Простые эфиры |
-О- оксигруппа |
СН3-СН2-О-СН2-СН3 |
Диэтиловый эфир, |
|
|
|
этоксиэтан |
Альдегиды |
-СОН карбонильная |
СН3-СОН |
Уксусный альдегид, |
|
|
|
этаналь |
Кетоны |
-(С=О)- |
СН3-(С=О)-СН3 |
Ацетон, пропанон |
Карбоновые кислоты |
-СООН карбоксильная |
СН3-СООН |
Уксусная кислота, |
|
|
|
этановая кислота |
Сложные эфиры |
-(С=О)-О- |
СН3-(С=О)-О-СН3 |
Метиловый эфир ук- |
|
|
|
сусной кислоты, мети- |
|
|
|
лацетат |
|
|
|
|
Аминокислоты — биологически важные соединения. Аминокислоты образуются при гидролизе белков.
2. КЛАССИФИКАЦИЯ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ ПО РАДИКАЛУ, НОМЕНКЛАТУРА.
Органические вещества:
1.Ациклические: алканы (предельные), алкены и алкины (непредельные)
2.Гетероциклические:
3. Карбоциклические
По радикалу 2 По строению углеродного скелета органические соединения делятся на: а) ациклические (алифатические), в которых
цепь атомов углерода может быть неразветвленной и разветвленной: СН3 – СН2 – СН2 – СН3 СН3 – СН – СН2 – СН3
CH3
б) карбоциклические соединения, в составе циклов которых только атомы углерода
В) гетероциклические соединения, которые кроме атомов углерода в циклическом скелете содержат один или несколько гетероатомов (лат. гетерос – иной, другой): азот, кислород, серу

Внастоящее время признана систематическая номенклатура ИЮПАК (IUРАС – Международный союз теоретической и прикладной химии). Среди вариантов систематических номенклатур, рекомендуемых ИЮПАК, наиболее рас-
пространенной является заместительная номенклатура.
По правилам ИЮПАК название органического соединения строится из названия главной цепи, образующего корень слова, и названий функций, используемых в качестве приставок или суффиксов.
Для правильного построения названия необходимо провести выбор главной цепи и нумерацию атомов углерода в ней.
Взаместительной номенклатуре название соединения представляет собой составное слово, корень которого включает название родоначальной структуры. Названия заместителей обозначаются префиксами (приставками) и суффиксами.
Некоторые характеристические группы, а именно галогены, нитро- и алкоксигруппы, отражаются в общем названии только в виде префиксов, например, бромметан, этоксиэтан, нитробензол.
Нумерацию атомов углерода в главной цепи начинают с того конца цепи, ближе к которому расположена старшая группа. Если таких возможностей оказывается несколько, то нумерацию проводят таким образом, чтобы либо кратная связь, либо другой заместитель, имеющийся в молекуле, получили наименьший номер.
В карбоциклических соединениях нумерацию начинают от того атома углерода, при котором находится старшая характеристическая группа. Если при этом невозможно выбрать однозначную нумерацию, то цикл нумеруют так, чтобы заместители имели наименьшие номера.
3 ИЗОМЕРИЯ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ, СТРУКТУРНАЯ ИЗОМЕРИЯ, ЕЕ ВИДЫ Изомерия – существование разных веществ с одинаковой молекулярной формулой. Данное явление обусловлено тем, что одни и те же атомы могут по-разному соединяться друг с другом.
Структурными называют изомеры, отвечающие различным структурным формулам органических соединений.
Структурные изомеры.
Выделяют три группы:
1)соединения, содержащие различные функциональные группы и относящиеся к различным классам органических соединений, например:
2)соединения, отличающиеся углеродными скелетами:
3)соединения, отличающиеся положением заместителя или кратной связи в молекуле:
4 ПРОСТРАНСТВЕННАЯ ИЗОМЕРИЯ, КОНФИГУРАЦИЯ И КОНФОРМАЦИЯ.

Изомеры – соединения с одинаковым составом, но отличающиеся природой или последовательностью связей между атомами и расположением их в пространстве.
Структурные изомеры отличаются по химическому строению – бутан/изобутан(2 метил пропан), пентен 1/циклопентан. Структурные изомеры:
*Цепи (бутан/изобутан)
*Положения кратных связей (бутен1/бутен2) *Положения ф-циональных групп (пропанол1/пропанол2)
*Изомеры ф-циональных групп (пропаналь/пропанон(ацетон)
Конфигурация – определенное пространственное расположение атомов в молекуле. Например, метан имеет форму тетраэдра.
Конформация (от лат. conformatio — форма, построение, расположение) молекул, геометрические формы, которые могут принимать молекулы органических соединений при вращении атомов или групп атомов (заместителей) вокруг простых связей при сохранении неизменными порядка химической связи атомов (химического строения), длины связей и валентных углов. Молекулы, отличающиеся только своими конформациями, называются конформерами, или поворотными изомерами. Существование конформации обусловлено пространственным взаимодействием (например, отталкиванием, притяжением, образованием водородных связей) не связанных между собой заместителей, в т. ч. и атомов водорода. Примером могут служить несколько плоских конформации молекул пентана: CH3—CH2—CH2— CH2—CH3
Стереоизомерия
Стереоизомерами называются изомеры, различающиеся только расположением атомов и групп атомов в пространстве, отличия обусловены различной конфигурацией/конформацией молекул.
Конфигурационные изомеры – стереоизомеры с различным пространственным расположением атомов или групп атомов в пространстве без учета возможных конформаций.
Конформационные изомеры – стереоизомеры, различие между которыми вызвано поворотом отдельных участков молекулы вокруг одинарных связей.
Хиральность - свойство молекулы не совмещаться в пространстве со своим зеркальным отражением.
Энантиомеры – стереоизомеры, молекулы которых относятся между собой как предмет и несовместимое с ним зеркальное изображение, имеют одинаковые физ/хим свойства.
Диастереомеры – стереоизмеры, не являющиеся зеркальным изображением один другого и имеющие различные физ/хим свойства.
5.АССИММЕТРИЧЕСКИЙ АТОМ УГЛЕРОДА КАК ЦЕНТР ХИРАЛЬНОСТИ. СТЕРЕОИЗОМЕРИЯ МОЛЕКУЛ С ОДНИМ ЦЕНТРОМ ХИРАЛЬНОСТИ. ОПТИЧЕСКАЯ АКТИВНОСТЬ.
Хиральный центр -это атом в молекуле, замещенный таким образом, что он становится несовместимым со своим зеркальным отражением. Атом углерода является центром хиральности только в том случае, когда имеет четыре различных заместителя.
Энантиомеры способны вращать плоскость поляризации света, т.е. обладают оптической активностью
Типичным примером пары энантиомеров с 1 центром хиральности является 2-гидроксипропановая кислота – CH3- *CHOH-COOH. В молекуле этого соединения содержится 1 асимметрический атом углерода.
6.ПРОЕКЦИОННЫЕ ФОРМУЛЫ ФИШЕРА. АБСОЛЮТНАЯ КОНФИГУРАЦИЯ СТЕРЕОИЗОМЕРОВ. D/L СТЕРЕОХИМИЧЕСКИЕ РЯДЫ.
Для условного изображения асимметрического атома на плоскости пользуются проекционными формулами Э.Фишера. Их получают, проецируя на плоскость атомы, с которыми связан асимметрический атом. При этом сам асимметрический атом, как правило, опускают, сохраняя лишь перекрещивающиеся линии и символы заместителей. Чтобы помнить о пространственном расположении заместителей, часто сохраняют в проекционных формулах прерывистую вертикальную линию (верхний и нижний заместитель удалены за плоскость чертежа), однако часто этого не делают. Ниже приведены различные способы записи проекционной формулы, отвечающей левой модели на предыдущем рисунке:
Для того чтобы сопоставлять "нестандартно" написанные проекционные формулы, надо знать следующие правила преобразования проекционных формул.
1.Формулы можно вращать в плоскости чертежа на 180о, не меняя их стереохимического смысла:
2.Две (или любое четное число) перестановки заместителей у одного асимметрического атома не меняют стереохимического смысла формулы:
3.Одна (или любое нечетное число) перестановок заместителей у асимметрического центра приводит к формуле оптического антипода:
4.Поворот в плоскости чертежа на 90о превращает формулу в антиподную, если только при этом одновременно не изменить условие расположения заместителей относительно плоскости чертежа, т.е. не считать, что теперь боковые заместители находятся за плоскостью чертежа, а верхний и нижний - перед ней. Если пользоваться формулой с пунктиром, то изменившаяся ориентация пунктира прямо напомнит об этом:
5.Вместо перестановок проекционные формулы можно преобразовывать путем вращения любых трех заместителей по часовой стрелке или против нее; четвертый заместитель при этом положения не меняет (такая операция эквивалентна двум перестановкам):
6.Проекционные формулы нельзя выводить из плоскости чертежа.
D.L-Система обозначения конфигурации. В начале ХХ в. была предложена система классификации энантиомеров для относительно простых (с позиций стереоизомерии) молекул, таких, как α-аминокислоты, α-гидроксикислоты и им подобные. За конфигурационный стандарт был принят глицериновый альдегид. Его левовращающему энантиомеру была произвольно приписана формула (I). Такая конфигурация атома углерода была обозначена буквой l (от лат. laevus - левый).
Правовращающему энантиомеру соответственно была приписана формула (II), а конфигурация обозначена буквой d (от лат. dexter - правый).
Заметим, что в стандартной проекционной формуле l-глицеринового альдегида группа ОН находится слева, а у d- глицеринового альдегида - справа.
Отнесение к d- или l-ряду других родственных по структуре оптически активных соединений производится путем сравнения конфигурации их асимметрического атома с конфигурацией d- или l-глицеринового альдегида. Например, у одного из энантиомеров молочной кислоты (I) в проекционной формуле группа ОН находится слева, как у l-глицеринового альдегида, поэтому энантиомер (I) относят к l-ряду. Из тех же соображений энантиомер (II) относят к d-ряду. Так из сравнения проекций Фишера определяют относительную конфигурацию.
Следует отметить, что l-глицериновый альдегид имеет левое вращение, а l-молочная кислота - правое (и это не единичный случай). Более того, одно и то же вещество может быть как лево-, так и правовращающим в зависимости от условий определения (разные растворители, температура).
Знак вращения плоскости поляризованного света не связан с принадлежностью к d- или l-стереохимическому ряду. Практическое определение относительной конфигурации оптически активных соединений проводят с помощью химических реакций: либо исследуемое вещество превращают в глицериновый альдегид (или другое вещество с известной относительной конфигурацией), либо, наоборот, из d- или l-глицеринового альдегида получают исследуемое вещество. Разумеется, что в ходе всех этих реакций не должна изменяться конфигурация асимметрического атома углерода. Произвольное приписание лево- и правовращающему глицериновому альдегиду условных конфигураций было вынужденным шагом. В то время абсолютная конфигурация не была известна ни для одного хирального соединения. Установление абсолютной конфигурации стало возможным только благодаря развитию физико-химических методов, особенно рентгеноструктурного анализа, с помощью которого в 1951 г. впервые была определена абсолютная конфигурация хиральной молекулы - это была соль (+)-винной кислоты. После этого стало ясно, что абсолютная конфигурация d- и l- глицериновых альдегидов действительно такая, какая им была первоначально приписана.
7.ЭЛЕКТРОННОЕ СТРОЕНИЕ АТОМА УГЛЕРОДА. ТИПЫ ГИБРИДИЗАЦИЙ АТОМНЫХ ОРБИТАЛЕЙ.
8.СОПРЯЖЕННЫЕ СИСТЕМЫ С ОТКРЫТОЙ И ЗАМКНУТОЙ ЦЕПЬЮ НА ПРИМЕРАХ БУТАДИЕНТА 1,3 И БЕНЗОЛА.)
Углерод, входящий в состав органических соединений, проявляет постоянную валентность. На последнем энергетическом уровне атома углерода содержится 4 электрона, два из которых занимают 2s-орбитали, имеющие гантелеподобную форму.При возбуждении один электрон из 2s-орбитали может переходить на одну из вакантных 2р-орбитали. Этот переход требует некоторых энерго. затрат. В результате возбужденный атом углерода имеет 4 неспаренных электрона и его электронная конфигурация выражается формулой 2s12р3.
Типы гибридизации:
sр3-гибридизация (первое валентное состояние углерода): химические связи образуют альфа связи (сигма-связи), форма молекулы в пространствететраэдр.
sр2-гибридизация (второе валентное состояние углерода): присутствует двойная связь sр-гибридизация (третье валентное состояние углерода): присутствует тройная связь
Сопряжение – это образование в молекуле единого делокализованного электронного облака в результате перекрывания негибридизованных р –орбиталей.
Пи,пи-сопряжение: Деколализованные молекулярные облака принадлежат двум или более пи-связям. Условия пи,пи-сопряжения:
• кратные связи должны быть разделены ОДНОЙ простой связью
• Максимальное сопряжение достигается, когда обе кратные связи лежат в одной плоскости
• Если по пространственным соображениям две кратные связи не могут лежать в одной плоскости, то сопряжение между ними уменьшается с увеличением угла между плоскостями этих связей р,пи-сопряжение: сопряжение пи-связи и соседней р-орбитали, содержащей пару электронов: С=С-•Х• Условия р,пи-сопряжения:
• Атом, несущий свободную электронную пару должен быть отделен от кратной связи одной простой связью
• Наибольшей величины сопряжение достигает, если р-атомное облако перпендикулярно плоскости двойной связи
• Сопряжение невозможно, если р-атомное облако лежит в плоскости двойной связи
• Участие атома С в р,пи-сопряжении с кратной связью возможно только в том случае, еси он превратится в радикал, катион или анион Сопряжение с открытой цепью (бутадиен):
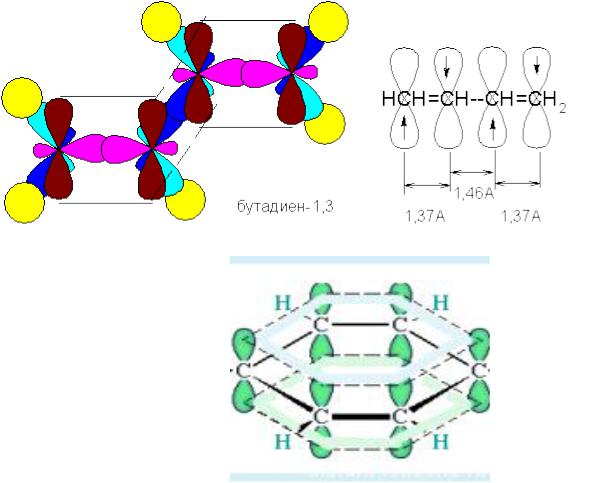
СН2=СН-СН=СН2
Сопряжение с открытой цепью (бензол): |
C6H6 |
9. АРОМАТИЧНОСТЬ. КРИТЕРИИ АРОМАТИЧНОСТИ. |
|
Ароматичность – понятие, характеризующее совокупность особых структурных, энергетических и магнитных свойств, а также особенностей реакционной способности циклических структур с системой сопряженных связей. Ароматичность понимается через совокупность особых признаков (критериев), присущих ряду циклических сопряженных молекул в той или иной мере. Часть этих критериев имеет экспериментальную, наблюдаемую природу, но другая часть основывается на квантовой теории строения молекул.
Для того чтобы молекула могла быть ароматической, она должна содержать хотя бы один цикл, каждый из атомов которого располагает пригодной для образования ароматической системы р-орбиталью. Ароматическим в полном смысле этого слова считается (в случае выполнения критериев, перечисленных ниже) именно этот цикл (кольцо, система колец). В этом цикле должно быть 4n+2 (то есть 2, 6, 10, 14, 18, 22 и т.п.) p-электронов.
Это правило называется правилом или критерием ароматичности Хюккеля.
Критерии ароматичности:
•Энергетический критерий (повышение термодинамической устойчивости за счет делокализации электронов)из всех самый неудобный и неясный. Никогда нельзя сравнивать разные ароматические системы по величине энергий делокализации – нельзя сделать вывод, что молекула А ароматичнее молекулы В, потому что энергия делокализации больше.
•Структурный – очень важный, если не самый важный, критерий, так как имеет не теоретическую, а экспериментальную природу. Специфика геометрии молекул ароматических соединений заключается в тенденции к копланарному расположению атомов и выравниванию длин связей. Тенденция к копланарности обуславливается выгодностью параллельного расположения осей атомных р-орбиталей для их эффективного перекрывания.
•Магнитный (наличие кольцевого тока – диатропная система, влияние на химические сдвиги протонов снаружи и внутри кольца, примеры – бензол и [18]-аннулен). Самый удобный и доступный критерий, так как для его оценки достаточно спектра 1H ЯМР.
•Химический – склонность к реакциям замещения, а не присоединения. Самый наглядный критерий, ясно различающий химию ароматических соединений от химии полиенов.
Пиридин:
Из трех гибридных орбиталей атома азота две образуют альфа-связи С-N, а третья содержит неподеленную пару электронов, которые не участвуют а пи-электронной системе.
2HC≡CH + HC≡N C5H5N.
•свойство ароматического соединения
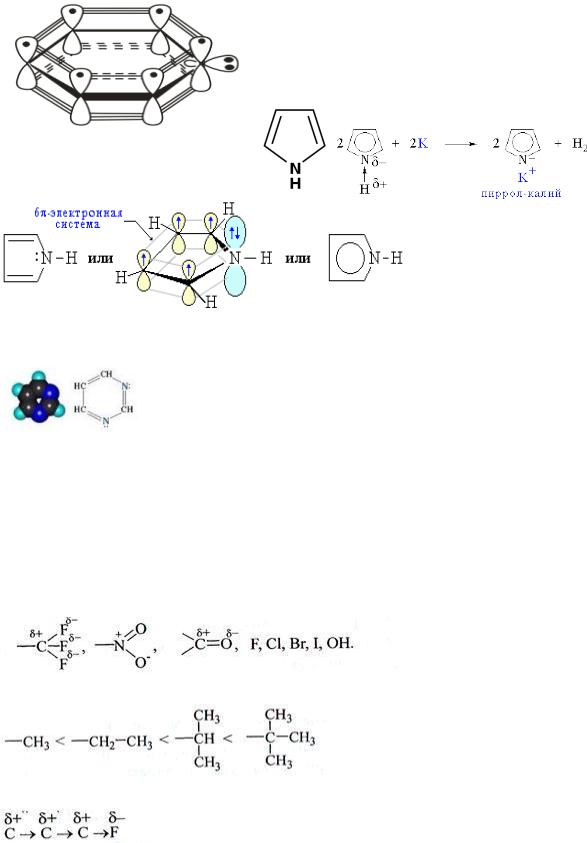
•свойства кислоты
Пиррол:
На негибридной р-орбитали азота находится неподеленная пара электронов, которые вступают в сопряжение с четырьмя р-электронами атомов С. В циклической системе сопряжения находится 6 электронов, что определяет ароматические свойства пиррола.
•свойство ароматического соединения
•свойства кислоты
Пиримидин С4Н4N2 – шестичленный гетероцикл с двумя атомами азота.
Проявляет свойства очень слабого основания, т.к. атомы азота в sp2гибридизованном состоянии довольно прочно удерживают неподеленную электронную пару. Для пиримидина, подобно пиридину, характерна 6∏-электронная ароматическая система. Поэтому его цикл обладает повышенной устойчивостью.
10. ЭЛЕКТРОННЫЕ ЭФФЕКТЫ ЗАМЕСТИТЕЛЕЙ: ИНДУКТИВНЫЙ И МЕЗОМЕРНЫЙ. ЭЛЕКТРОДОНОРНЫЕ И ЭЛЕКТРОАКЦЕПТОРНЫЕ ЗАМЕСТИТЕЛИ И ИХ ВЛИЯНИЕ НА РЕАКЦИОННУЮ СПОСОБНОСТЬ СОЕДИНЕНИЙ.
Взаимное влияние, передающееся по цепи σ-связей, называется индуктивным эффектом(I) атома или группы, а передающееся по цепи π-связей -мезомерным эффектом(M).
Заместители проявляют отрицательный индуктивный эффект (-I), если они смещают к себе электронную плотность σ-связи от атома углерода сильнее, чем водород. Таким свойством обладают группы, содержащие полярные связи, и атомы более электроотрицательные, чем углерод:
Заместители характеризуются положительным индуктивным эффектом (+I), если они отталкивают электронную плотность σ-связи к углероду. +I проявляют металлы I-III групп периодической системы и алкильные группы:
Индуктивный эффект быстро убывает с расстоянием, «затухает» по цепи, исчезая через 2-3 σ-связи. Наибольшее ин-
дуктивное влияние заместители оказывают на соседний (α) углеродный атом.
Мезомерный эффект – это перераспределение электронной плотности в сопряженных π,π- (и π,р)-системах. В соответствии с квантовохимической моделью сопряжением (или мезомерией) называют образование общей π-системы.
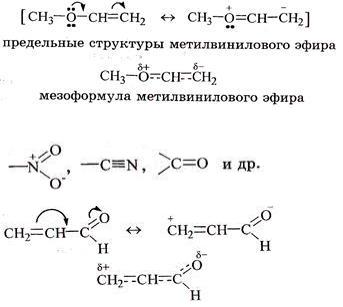
Положительный мезомерный эффект (+М) проявляют атомы азота, кислорода и галогенов, непосредственно связан-
ные с ненасыщенными атомами углерода.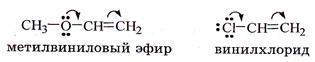
Отрицательный мезомерный эффект (-М) проявляют заместители, имеющие π-связи между атомами с различной электроотрицательностью:
Например, в непредельном альдегиде имеет место π,π-сопряжение и электронная плотность смещена к атому кислорода:
Мезомерный эффект передается по цепи сопряженных связей без затухания.
Поляризация химической связи — асимметрия (смещение) электронной плотности, связывающей молекулярной орбитали ковалентной связи.
Электронодонорные заместители проявляют +М и +I-эффект и повышают электронную плотность в сопряженной системе. К ним относятся гидроксильная группа -ОН и аминогруппа -NH2. Не-поделенная пара электронов в этих группах вступает в общее со-пряжение с p-электронной системой бензольного кольца и увеличивает длину сопряженной системы. В результате электронная плотность сосредотачивается в орто- и пара-положениях.
Алкильные группы не могут участвовать в общем сопряжении, но они проявляют +I-эффект, под действием которого происходит аналогичное перераспределение p-электронной плотности.
Электроноакцепторные заместители проявляют -М-эффект и снижают электронную плотность в сопряженной системе. К ним относятся нитрогруппа -NO2, сульфогруппа —SO3H, альдегидная —СНО и карбоксильная —СООН группы. Эти заместители образуют с бензольным кольцом общую сопряженную систему, но общее электронное облако смещается в сторону этих групп. Таким образом, общая электронная плотность в кольце уменьшается, причем меньше всего она уменьшается в метаположениях.
11. ГОМО/ГЕТЕРОЛИТИЧЕСКИЕ РАЗРЫВЫ КОВАЛЕНТНОЙ СВЯЗЫ В ОРГАНИЧЕСКИХ СОЕДИНЕНИЯХ, ОБРАЗУЮЩИЕСЯ ПРИ ЭТОМ ЧАСТИЦЫ.
Гомолитический( радикальный) тип разрыва характерен для неполярных или малополярных ковалентных связей при воздействии высокой температуры, электромагнитного неионизирующего излучения(ультрафиолетовое, рентгеновское) или других свободных радикалов ; приводит к образованию активных частиц радикалов .
Примерами радикальных реагентов являются атомы галогенов Br•, Cl •, гидроксильные, НО•, гидропероксильные НОО•, алкилпероксильные ROO•, алкильные R•.
Радикал ( R• )- частица вещества, имеющая неспаренный электрон. Радикалы могут быть нейтральными или заря-
женными частицами. При гомолитическом разрыве общая электронная пара связи разрывается поровну( по одному электрону на каждую новую частицу).
Гетеролитический(ионный) тип разрыва характерен для полярных ковалентных связей . Общая электронная пара переходит на орбиталь более электроотрицательного атома, частица приобретает отрицательный заряд. Атом, потерявший свой электрон, приобретает свободную орбиталь и положительный заряд.
12. РАДИКАЛЬНЫЕ, ЭЛЕКТРОФИЛЬНЫЕ, НУКЛЕОФИЛЬНЫЕ РЕАГЕНТЫ, КЛАССИФИКАЦИЯ ХИМ РЕАКЦИЙ ПО ТИПУ РЕАГЕНТА.
Электрофилы – частицы, образующие новые ковалентные связи за счет пары электронов партнеров (обозначаются символом Е+). Электрофильными реагентами являются: положительно заряженные ионы Н+, Br+, Cl+, NO2+, ≡C+; нейтральные молекулы, имеющие электронодефицитный центр: SO3, ≡Cδ+→X, кислоты Льюиса (FeBr3, AlCl3, BF3). Нуклеофилы – это частицы, образующие новые ковалентные связи, предоставляя партнеру пару электронов (обозначаются символами: Nu или Nu–). Нуклеофильными реагентами являются: отрицательно заряженные ионы: Br–, Cl–, HO–,
HS–, RO–, RS–; нейтральные молекулы, имеющие неподеленную электронную пару гетероатома: H2O, ROH, RSH, NH3, RNH2, R2NH, R3N; доноры π-электронов: = С = С =, ароматическое кольцо.
Радикальные реагенты(радикалы) - свободные атомы или частицы с неспаренным электроном. Примеры радикальных реагентов: гидроксильные НОˑ, гидропероксильные HOOˑ, алкильные Rˑ радикалы, атомы галогенов Сˑ, Brˑ.
13.КЛАССИФИКАЦИЯ ХИМ РЕАКЦИЙ ПО РЕЗУЛЬТАТУ: ЗАМЕЩЕНЕИЕ, ПРИСОЕДИНЕНИЕ, ЭЛИМИНИРОВАНИЕ, ПЕРЕГРУППИРОВКА, ОВР
Реакции замещения. Их обозначают символом S (от англ. substitution). В зависимости от природы атакующего реагента замещение может быть радикальное (SR), электрофильное (SE) и нуклеофильное (SN). Замещаемая часть субстрата называется уходящей группой. При радикальном замещении уходящий свободный радикал тут же вступает в реакцию. Реакции присоединения. Их обозначают символом А (от англ. addition). Присоединение может происходить также по трем механизмам: радикальное (АR), электрофильное (AE) и нуклеофильное (AN).
Реакции отщепления (элиминирования) обозначают символом Е (от англ. elimination). Чаще в этих реакциях отщепляющиеся группы уходят от соседних атомов углерода (β-элиминирование).
Реакции перегруппировки. В результате процесса перегруппировок происходит переход атомов или групп от одного атома к другому. Наиболее распространен переход мигрирующей группы к соседнему атому (1,2-перегруппировка). Мигрирующая группа может переходить с одним (радикальная) или парой электронов (нуклеофильная) перегруппировка. Окислительно-восстановительными реакциями (ОВР) называются реакции, протекающие с изменением степени окисления некоторых элементов, входящих в состав реагирующих веществ.
14.КИСЛОТЫ И ОСНОВАНИЯ ПО БРЕНСТЕДУ, ИХ КЛАССИФИКАЦИЯ.
По Бренстеду-Лоури, кислоты представляют собой вещества, способные отдавать протон, а основания - вещества, присоединяющие протон. Кислотность соединений количественно оценивается долей ионизированной формы вещества в растворе (воде) или константой равновесия (К) реакции переноса протона от кислоты к воде как основанию. Так, для уксусной кислоты (вода взята в значительном избытке, и ее концентрация практически не меняется) константа кислотности Ка (где а - начальная буква от англ. acid - кислота) выводится из выражения. Чем больше Ка (соответственно, чем выше доля ионизированной формы вещества), тем сильнее кислота. Кислотность: H - CH3 < H - NH2 < H - OH < H - F,
H - SH < H - Cl.
Жесткие кислоты - кислоты Льюиса, в которых акцепторные атомы малы по размеру, обладают большим положительным зарядом, большой электроотрицательностью и низкой поляризуемостью. Молекулярная орбиталь жестких кислот, на которую переходят электроны донора, имеет низкий уровень энергии.
Мягкие кислоты - кислоты Льюиса, содержащие акцепторные атомы большого размера с малым положительным зарядом, с небольшой электроотрицательностью и высокой поляризуемостью. Молекулярная орбиталь мягких кислот, принимающая электроны донора, имеет высокий уровень энергии.
Жесткие основания - донорные частицы, в которых атомы-доноры имеют высокую электроотрицательность и низкую поляризуемость. Валентные электроны удерживаются прочно, продукт окисляется с трудом. Орбиталь, пара электронов которой передается акцептору, имеет низкий уровень энергии. Донорными атомами в жестких основаниях могут быть кислород, азот, фтор, хлор.
Мягкие основания - донорные частицы, в которых атомы-доноры имеют низкую электроотрицательность и высокую поляризуемость, они легко окисляются; валентные электроны удерживаются слабо. Орбиталь, пара электронов которой передается акцептору, обладает высоким уровнем энергии. Донорными атомами в мягких основаниях выступают атомы углерода, серы, иода.
15. ВЛИЯНИЕ РАЗЛИЧНЫХ ФАКТОРОВ НА КИСЛОТНЫЕ И ОСНОВНЫЕ СВОЙСТВА ВЕЩЕСТВ. ПРИМЕРЫ.
Рассмотрим несколько примеров, как структура (природа радикала у кислотного центра) влияет на кислотность органических соединений. Известно, что в ряду ОН-кислот кислотные свойства убывают в следующем порядке: карбоновые кислоты > фенолы > спирты. В этом ряду радикалами у кислотных центров соответственно являются ацил с ярко выраженным акцепторным характером, арил, относящийся к акцепторным заместителям, но уступающий ацилам, и алкил, характеризующийся хотя и слабым, но электронодонорным эффектом. Указанные радикалы до разрыва связи О-Н будут различным образом влиять на ее поляризацию: чем выше акцепторность радикала, тем выше полярность связи (статический фактор). Однако более существенное влияние заместителей будет проявляться после разрыва О-Н-связи: чем выше степень делокализации заряда аниона, тем выше его устойчивость (динамический фактор). А чем стабильнее частица (в нашем случае кислородцентрированный анион), тем ниже энергетические барьеры на пути ее образования. В рассматриваемых примерах устойчивость анионов будет уменьшаться в следующем порядке: ацилат-анион > феноксид-анион > алкоксид-анион:
В первом случае делокализация заряда достигается за счет его распределения между двумя эквивалентными атомами кислорода. В феноксид-анионе делокализация заряда достигается за счет сопряжения электронных пар атома кислорода с
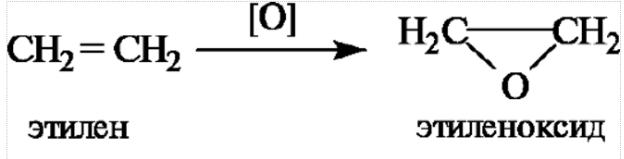
p-системой ароматического ядра, в результате чего часть электронной плотности с атома кислорода переносится на ароматическое ядро (отрицательный заряд на атоме кислорода снижается). Высокая степень локализации заряда на атоме кислорода в алкоксид-анионе делает его наименее стабильным и соответственно наиболее трудно образующимся. Легко понять, что введение в радикал у кислотного центра электроноакцепторных заместителей будет способствовать повышению кислотности всех типов кислот. Особенно резкое повышение кислотности СН-кислот наступает в случае, если введение такого заместителя придает соединению возможность существовать в нескольких таутомерных формах. Сравните кислотность двух СН-кислот: хлороформа и нитрометана (см. табл. 1). Из таблицы видно, что кислотность последнего почти на пять порядков выше. Столь значительная разница в кислотности двух указанных соединений обусловлена тем, что нитрометан может существовать в двух таутомерных формах с общим мезомерным анионом. Аналогичный подход можно использовать для объяснения подвижности a-водородных атомов в карбонильных соединениях.
Кратко остановимся на влиянии электронных факторов на основность органических соединений. В качестве оснований могут выступать анионы или нейтральные молекулы, содержащие атомы с неподеленными электронными парами. В роли последних чаще всего выступают азот- и кислородсодержащие соединения. Сила оснований будет определяться концентрацией электронной плотности на основных центрах (центрах протонирования). Влияние электронных факторов на основность органических соединений будет прямо противоположным тому, что выше было рассмотрено для кислот: электронодонорные заместители у основных центров будут усиливать основность, акцепторные - ее понижать.
Кроме оснований, понимаемых в рамках широкой трактовки этого термина, существует более узкая трактовка - органические основания. Это органические соединения, используемые на практике в качестве акцепторов протонов. К ним относятся нейтральные основания (третичные амины, амидины) и анионные основания (алкоголяты и амиды щелочных металлов, металлоорганические соединения). В препаративных синтезах эту роль чаще всего выполняют третичные амины - триэтиламин, диметиланилин, пиридин. Используя рассмотренные выше подходы в оценке кислотно-основных свойств органических соединений, можно на качественном уровне дать характеристику любому органическому соединению.
(16. СПИРТЫ И ФЕНОЛЫ. МНОГОАТОМНЫЕ СПИРТЫ.
17. ХИМИЧЕСКИЕ СВОЙСТВА СПИРТОВ И ФЕНОЛОВ.)
Одноатомные спирты, фенолы и их производные Производные алифатических углеводородов, в которых один или несколько атомов водорода замещены гидроксильной
группой, называют спиртами; аналогичные производные ароматических углеводородов называют фенолами.
В зависимости от числа гидроксильных групп спирты и фенолы бывают одно-, двух-, трехатомными и т. д. Спирты, содержащие две гидроксильные группы или более, называют многоатомными. В зависимости от того, у какого атома углерода находится функциональная группа, спирты называют первичными, вторичными или третичными.
Простые эфиры можно рассматривать как производные спиртов или фенолов, в которых атом водорода гидроксильной группы замещен алкильным или арильным радикалом. Простые эфиры бывают также ненасыщенными (например, виниловые) и циклическими. Виниловые эфиры CH2=CH-OR являются производными винилового спирта. Виниловый спирт CH2=CH-OH - простейший представитель соединений, называемых енолами, поскольку в их составе у атома углерода двойной связи (-ен) находится гидроксильная группа (-ол). Енолы - крайне неустойчивые соединения, например виниловый спирт в момент его образования изомеризуется в уксусный альдегид.
Простейший из циклических эфиров - этиленоксид - образуется при каталитическом окислении этилена.
Диэтиловый эфир применяют для ингаляционного наркоза, а также как растворитель веществ животного и растительного происхожедения. При хранении на воздухе диэтиловый эфир легко образует взрывчатый гидропероксид. Бутилвиниловый эфир используют для получения полимера, применяемого в качестве ранозаживляющего средства, под названием винилин («бальзам Шостаковского»).
Для спиртов характерна структурная изомерия (изомерия углеродного скелета, изомерия положения заместителя или гидроксильной группы), а также межклассовая изомерия.
Горение:
C2H5OH + 3O2  2CO2 +3H2O + Q
2CO2 +3H2O + Q
Реакции с щелочными и щелочноземельными металлами ("кислотные" свойства):
Атомы водорода гидроксильных групп молекул спиртов, также как и атомы водорода в молекулах воды, могут восстанавливаться атомами щелочных и щелочноземельных металлов ("замещаться" на них).
1.2Na + 2H—O—H  2NaOH + H2
2NaOH + H2 2Na + 2R—O—H
2Na + 2R—O—H  2RONa + H2
2RONa + H2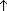
2.Реакции с галогеноводородами:
C2H5OH + HBr  C2H5Br + H2O
C2H5Br + H2O
3.Внутримолекулярная дегидратация (t > 140oС, образуются алкены):
C2H5OH  C2H4 + H2O
C2H4 + H2O
4.Межмолекулярная дегидратация (t < 140oС, образуются простые эфиры):
2C2H5OH  C2H5OC2H5 + H2O
C2H5OC2H5 + H2O
5.Окисление (мягкое, до альдегидов):
CH3CH2OH + CuO  CH3—CHO + Cu + H2O
CH3—CHO + Cu + H2O
Получение спиртов
1.Щелочной гидролиз галогеналканов (лабораторный способ): C2H5Cl + NaOH  C2H5OH + NaCl.
C2H5OH + NaCl.
2.Гидратация алкенов: C2H4 + H2O  C2H5OH.
C2H5OH.
3.Брожение глюкозы : C6H12O6  2C2H5OH + 2CO2
2C2H5OH + 2CO2 .
.
4.Синтез метанола: CO + 2H2  CH3OH
CH3OH
Многоатомные спирты
Примерами многоатомных спиртов является двухатомный спирт этандиол (этиленгликоль) HO—CH2—CH2—OH и трехатомный спирт пропантриол-1,2,3 (глицерин) HO—CH2—CH(OH)—CH2—OH.
Фенолы
Важнейшим представителем фенолов является фенол (гидроксобензол, старые названия - гидроксибензол, оксибензол)
C6H5—OH.
Физические свойства фенола: твердое бесцветное вещество с резким запахом; ядовит; при комнатной температуре заметно растворим в воде, водный раствор фенола называют карболовой кислотой.
Химические свойства
1.Кислотные свойства. Кислотные свойства фенола выражены сильнее, чем у воды и предельных спиртов, что связано с большей полярностью O—H связи и с большей устойчивостью образующегося при ее разрыве фенолятиона. В отличие от спиртов, фенолы реагируют не только с щелочными и щелочноземельными металлами, но и с растворами щелочей, образуя феноляты:
2C6H5OH + 2Na 2C6H5ONa |
+ H2 |
фенолят натрия
2.
3.C6H5OH + NaOH  C6H5ONa + H2O
C6H5ONa + H2O
4.Однако кислотные свойства фенола выражены слабее, чем у карбоновых кислот и, тем более, у сильных неорганических.
5.Замещение в бензольном кольце. Наличие гидроксильной группы в качестве заместителя в молекуле бензола приводит к перераспределению электронной плотности в сопряженной  -системе бензольного кольца, при этом увеличивается электронная плотность у 2-го, 4-го и 6-го атомов углерода (орто- и пара-положения) и уменьшается у 3-го и 5-го атомов углерода (мета-положение).
-системе бензольного кольца, при этом увеличивается электронная плотность у 2-го, 4-го и 6-го атомов углерода (орто- и пара-положения) и уменьшается у 3-го и 5-го атомов углерода (мета-положение).
а) Реакция с бромной водой (качественная реакция):
+ 3Br2 |
+ 3HBr |
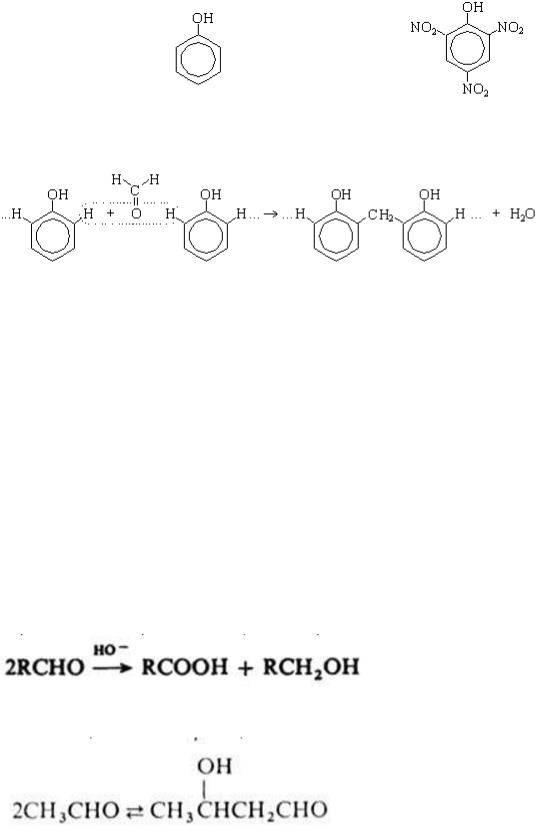
6.
Образуется 2,4,6-трибромфенол - осадок белого цвета.
б) Нитрование (при комнатной температуре):
7. C6H5—OH + HNO3(разб.)  H2O + O2N—C6H4—OH (смесь орто- и пара-изомеров) 8.
H2O + O2N—C6H4—OH (смесь орто- и пара-изомеров) 8.
+3HNO3(конц.)  3H2O +
3H2O +
9.По вторй реакции образуется 2,4,6-тринитрофенол (пикриновая кислота).
10.Поликонденсация фенола с формальдегидом (по этой реакции происходит образование фенолформальдегидной смолы:
11.Качественная реакция с хлоридом железа(III). Образуется комплексное соединение фиолетового цвета.
18.АЛЬДЕГИДЫ. ОСОБЕННОСТИ СТРОЕНИЯ КАРБОНИЛЬНОЙ ГРУППЫ. ХИМИЧЕСКИЕ СВОЙСТВА АЛЬДЕГИДОВ: ОБРАЗОВАНИЕ ПОЛУАЦЕТАЛЕЙ И АЦЕТАЛЕЙ, РЕАКЦИЯ ДИСПРОПОРЦИОНИРОВАНИЯ И АЛЬДОЛЬНОЙ КОНДЕНСАЦИИ, ОВР, ОБРАЗОВАНИЕ ОСНОВАНИЙ ШИФФА.
Альдегиды – органические соединения, содержащие альдегидную группу СНО.
В зависимости от насыщенности углеводородного заместителя:
предельные (насыщенные) альдегиды (ацетальдегид); непредельные (ненасыщенные) альдегиды (акролеин); ароматические альдегиды (бензальдегид).
По числу карбонильных групп:
альдегиды с одной карбонильной группой (формальдегид); диальдегиды (глиоксаль); многоатомные альдегиды.
Альдегиды в кислой среде образуют полуацетали при взаимодействии со спиртами. Полуацеталь сохраняет свойства альдегида и качественные реакции, характерные для альдегидной группы( «серебряного зеркала» и др.). При действии избытка спирта полуацеталь превращается в ацеталь, который не сохраняет свойства альдегидной группы. Гидролиз полуацеталя и ацеталя возможен только в кислой среде и не возможен в щелочной.
Реакция Канниццаро (диспропорционирования)
АЛЬДОЛЬНАЯ КОНДЕНСАЦИЯ, взаимод. двух молекул альдегида или кетона (одинаковых или разных) в присут-
ствии кислот или оснований с образованием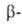 гидроксиальдегидов (альдолей), например:
гидроксиальдегидов (альдолей), например:
Альдольная конденсация двух различных альдегидов или кетонов наз. перекрестной. При этом возможно образование смеси различных альдолей:

Шиффа основания образуются;
1)при взаимодействии ароматических альдегидов с анилинами: C6H5-NH2+O=HC—C6H5→C6H5—N=CH—С6Н5+Н2O; эта реакция обратима и в кислом растворе основания Шиффа гидролитически расщепляются;
2)в процессе синтеза вторичных аминов нитрил восстанавливается до альдимина, который затем частично гидролизуется до альдегида, а частично восстанавливается до первичного амина; образовавшиеся вещества взаимодействуют между собой с образованием оснований Шиффа;
3)непосредственным взаимодействием альдимина с первичным амином;
4)при нагревании вторичных аминов с гексаметилентетрамином в присутствии уксусной кислоты;
5)при синтезе альдегидов из анилида, сопровождающемся образованием оснований Шиффа (его соли) в качестве промежуточного продукта;
6)как промежуточный продукт при синтезе аминокислот из альдегидов; при этом альдегид, взаимодействуя с аммиаком, образует альдегидаммиак, который, отщепляя воду, превращается в соответствующее основание Шиффа. Аминокислоты образуют основания Шиффа с альдегидами и другими соединениями, содержащими карбонильную группу. Определенную роль оснований Шиффа приписывают в ферментативном катализе. Дипептидазы и аминополипептидазы действуют на субстрат только в том случае, если он имеет свободную аминогруппу, с которой эти ферменты связываются, вероятно, посредством своих карбонильных групп, образуя основания Шиффа. Аналогичным образом осуществляется взаимодействие коферментов переаминирования с субстратами: фосфопиридоксаля с аминокислотами (через аминогруппу) и фосфопиридоксамина с кетокислотами (через кетогруппу).
19. КЛАССИФИКАЦИИ КАРБОНОВЫХ КИСЛОТ ПО ОСНОВНОСТИ, НАСЫЩЕННОСТИ, НАЛИЧИЮ ФУНКЦИОНАЛЬНОЙ ГРУППЫ, ЧИСЛУ АТОМОВ УГЛЕРОДА В ЦЕПИ.
В зависимости от природы органического радикала карбоновые кислоты могут быть алифатическими (насыщенными или ненасыщенными) RCOOH и ароматическими ArCOOH . По числу карбоксильных групп они подразделяются на монокарбоновые, дикарбоновые и трикарбоновые.
20. ХИМИЧЕСКИЕ СВОЙСТВА КАРБОНОВЫХ КИСЛОТ С УЧАСТИЕМ КАРБОКСИЛЬНОЙ ГРУППЫ: ДЕКАРБОКСИЛИРОВАНИЕ, ОБРАЗОВАНИЕ СОЛЕЙ, АМИДОВ, АНГИДРИДОВ, ГАЛОГЕНГИДРИДОВ, СЛОЖНЫХ ЭФИРОВ.
В отличие от спиртов и фенолов, карбоновые кислоты обладают заметной кислотностью, хотя и значительно уступают по силе минеральным кислотам, таким, как фосфорная или соляная. Поскольку кислотность напрямую связана с легкостью отщепления протона, сила кислоты увеличивается, если отрицательный заряд аниона лучше компенсируется отрицательными индуктивными или мезомерными эффектами Получение ангидридов кислот. Ангидриды кислот можно рассматривать как продукты дегидратации двух молекул
кислоты. При отнятии воды от карбоновых кислот (которое удается осуществить только при помощи фосфорного ангид-
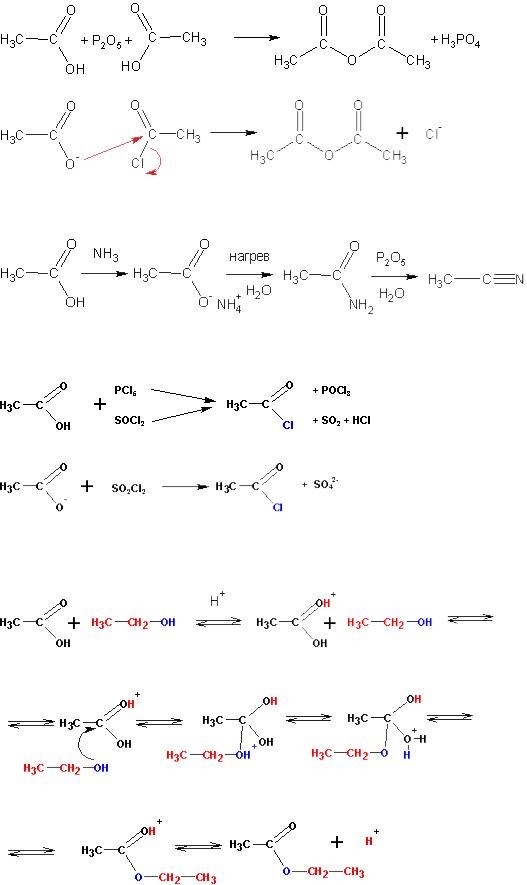
рида Р2О5) можно получать смешанные и моноангидриды:
Другой способ получения ангидридовреакция солей карбоновых кислот с галогенангидридами кислот:
Уксусный ангидриджидкость, кипящая при 140 оС, обладающая неприятным резким запахом. Ангидрида муравьиной кислоты не существует.
Образование амидов
Получение галогенангидридов кислот
Хлорангидриды кислот получают классическими реакциями замены гидроксильной группы на галоген (так же, как и в случае со спиртами):
Или при реакции соли карбоновой кислоты с хлористым сульфурилом:
Получение сложных эфиров
Этерификация кислот спиртами приводит к сложным эфирам с переменным успехом.
Реакция протекает в кислой среде и обратима. Роль кислоты заключается в активации (усилении реакционной способности) карбоновой кислоты (но не спирта!) путем протонирования:
Протонированная по атому кислорода карбонильной группы кислота атакуется атомом кислорода спирта (на нем имеются две неподеленные пары электронов):
Реакция завершается переносом протона, отщеплением воды и, наконец, отщеплением самого протона (регенерация катализатора):
Поскольку все стадии этерификации обратимы, для увеличения выхода приходится отгонять из реакционной смеси продукт (эфир) или связывать воду. Обратите внимание, что в составе сложного эфира присутствует атом кислорода от спирта, а не от кислоты. Успех реакции в значительной степени зависит от строения спирта и кислоты. Так, наиболее успешно реакция протекает с короткими молекулами спиртов и кислот. Важное значение имеет то, чтобы ни спирт, ни кислота не были стерически затруднены у реакционных центров (гидроксильной и карбоксильной групп). Скорость реакции этерификации кислот спиртами растет с понижением значения рН до определенной величины, а с дальнейшим
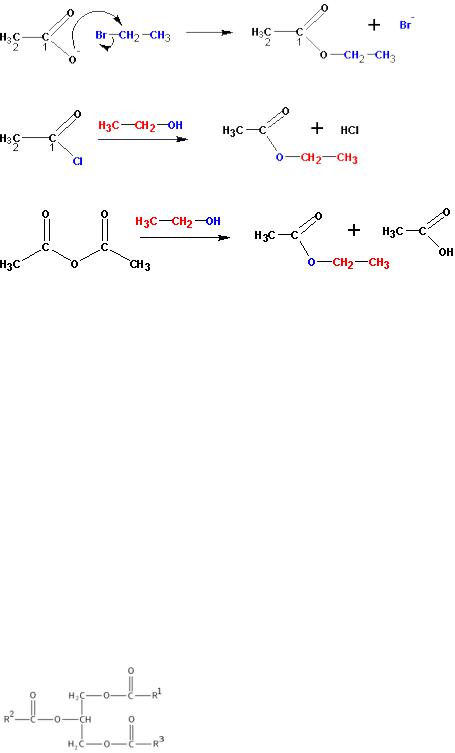
снижением рН опять падает. Связано это со все возрастающей степенью протонирования (по атому кислорода) молекулы спирта и, соответственно, потерей ей реакционной способности (атаковать карбонильный углерод).
Другим удобным способом получения сложных эфиров является реакция солей карбоновых кислот с галоидными алкилами:
При наличии ангидридов и галогенангидридов кислот наиболее удобно получать эфиры из них, так как эти реакции идут практически полностью (и необратимо). С галогенангидридами спирты реагируют по схеме:
С ангидридами реакции идут немного менее активно, но гораздо лучше, чем с самими кислотами. В реакцию берут спирт и ангидрид кислоты:
21. ВЫСШИЕ ЖИРНЫЕ КАРБОНОВЫЕ КИСЛОТЫ: КЛАССИФИКАЦИЯ, НОМЕНКЛАТУРА, СТРУКТУРА, ФИЗИЧЕСКИЕ СВОЙСТВА.
ВЖК — алифатические одноосновные карбоновые кислоты с открытой цепью, содержащиеся в этерифицированной форме в жирах, маслах и восках растительного и животного происхождения. Жирные кислоты, как правило, содержат неразветвленную цепь из четного числа атомов углерода (С4-24, включая карбоксильный углерод) и могут быть как насыщенными, так и ненасыщенными.
Классификация:
1.Насыщенные: Жирная кислота считается насыщенной, если все свободные углеродные цепи связаны атомом водорода. Насыщенные жиры содержатся, в основном, в животных жирах и тропических маслах, и организм также производит их из углеводов.
стеариновая (C17H35COOH) пальмитиновая (C15H31COOH)
2.Ненасыщенные: полиненасыщенные жирные кислоты имеют две или более двойных связей, поэтому им не хватает уже четырех атомов водорода и выше. Все жиры и масла, как растительного так и животного происхождения, представлены комбинацией насыщенных жирных кислот, мононенасыщенных жирных кислот и полиненасыщенных линолевой и линоленовой кислот.
пальмитолеиновая (C15H29COOH, 1 двойная связь) олеиновая (C17H33COOH, 1 двойная связь) линолевая (C17H31COOH, 2 двойные связи) линоленовая (C17H29COOH, 3 двойные связи) арахидоновая (C19H31COOH, 4 двойные связи,
К незаменимым жирным кислотам относятся всего две жирных кислоты: линолевая и линоленовая, и из линолевой синтезируется арахидоновая – они образуют витамин F. Остальные относятся к заменимым: пальмитолеино-
вая (C15H29COOH, 1 двойная связь), олеиновая (C17H33COOH, 1 двойная связь), стеариновая (C17H35COOH), пальмитино-
вая (C15H31COOH).
Для названия Ненасыщенных жирных кислот наиболее удобна ω-номенклатура, в соответствии с которой структура любой ненасыщенной жирной кислоты может быть выражена тремя цифрами : длиной цепи (количеством углеродных атомов), количеством двойных связей и количеством углеродных атомов между двойной связью и метильной группой (ω- углеродом). Наличие двойной связи может быть также обозначено цифрой, указывающей начало двойной связи, считая с карбоксильного конца молекулы:
Олеиновая кислота (18:1 ω9),или Цис - 9 - октадеценовая кислота. Линолевая кислота (18:2 ω6), или Цис-9-Цис-12-октадекадиеновая кислота.

Линоленовая кислота (18:3 ω3), или Цис-9, Цис-12, Цис-15-октадекатриеновая кислота.
Арахидоновая кислота (20:4 ω6), или (эйкозатетраен-5,8,11,14-овая кислота), Цис-5, Цис-8, Цис-11, Цис-14- эйкозатетраеновая кислота.
Химические свойства:
Химические свойства ВЖК: образование солей, реакция этерификации с образованием тиоэфиров (ацилКоА). Образование солей:
С17Н35СООН + NaOH → С17Н35СООNа + Н2О
Реакция этерификации ВЖК сопровождается активацией ВЖК и получением АцилКоА. Реакция происходит на наружной поверхности мембраны митохондрий при участии АТФ, коэнзима A (HS-KoA) и ионов Mg2+. Катализируется ферментом ацил-КоА-синтетазой:
22.ДИКАРБОНОВЫЕ КИСЛОТЫ: ЩАВЕЛЕВАЯ, МАЛОНОВАЯ, ЯНТАРНАЯ, ГЛУТАРОВАЯ, ФУМАРОВАЯ. ИХ РОЛЬ В ОРГАНИЗМЕ.
Соли щавелевой кислоты - оксалаты.
Щавелевая кислота НООС—СООН — простейшая двухосновная кислота. Ее соли называют оксалатами.
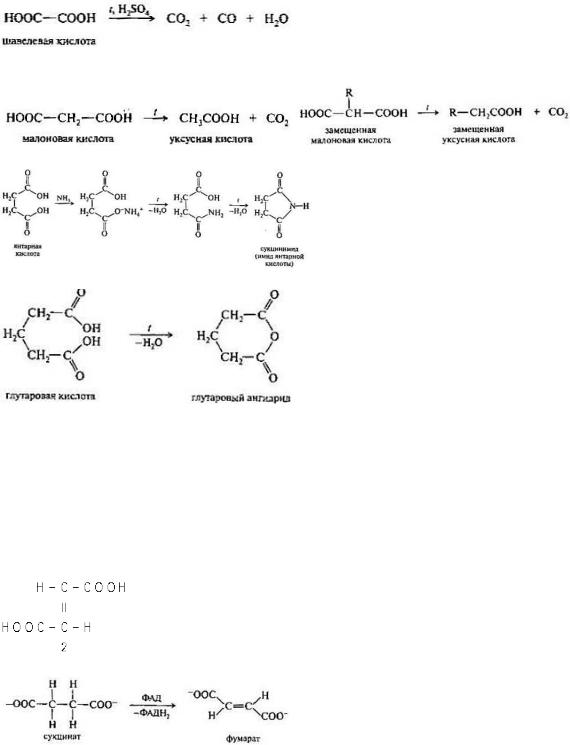
Na2C2O4 --t→Na2CO3+CO,
Малоновая кислота НООС-СН2-СООН
,
Янтарная кислота НООС(СН2)2СООН
Глутаровая кислота НООС(СН2)2СООН
Ненасыщенные дикарбоновые кислоты: фумаровая, малеиновая их пространственное строение. Превращение янтарной кислоты в фумаровую кислоту как пример биологической реакции дегидрирования.
Малеиновая кислота
 ,
,
Фумаровая кислота
Превращение янтарной кислоты в фумаровую кислоту:
Насыщенные дикарбоновые кислоты – это карбоновые кислоты, содержащие 2 карбоксильные группы –СООН, с общей формулой НООС-R-СООН, где R-любой двухвалентный органический радикал. Ненасыщенные карбоновые кислоты содержат в углеводо-родной цепи одну или несколько двойных или тройных связей.
Система дикарбоновых аминокислот, к которой относят также соответствующие α-кетокислоты, теснейшим образом связана не только с азотистым метаболизмом в целом, но и с обменом липидов и углеводов. Ранее отмечалась особая роль дикарбоновых аминокислот и ферментов, катализирующих их превращения, в перераспределении азота в организме, дезаминировании и синтезе природных аминокислот (реакции трансде-заминирования и трансреаминирования), в образовании конечных продуктов белкового обмена – синтезе мочевины. Аспарагиновая кислота принимает непосредственное участие в орни-тиновом цикле мочевинообразования, в реакциях трансаминирования и биосинтезе углеводов (гликогенная аминокислота), карнозина и ансерина, пуриновых и пиримидиновых нуклеотидов (см. главу 14), а также в синтезе N-ацетиласпарагиновой кислоты в ткани мозга. Роль последней, содержащейся в довольно высоких концентрациях в ткани мозга млекопитающих, пока не выяснена. Глутаминовая кислота, являющаяся гликогенной и заменимой аминокислотой для человека и животных, также включается в синтез ряда специфических метаболитов, в частности глутатиона и глутамина. Помимо участия в транспорте аммиака и регуляции кислотно-щелочного равновесия, глутамин –
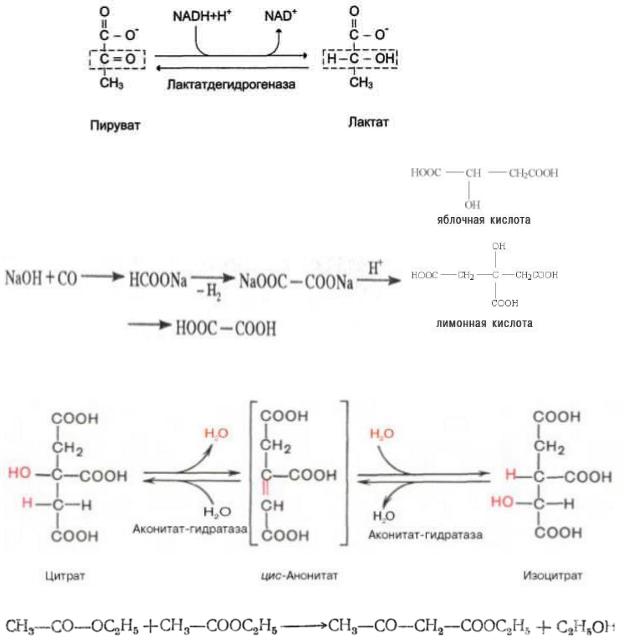
это незаменимый источник азота в ряде синтезов, в частности в биосинтезе пуриновых и пиримидиновых нуклеотидов, амино-сахаров, в обезвреживании фенилуксусной кислоты (синтез фенилацетил-глутамина) у человека и человекообразных обезьян, а также в синтезе витамина фолиевой кислоты (птероилглутаминовая кислота). Глутамин и аспарагин оказались, кроме того, эссенциальными факторами для роста некоторых нормальных и опухолевых клеток в культуре ткани; они не могут быть заменены ни друг другом, ни соответствующими дикарбоновыми аминокислотами. Это свидетельствует о том, что в условиях выращивания клеток в культуре ткани некоторые клетки теряют способность синтезировать эти амиды синтетазным или трансаминазным путем.
23. ОКСОГИДРОКСИКАРБОНОВЫЕ КИСЛОТЫ: ПИРОВИНОГРАДНАЯ И МОЛОЧНАЯ, ЯБЛОЧНАЯ И ЩАВЕЛЕВАЯ, ЛИМОННАЯ, АЦЕТОУКСУСНАЯ И β-ГИДРОКСИМАСЛЯНАЯ, α-КЕТОГЛУТАРОВАЯ, ФУНКЦИИ В ОРГАНИЗМЕ.
Оксокарбоновыми кислотами называют соединения, содержащие одновременно карбоксильную и карбонильную группы. Они подразделяются на альдегидо- и кетонокислоты.
Гидроксикарбоновыми кислотами называют соединения, молекулы которых содержат и спиртовые, и карбоксильные группы. Число карбоксильных групп определяет основность гидро-ксикарбоновых кислот, а суммарное число групп ОН (как спир-товых, так и карбоксильных) - их атомность.
Пируват и лактат учавствуют в анаэробном гликолизе, все 10 реакций которого идентичны аэробному, отличие лишь в
последней, 11.
Способ получения щавелевой кислоты из СО через формиат Na:
Цитрат (лимонная) – Цикл Кребса
Ацетоуксусная кислота – получение этилового эфира ацетоуксусной кислоты
β-гидроксибутират. В организме человека, бета-гидроксибутират синтезируется в печени из ацетил-КоА. Биосинтез катализируется ферментом бета-гидроксибутиратдегидрогеназы.
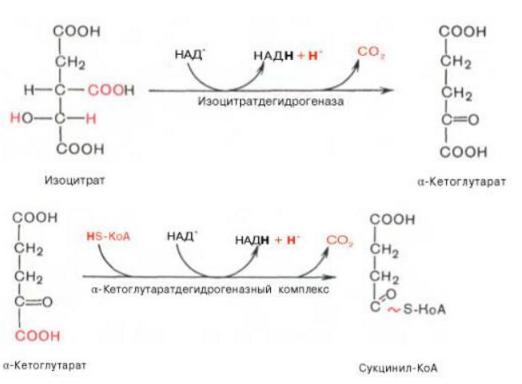
Как промежуточный продукт окисления жирных кислот накапливается в организме у больных сахарным диабетом, являясь, в свою очередь, предшественником ацетоуксусной кислоты. Соединение может быть использовано в качестве источника энергии для мозга, когда наблюдается низкий уровень глюкозы в крови.
α-кетоглутаровая кислота ключевой продукт Кребса, образуется в результате декарбоксилирования изоцитрата и превращается в сукцинил-CoA в альфа-кетоглутарат дегидрогеназном комплексе.
24. ОБЩЕЕ ПРЕДСТАВЛЕНИЕ О ЛИПИДАХ, КЛАССИФИКАЦИЯ ЛИПИДОВ.
Липиды — органические вещества, характерные для живых организмов, нерастворимые в воде, но растворимые в органических растворителях и друг в друге.
Структурная классификация липидов. 1.Простые (неполярные):
-омыляемые: жиры (триацилглицерины) и воска (эфиры);
-неомыляемые: стероиды (холестерин).
2.Ложные (полярные):
-глицерофосфолипиды;
-сфингофосфолипиды;
-гликолипиды. Биологическая роль:
• Энергетическая (резервная) функция: многие жиры, в первую очередь триглицериды, используются организмом как источник энергии. Жировые отложения используются в качестве запасных источников питательных веществ, прежде всего животными, которые вынуждены носить свои запасы на себе.
• Функция теплоизоляции: жир — хороший теплоизолятор, поэтому у многих теплокровных животных он откладывается в подкожной жировой ткани, уменьшая потери тепла.
• Структурная функция: все живые клетки окружены плазматическими мембранами, основным структурным элементом которых является двойной слой липидов (липидный бислой).
• Защитная (амортизационная): толстый слой жира защищает внутренние органы многих животных от повреждений при ударах.
25. ПРОСТЫЕ ЛИПИДЫ: ТАГ, СОСТАВ, НОМЕНКЛАТУРА, СВОЙСТВА, ГИДРОЛИЗ ТАГ, БИОЛОГИЧЕСКАЯ РОЛЬ.
Триацилглицерины – самые распространенные липиды в природе. Их принято делить на жиры и масла. Жиры при комнатной температуре находятся в твердом состоянии. При нагревании они плавятся и переходят в жидкое состояние. Масла же при комнатной температуре имеют жидкую консистенцию. Жиры и масла не растворяются в воде. При интенсивном перемешивании с водой они образуют эмульсии.
При гидролизе триацилглицеринов образуются глицерин и жирные кислоты:
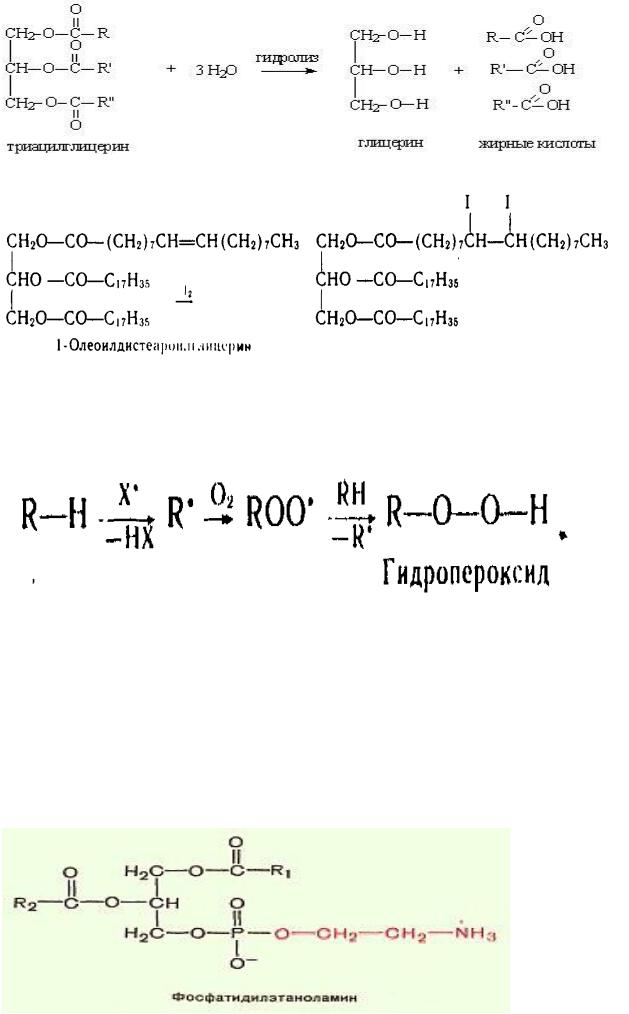
Реакция присоединения – Липиды содержащие остатки непредельных ЖК присоединяют по двойным связям водород, галогены, галогеноводороды и в кислой среде воду.
Реакция окисления – Процессы окисления липидов весьма разнообразны. В частности, окисление кислородом воздуха ненасыщенных триацилглицеролов при хранении (автоокисление), сопровождаемое гидролизом, является частью процесса, так называемого, прогоркания масла. Первичными продуктами реакции липидов с молекулярным кислородом являются гидроперекиси, образующиеся в результате инициации цепного свободнорадикального окислительного процесса:
Биологическая роль:
Будучи одним из основных компонентов биологических мембран, липиды влияют на проницаемость клеток и активность многих ферментов, участвуют в передаче нервного импульса, в мышечном сокращении, создании межклеточных контактов, в иммунохимических процессах. Также липиды образуют энергетический резерв организма, участвуют в создании водоотталкивающих и термоизоляционных покровов, защищают различные органы от механических воздействий и др.
26. СЛОЖНЫЕ ЛИПИДЫ — ГЛИЦЕРОФОСФОЛИПИДЫ, СТРОЕНИЕ И ФУНКЦИИ ФОСФАТИДИЛСЕРИНА, ФОСФАТИДИЭТАНОЛАМИНА, ФОСФАТИДИЛХОЛИНА, ФОСФАТИДИЛИНОЗИТОЛА.
Фосфолипиды (фосфоглицериды) - это сложные липиды, производные фосфатидной кислоты. Липидам принадлежит главная роль в образовании мембран клеток. Основная часть липидов в мембранах представлена фосфолипидами, гликолипидами и холестерином.
Фосфатидиэтаноламин:
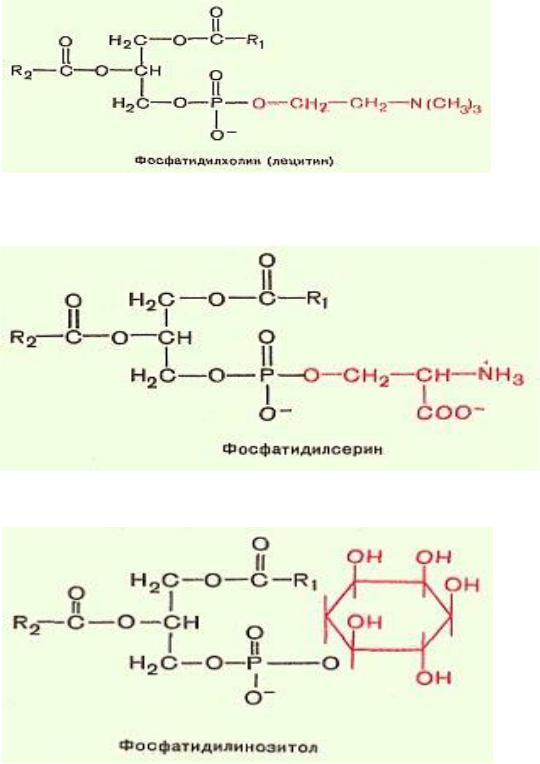
Фосфатидилхолин:
Фосфатидилхолины и фосфотидилэтаноламины встречаются в организме животных и высших растений в наибольшем количестве. Эти две группы фосфоглицеридов метаболически связаны друг с другом и являются главными липидными компонентами мембран клеток в плане стабилизации их двухслойности.
Фосфатидилсерин:
Фосфатидилсерины распространены гораздо менее широко, чем фосфатидилхолины и фосфатидилэтаноламины, и их значение определяется в основном тем, что они участвуют в синтезе фосфатидилэтаноламинов.
Фосфатидилинозитол:
Фосфатидилинозитолы довольно широко распространены в природе. Обнаружены у животных, растений и микроорганизмов. В животном организме они найдены в мозге, печени, легких.
27. СОЕДИНЕНИЯ СТЕРОЙДНОЙ ГРУППЫ: ХОЛЕСТЕРИН, ЖЕЛЧНЫЕ КИСЛОТЫ, ПРЕДСТАВЛЕНИЕ О ХИМИЧЕСКОМ СТРОЕНИИ И БИОЛОГИЧЕСКОЙ РОЛИ.
Холестерин — органическое соединение, природный жирный (липофильный) спирт, содержащийся в клеточных мембранах всех живых организмов, за исключением безъядерных (прокариоты). Нерастворим в воде, растворим в жирах и органических растворителях. Около 80% холестерина вырабатывается самим организмом (печенью, кишечником, почками, надпочечниками, половыми железами), остальные 20% поступают с пищей. 80% холестери-
на в организме свободные, а 20% — связанные. Холестерин обеспечивает стабильность клеточных мембран в широком интервале температур. Он необходим для выработки витамина D, выработки надпочечниками различных стероидных гормонов, включая кортизол, альдостерон, женских половых гормонов эстрогенов и прогестерона, мужского полового гормона тестостерона, играет важную роль в деятельности нервной и иммунной системы.
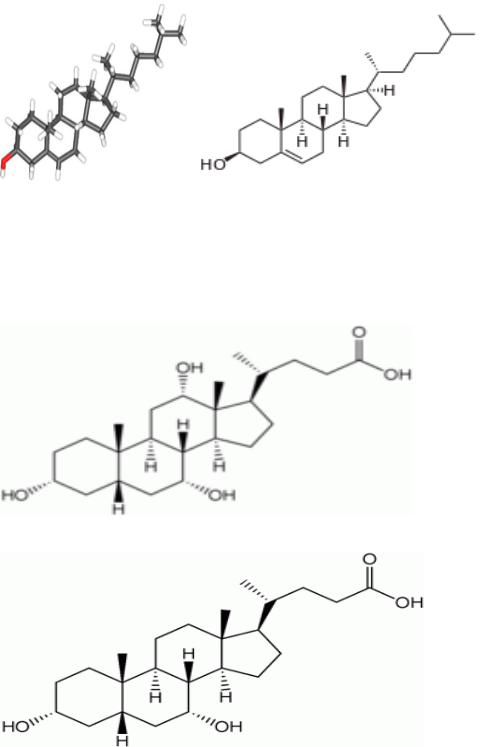
Желчные кислоты – синтезируются в организме из холестерина в клетках печени. Эмульгируют пищевые липиды (жиры)
– необходимо для того, чтоб с пищевыми липидами могли контактировать и действовать на них водорастворяющие ферменты. Активируют панкреатическую липазу путем создания тройного комплекса: состоит из липазы, колипазы, желчные кислоты. Принимает участие в создании транспортной формы липидов – мицеллы. Желчные кислоты могут соединяться в клетках печени с рядом молекул, образуя коньюгаты с гликонолом или глицином и таурином. Функции этих коньюгатов такая же как и у простой желчной кислоты.
Желчные кислоты:
•Первыичные – синтез с участием ферментов человека (холевая)
•Вторичная – образуется в кишечнике под действием ферментов бактерий, теряется одна гидроксил-группа (дезоксихолевая кислота)
28. УГЛЕВОДЫ, КЛАССИФИКАЦИЯ УГЛЕВОДОВ, ФУНКЦИИ УГЛЕВОДОВ В ОРГАНИЗМЕ.
Углеводы входят в состав клеток и тканей всех растительных и животных организмов. Они имеют большое значение как источники энергии в метаболических процессах.
Углеводы служат основным ингредиентом пищи млекопитающих. Общеизвестный их представитель - глюкоза - содержится в растительных соках, плодах, фруктах и особенно в винограде (отсюда ее название - виноградный сахар). Она является обязательным компонентом крови и тканей животных и непосредственным источником энергии для клеточных реакций.
Углеводы образуются в растениях в процессе фотосинтеза из диоксида углерода и воды. Для человека основным источником углеводов является растительная пища.
Моносахариды -- углеводы, молекулы которых не могут быть разложены на более простые молекулы углеводов; Олигосахариды -- углеводы, содержащие от двух до десяти одинаковых или различных моносахаридных остатков. По числу таких остатков различают дисахариды, трисахариды, тетрасахариды и т. д.; Полисахариды -- углеводы, содержащие более десяти (до тысячи и выше) одинаковых или различных моносахаридных остатков.

Моносахариды по виду функциональной группы делятся на альдозы (содержат альдегидную группу) и кетозы (содержат карбонильную группу).
Кетозы - глюкоза, галактоза, фруктоза
29. КЛАССИФИКАЦИЯ И ХИМИЧЕСКИЕ СВОЙСТВА МОНОСАХАРИДОВ, (СМ ВЫШЕ) ОВР МОНОСАХАРИДОВ.
Химические свойства глюкозы
Получение: (C6H10O5)n + nH2O t,H+→ nC6H12O6
1.Спиртовое брожение:
C6H12O6 → 2C2H5-OH + 2CO2↑
2. Молочнокислое брожение:
C6H12O6 → 2СH3-CH-COOH
│
OH молочная кислота 3. Маслянокислое брожение:
C6H12O6 → C3H7COOH + 2H2 ↑+ 2CO2↑
II. Свойства альдегидов
1. Реакция серебряного зеркала: Качественная реакция
СH2OH(CHOH)4-COH + Ag2O t.NH3→ СH2OH(CHOH)4-COOH + 2Ag↓(глюконовая кислота)
Или СH2OH(CHOH)4-COH + 2[Ag(NH3)2]OH → СH2OH(CHOH)4-COONH4 + 2Ag↓+ 3NH3 +H2O
2. Окисление гидроксидом меди (II):
СH2OH(CHOH)4-COH + 2Cu(OH)2 t → СH2OH(CHOH)4-COOH + Cu2O + 2H2O
3. Восстановление:
СH2OH(CHOH)4-COH + H2 t,Ni → СH2OH(CHOH)4-CH2OH (сорбит – шестиатомный спирт)
III. Свойства многоатомных спиртов
1. Образование простых эфиров со спиртами При действии метилового спирта в присутствии газообразного хлористого водорода атом водорода гликозидного гидроксила замещается на метильную группу.
+ СH3ОН HCl(газ)→ |
+ H2О |
α- глюкоза
2.Качественная реакция многоатомных спиртов
Прильём к раствору глюкозы несколько капель раствора сульфата меди (II) и раствор щелочи. Осадка гидроксида меди не образуется. Раствор окрашивается в ярко-синий цвет. В данном случае глюкоза растворяет гидроксид меди (II) и ведет себя как многоатомный спирт, образуя комплексное соединение – ярко синего цвета.
Превращение глю-6-фосфата во фруктозу-6-фосфат
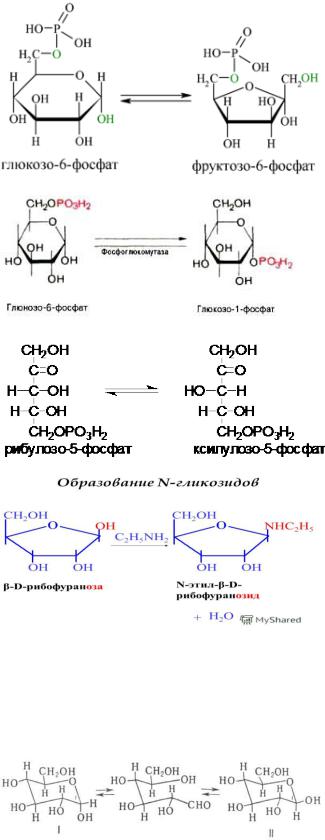
превращение глю-6-фосфата в глюкозу-1-фосфат
рибулозы-5-фосфата в ксилулозу-6-фосфат
30. СТЕРЕОИЗОМЕРИЯ МОНОСАХАРИДОВ D- И L- РЯДЫ, ОТКРЫТЫЕ И ЦИКЛИЧЕСКИЕ ФОРМУЛЫ (ФИШЕРА, КОЛЛИ-ТОЛЛЕНСА, ХЕУОРСА), ПИРАНОЗЫ И ФУРАНОЗЫ, α И β АНОМЕРЫ, ЦИКЛОЦЕПНАЯ ТАУТОМЕРИЯ, ЯВЛЕНИЕ МУТАРОТАЦИИ.
МУТАРОТАЦИЯ — самопроизвольное изменение величины оптического вращения свежеприготовленных растворов оптически активных соединений. Характерна для моносахаридов, восстанавливающих олигосахаридов, лактонов и др. Катализируется кислотами и основаниями. Растворы гликозидов не мутаротируют.
Вслучае глюкозы мутаротация объясняется установлением равновесия:
Вравновесном состоянии присутствует 38% a-формы (ф-ла I) и 62% b-формы (II). Промежуточная альдегидная форма содержится в ничтожно малой концентрации. Преимуществ, образование b-формы объясняется тем, что гидроксил при С-1 занимает экваториальное положение.
Моносахариды могут существовать как в открытой (оксоформе), так и в циклических формах. В растворе эти изомерные формы находятся в динамическом равновесии.
Открытые формы. Моносахариды (монозы) являются гетерофункциональными соединениями. В их молекулах одновременно содержатся карбонильная (альдегидная или кетонная) и несколько гидроксильных групп, т. е. моносахариды представляют собой полигидроксикарбонильные соединения - полигидроксиальдегиды и полигидроксикетоны. Они имеют неразветвленную углеродную цепь.
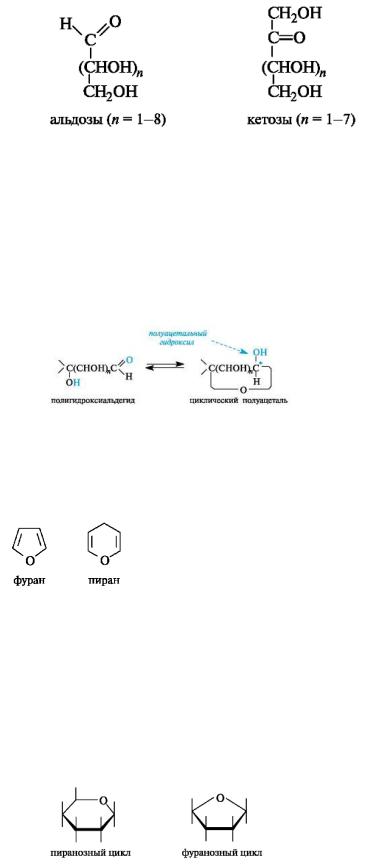
Моносахариды классифицируют с учетом природы карбонильной группы и длины углеродной цепи. Моносахариды, содержащие альдегидную группу, называют альдозами, а кетонную группу (обычно в положении 2) - кетозами (суффикс -оза применяют для названий моносахаридов: глюкоза, галактоза, фруктоза и т. д.). В общем виде строение альдоз и кетоз можно представить следующим образом.
Для обозначения стереохимии используется D,L-система. Отнесение моносахарида к D- или L-ряду проводят по конфигурации хирального центра, наиболее удаленного от оксогруппы, независимо от конфигурации остальных центров! Для пентоз таким «определяющим» центром является атом С-4, а для гексоз - С-5. Положение группы ОН у последнего центра хиральности справа свидетельствует о принадлежности моносахарида к D-ряду, слева - к L-ряду, т. е. по аналогии со стереохимическим стандартом - глицериновым альдегидом. Большинство природных моносахаридов принадлежит к D- ряду. Из альдопентоз часто встречаются D-рибоза и D-ксилоза, а из кетопентоз - D-рибулоза и D-ксилулоза. Циклические формы. Открытые формы моносахаридов удобны для рассмотрения пространственных отношений между стереоизомерными моносахаридами. В действительности моносахариды по строению являются циклическими полуацеталями. Образование циклических форм моносахаридов можно представить как результат внутримолекулярного взаимодействия карбонильной и гидроксильной групп (см. 9.2.2), содержащихся в молекуле моносахарида.
Полуацетальную гидроксильную группу в химии углеводов называют гликозидной. По свойствам она значительно отличается от остальных (спиртовых) гидроксильных групп.
В результате циклизации образуются термодинамически более устойчивые фуранозные (пятичленные) и пиранозные (шестичленные) циклы. Названия циклов происходят от названий родственных гетероциклических соединений - фурана и пирана.
В циклической форме создается дополнительный центр хиральности - атом углерода, ранее входивший в состав карбонильной группы (у альдоз это С-1). Этот атом называют аномерным, а два соответствующих стереоизомера - α- и β- аномерами. Аномеры представляют собой частный случай эпимеров. У α-аномера конфигурация аномерного центра одинакова с конфигурацией «концевого» хирального центра, определяющего принадлежность к d- или l-ряду, а у β- аномера - противоположна. В проекционных формулах Фишера у моносахаридов d-ряда в α-аномере гликозидная группа ОН находится справа, а в β-аномере - слева от углеродной цепи.
Формулы Хеуорса. Циклические формы моносахаридов изображают в виде перспективных формул Хеуорса, в которых циклы показывают в виде плоских многоугольников, лежащих перпендикулярно плоскости рисунка. Атом кислорода располагают в пиранозном цикле в дальнем правом углу, в фуранозном - за плоскостью цикла. Символы атомов углерода в циклах не указывают.
Для перехода к формулам Хеуорса циклическую формулу Фишера преобразуют так, чтобы атом кислорода цикла располагался на одной прямой с атомами углерода, входящими в цикл. Это показано ниже на примере a-d-глюкопиранозы путем двух перестановок у атома С-5, что не изменяет конфигурацию этого асимметрического центра. Если преобразованную формулу Фишера расположить горизонтально, как требуют правила написания формул Хеуорса, то заместители,
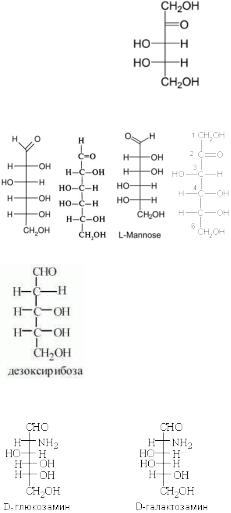
находившиеся справа от вертикальной линии углеродной цепи, окажутся под плоскостью цикла, а те, что были слева, - над этой плоскостью.
Химическая сущность мутаротации состоит в способности моносахаридов к существованию в виде равновесной смеси таутомеров - открытой и циклических форм. Такой вид таутомерии называется циклотаутомерией.
В растворах равновесие между четырьмя циклическими таутомерами моносахаридов устанавливается через открытую форму - оксоформу. Взаимопревращение a- и β-аномеров друг в друга через промежуточную оксоформу называет-
ся аномеризацией.
Таким образом, в растворе d-глюкоза существует в виде таутомеров: оксоформы и a- и β-аномеров пиранозных и фуранозных циклических форм.
31+32. СТРОЕНИЕ НАИБОЛЕЕ ВАЖНЫХ ПРЕДСТАВИТЕЛЕЙ ГЕКСОЗ: ГЛЮКОЗА, ГАЛАКТОЗА, ФРУКТОЗА. СТРОЕНИЕ НАИБОЛЕЕ ВАЖНЫХ ПРЕДСТАВИТЕЛЕЙ ПЕНТОЗ: РИБОЗА, 2-ДЕЗОКСИРИБОЗА.
Пентозы - химическое название класса пятиуглеродных моносахаридов, то есть сахаров, общей формулой которых является C5(H2O)5, или C5H10O5.
Рибоза, ксилоза, рибулоза
 ,
, ,
,
Гексозы, C6H12O6, простые сахара — моносахариды.
Глюкоза, галактоза, манноза, фруктоза
,, ,
Дезоксисахара (2-дезоксирибоза)
2-амигносахаров глюкозамин, галактозамин, маннозамин
33. КЛАССИФИКАЦИЯ ПОЛИСАХАРИДОВ, ФУНКЦИИ В ОРГАНИЗМЕ.
Полисахариды, состоящие из остатков одного и того же моносахарида, называются гомополисахаридами. К гомополисахаридам относятся полисахариды:
•растительного происхождения (крахмал (С6Н10О5)n, целлюлоза (С6Н10О5)n, пектиновые вещества),
•животного происхождения (гликоген, хитин),
•бактериального происхождения (декстраны).
Полисахариды, состоящие из остатков разных моносахаридов, называются гетерополисахаридами. Инулин — полисахарид формулы (С6Н10О5)n (НЕ ПУТАТЬ С ИНСУЛИНОМ!)
34. ДИСАХАРИДЫ, СТРУКТУРА И СВОЙСТВА ОСНОВНЫХ БИОЛОГИЧЕСКИ ВАЖНЫХ ДИСАХАРИДОВ: МАЛЬТОЗЫ, ЛАКТОЗЫ, САХАРОЗЫ, ЦЕЛЛОБИОЗЫ.
Дисахариды: классификация (редуцируюище - мальтоза, целлобиоза, лактоза и нередуцирующие сахароза, трегалоза) Среди дисахаридов наиболее широко распространены мальтоза (глюкоза + глюкоза), лактоза (глюкоза + галактоза), сахароза (глюкоза + фруктоза).
Классификация:
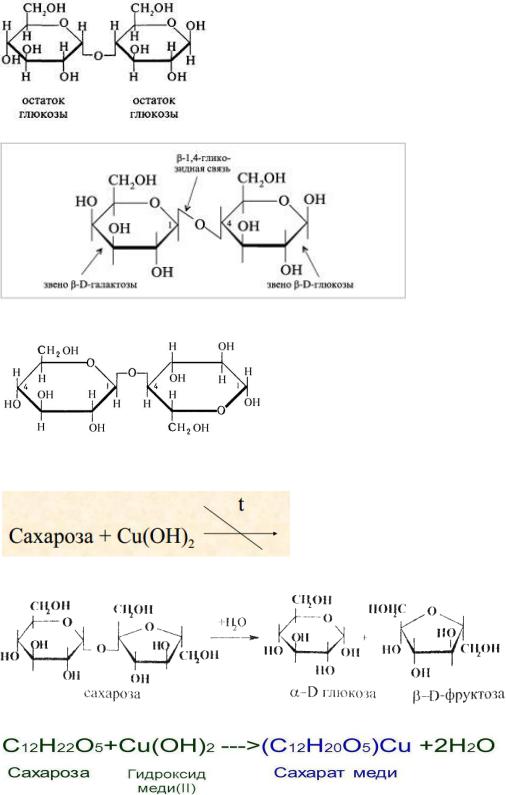
1.Понятие «редуцирующие сахара» обозначает группу Сахаров, которые в химической реакции оказывают восстанавливающее действие на соответствующие реагенты
Мальтоза (α-D-Глюкоза D-Глюкоза)
Лактоза (в-гал, в-гал)
Целлобиоза (в-глю, в-глю)
Невосстанавливающие дисахариды (нередуцирующие сахара) 1. Сахароза – невосстанавливающий дисахарид
2.Гидролиз сахарозы
3.Реакция на многоатомность сахарозы
35. ГОМОПОЛИСАХАРИДЫ: КРАХМАЛ (АМИЛОЗА И АМИЛОПЕКТИН), ГЛИКОГЕН, ЦЕЛЛЮЛОЗА, СТРОЕНИЕ, СВОЙСТВА, БИОЛОГИЧЕСКАЯ РОЛЬ.
Полисахариды, состоящие из остатков одного и того же моносахарида, называются гомополисахаридами. К гомополисахаридам относятся полисахариды:
•растительного происхождения (крахмал (С6Н10О5)n, целлюлоза (С6Н10О5)n, пектиновые вещества),
•животного происхождения (гликоген, хитин),
•бактериального происхождения (декстраны)
Крахмал (С6Н10О5)n
Смесь амилазы (10-20%) и амилопектина (80-90%).
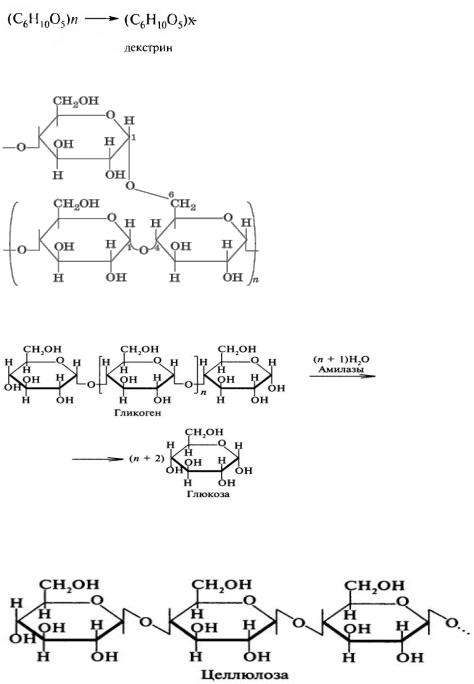
Амилаза – молекула, закрученная в спираль. Амилопектин имеет разветвленное строение. Связи: а[1→4] – в цепи, в[1→6]- в точке разветвления
Гидролиз крахмала расщепляет а[1→4] и а[1→6] Конечный продукт глюкоза и мальтоза.
Гликоген
Декстран (С6Н10О5)х – полисахарид бактериального происхождения. Состоит из а-D-гликопиранозных остатков, сильно разветвлён. Связи: в цепи - а[1→6] и в месте разветвления - а[1→4], а[1→3].
Целлюлоза (C6H10O5)n
D-гликопираноза, в[1→4] гликозидная связь.
Биороль. Для человека крахмал является важным пищевым углеводом; содержание его в муке составляет 75–80%, в картофеле – 25%.
Гликоген – главный резервный полисахарид высших животных и человека, построенный из остатков D-глюкозы. Эмпирическая формула гликогена, как и крахмала, (С6Н10О5)n. Гликоген содержится практически во всех органах и тканях животных и человека; наибольшее количество обнаружено в печени и мышцах. Молекулярная масса гликогена 105–108 Да и более. Его молекула построена из ветвящихся полиглюкозидных цепей, в которых остатки глюкозы соединены α-1– >4-гликозидными связями. В точках ветвления имеются α-1–>6-гликозидные связи. По строению гликоген близок к амилопектину. В молекуле гликогена различают внутренние ветви – участки от периферической точки ветвления до нереду- ци-рующего конца цепи.Гликоген характеризуется более разветвленной структурой, чем амило-пектин; линейные отрезки в молекуле гликогена включают 11–18 остатков α-D-глюкопиранозы.
При гидролизе гликоген, подобно крахмалу, расщепляется с образованием сначала декстринов, затем мальтозы и, наконец, глюкозы.
Инулин – полисахарид, содержащийся в клубнях и корнях георгинов, артишоков и одуванчиков. При его гидролизе образуется фруктоза, следовательно, он представляет собой фруктазан.
36. ГЕТЕРОПОЛИСАХАРИДЫ, ГИАЛУРОНОВАЯ КИСЛОТА, ХОНДРОИТИНСУЛЬФАТЫ, СТРОЕНИЕ, БИОЛОГИЧЕСКАЯ РОЛЬ.
Полисахариды, в структуре которых характерно наличие двух или более типов мономерных звеньев, носят название гетерополисахаридов.
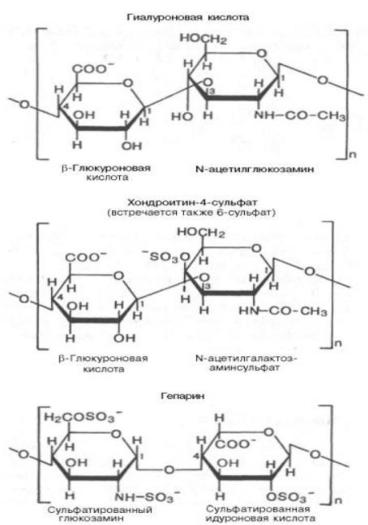
Гиалуроновая кислота является главным компонентом синовиальной жидкости, отвечающим за её вязкость. Гиалуроновая кислота — важный компонент суставного хряща, в котором присутствует в виде оболочки каждой клетки (хондроцита). При связывании гиалуроновой кислоты с мономерами аггрекана в присутствии связующего белка, в хряще формируются крупные отрицательно заряженные агрегаты, поглощающие воду. Эти агрегаты отвечают за упругость хряща (устойчивость его к компрессии). Молекулярная масса (длина цепи) гиалуроновой кислоты в хряще уменьшается с возрастом организма, при этом общее её содержание увеличивается.
Также гиалуроновая кислота входит в состав кожи, где участвует в регенерации ткани. При чрезмерном воздействии на кожу ультрафиолета происходит её воспаление («солнечный ожог»), при этом в клетках дермы прекращается синтез гиалуроновой кислоты и увеличивается скорость её распада. Гиалуро́новая кислота́(гиалурона́т, гиалурона́н) — несульфированный гликозаминогликан, входящий в составсоединительной, эпителиальной и нервной тканей. Является одним из основных компонентов внеклеточного матрикса, содержится во многих биологических жидкостях (слюне, синовиальной жидкости и др.). Принимает значительное участие в пролиферации и миграции клеток, может быть вовлечена в процесс развития злокачественных опухолей.
Хондроитинсульфаты — полимерные сульфатированные гликозаминогликаны. Являются специфическими компонентами хряща. Вырабатываются хрящевой тканью суставов, входят в состав синовиальной жидкости. Необходимым строительным компонентом хондроитинсульфата является глюкозамин, при недостатке глюкозамина в составе синовиальной жидкости образуется недостаток хондроитинсульфата, что ухудшает качество синовиальной жидкости и может вызвать хруст в суставах.
Гепарин — кислый серосодержащий гликозаминогликан; впервые выделен из печени. В клинической практике известен как прямой антикоагулянт, то есть как вещество, препятствующее свёртыванию крови. Применяется для профилактики и терапии тромбоэмболических заболеваний, при операциях на сердце и кровеносных сосудах, для поддержания жидкого состояния крови в аппаратах искусственного кровообращения и гемодиализа, а также для предотвращения свертывания крови при лабораторных исследованиях. Синтезируется в тучных клетках, скопления которых находятся в органах животных, особенно в печени, лёгких, стенках сосудов.
37. АЗОТИСТЫЕ ОСНОВАНИЯ ПИРИМИДИНОВЫЕ (ТИМИН, УРАЦИЛ, ЦИТОЗИН) И ПУРИНОВЫЕ (АДЕНИН, ГУАНИН), СТРОЕНИЕ, ЛАКТИМ-ЛАКТАМНАЯ ТАУТОМЕРИЯ.
Азотистые основания — это ароматические гетероциклические соединения, производные пиримидина или пурина.Пять соединений этого класса являются основными структурными компонентами нуклеиновых кислот
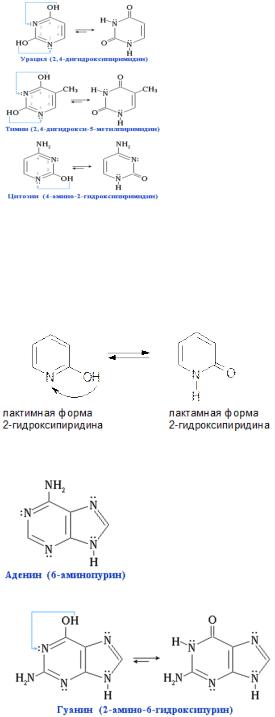
Пиримидиновые основания – производные пиримидина, входящие в состав нуклеиновых кислот: урацил, тимин, цитозин.
Для оснований, содержащих группу —OH, характерно подвижное равновесие структурных изомеров, обусловленное переносом протона от кислорода к азоту и наоборот:
Подобное динамическое равновесие структурных изомеров называют лактим-лактамной таутомерией. Пиримидиновые основания входят в состав нуклеозидов — структурных компонентов нуклеиновых кислот.
ЛАКТИМ-ЛАКТАМНАЯ ТАУТОМЕРИЯ
Этот вид таутомерии характерен для азотсодержащих гетероциклов с фрагментом N=C—ОН.
Взаимопревращение таутомерных форм связано с переносом протона от гидроксильной группы, напоминающей фенольную ОН-группу, к основному центру — пиридиновому атому азота и наоборот. Обычно лактамная форма в равновесии преобладает.
Пуриновые основания – производные пурина, входящие в состав нуклеиновых кислот: аденин, гуанин.
Гуанин существует в виде двух структурных изомеров
Образование нуклеозидов происходит, как и в случае пиримидиновых оснований, по связи N-H имидазольного цикла.
38. НУКЛЕОЗИДЫ, СТРОЕНИЕ, НОМЕНКЛАТУРА, ГИДРОЛИЗ, ХАРАКТЕР СВЯЗИ НУКЛЕИНОВОГО ОСНОВАНИЯ С УГЛЕВОДНЫМ ОСТАТКОМ.
Нуклеозиды – это производные азотистых оснований, образуются за счет образования N-гликозидной связи между первым атомом углерода в пентозе и первым атомом азота в пиримидину или девятым атомом азота в пурине.
С точки зрения строения нуклеозиды делятся на:
1.пиримидиновые и имеют окончание – дин. В свою очередь, которые делятся на: А) рибонуклеозиды, например: уридин, цитидин, тимидин.
В) дезоксирибонуклеозиды, например: дезокситимидин, дезоксицитидин, дезоксиурацидин. 2.пуриновые и имеют окончание –зин. Так же делятся на:
А) рибонуклеозиды, например: аденазин, гуанозин.
В) дезоксирибонуклеозиды, например: дезоксиаденазин, дезоксигуанозин.
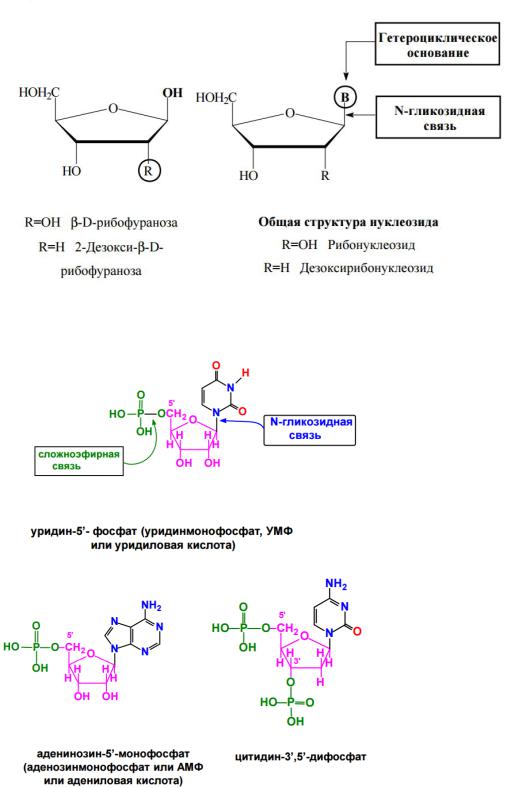
Аденин, гуанин и цитозин встречаются как в дезокситак и в рибонуклеозидах, а тимин образует устойчивые связи с дезоксирибонуклеозидами и урацил - с рибонуклеозидами.
Нуклеозиды выполняют только метаболическую функцию, входят в состав нуклеотидов.
39. НУКЛЕОТИДЫ, СТРОЕНИЕ, НОМЕНКЛАТУРА, ГИДРОЛИЗ, ХАРАКТЕР СВЯЗЕЙ МЕЖДУ КОМПОНЕНТАМИ НУКЛЕОТИДА.
Нуклеотиды – сложные эфиры нуклеозидов и фосфорных кислот
Соединения, состоящие из двух нуклеотидовых молекул, называются динуклеотидами, из трёх — тринуклеотидами, из небольшого числа — олигонуклеотидами, а из многих — полинуклеотидами Биологическая роль
1.Универсальный источник энергии (АТФ и его аналоги).
2.Являются активаторами и переносчиками мономеров в клетке(УДФ-глюкоза)
3.Выступают в роли коферментов (ФАД, ФМН, НАД+, НАДФ+)
4.Циклические мононуклеотиды являются вторичными посредниками при действии гормонов и других сигналов (цАМФ, цГМФ).
5.Аллостерические регуляторы активности ферментов.
6.Являются мономерами в составе нуклеиновых кислот, связанные 3′-5′-фосфодиэфирными связями.
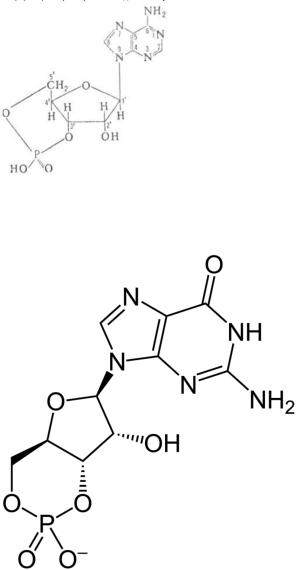
40. СВОБОДНЫЕ НУКЛЕОТИДЫ: ЦАМФ И ЦГМФ, АТФ, АДФ, ФАД, НАД, СТРОЕНИЕ, ФУНКЦИИ В ОРГАНИЗМЕ.
ЦАМФ — аденозинмонофосфат циклический, производное АТФ. 3'5'-цAMФ синтезируется аденилатциклазой в ответ на некоторые гормональные стимуляторы; действует как вторичный посредник при клеточном гормональном контроле путём стимуляции протеинкиназ. цАМФ является аллостерическим эффектором протеинкиназ A и ионных каналов. Синтезируется цАМФ мембранными аденилатциклазами (семейство ферментов, катализирующих реакцию циклизации АТФ с образованием цАМФ и неорганического пирофосфата). Расщепление цАМФ с образованием АМФ катализируется фосфодиэстеразами. Ингибируются цАМФ только при высоких концентрациях метилированных производных ксантина, например, кофеина.
ЦГМФ — Циклический гуанозинмонофосфат, это циклическая форма нуклеотида, образующаяся из гуанозинтрифосфата ферментом гуанилатциклазой. цГМФ действует как вторичный посредник и его действие подобно цАМФ, в основном активируя внутриклеточные протеинкиназы в ответ на связывание с клеточной мембраной пептидных гормонов (для которых мембрана непроницаема) с внешней стороны клетки.
АТФ — аденозинтрифосфат. Главная роль АТФ в организме связана с обеспечением энергией многочисленных биохимических реакций. Являясь носителем двух высокоэнергетических связей, АТФ служит непосредственным источником энергии для множества энергозатратных биохимических и физиологических процессов. Всё это реакции синтеза сложных веществ в организме: осуществление активного переноса молекул через биологические мембраны, в том числе и для создания трансмембранного электрического потенциала; осуществления мышечного сокращения.
Помимо энергетической АТФ выполняет в организме ещё ряд других не менее важных функций:
Вместе с другими нуклеозидтрифосфатами АТФ является исходным продуктом при синтезе нуклеиновых кислот. Кроме того, АТФ отводится важное место в регуляции множества биохимических процессов. Являясь аллостерическим эффектором ряда ферментов, АТФ, присоединяясь к их регуляторным центрам, усиливает или подавляет их активность. АТФ является также непосредственным предшественником синтеза циклического аденозинмонофосфата — вторичного посредника передачи в клетку гормонального сигнала.
Также известна роль АТФ в качестве медиатора в синапсах и сигнального вещества в других межклеточных взаимодействиях (пуринергическая передача сигнала).
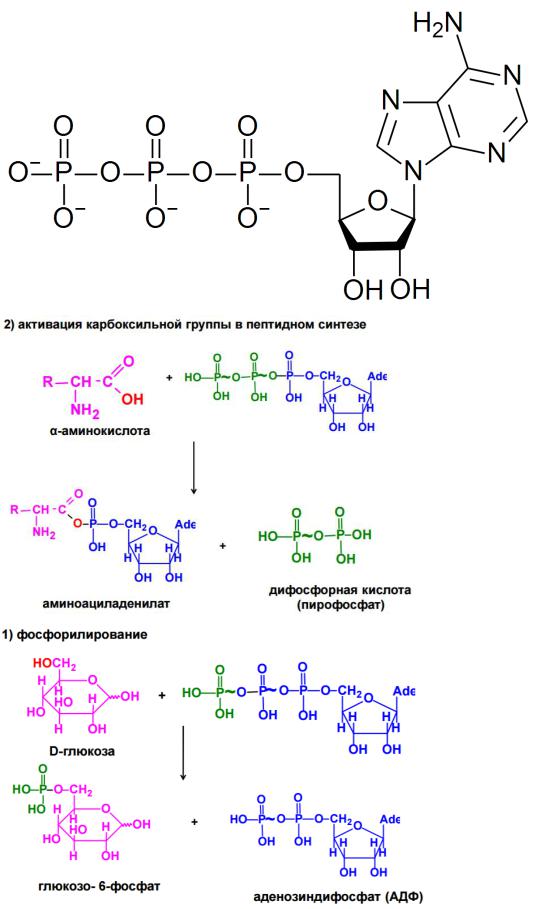

АДФ — аденозиндифосфат. нуклеотид, состоящий из аденина, рибозы и двух остатков фосфорной кислоты. АДФ образуется в результате переноса концевой фосфатной группы Аденозинтрифосфата (АТФ). АДФ участвует в энергетическом обмене во всех живых организмах, из него образуется АТФ путём фосфорилирования с затратами энергии (субстратное фосфорилирование, окислительное фосфорилирование, или фотофосфорилирование при фотосинтезе)
ФАД — флавинадениндинуклеотид, кофермент, принимающий участие во многих окислительно-восстановительных биохимических процессах. ФАД существует в двух формах — окисленной и восстановленной, его биохимическая функция, как правило, заключается в переходе между этими формами
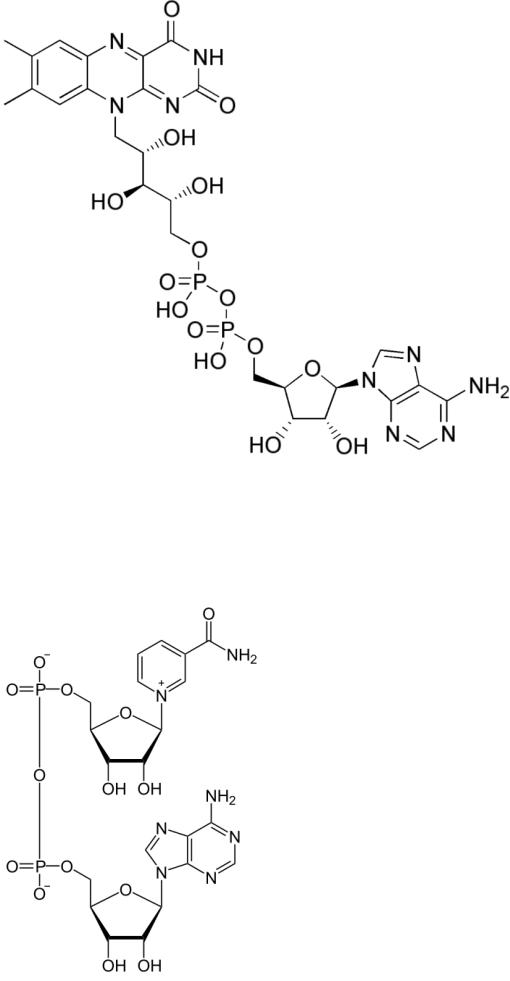
НАД — Никотинамидадениндинуклеотид. NAD выполняет несколько важнейших функций в метаболизме. Он выступает как кофермент в окислительно-восстановительных реакциях, как обязательный кофактор (простетическая группа) ферментов (циклаз фосфорилированных углеводов, различных эпимераз и др.), как донор ADP-рибозных остатков в реакциях ADP-рибозилирования (одна из реакций посттрансляционной модификации белков), как предшественник циклической ADP-рибозы, являющейся вторичным посредником, а также как субстрат для бактериальных ДНК-лигаз и группы ферментов — сиртуинов, которые используют NAD+ для удаления ацетильных группс ферментов. Кроме этих метаболических функций, NAD+ может также выполнять важные функции вне клетки, так как он может выделяться из клетки спонтанно или в результате регулируемых процессов
41. ПЕРВИЧНАЯ СТРУКТУРА НУКЛЕИНОВЫХ КИСЛОТ, НУКЛЕОТИДНЫЙ СОСТАВ ДНК/РНК.
Под первичной структурой нуклеиновых кислот понимают порядок, последовательность расположения мононуклеотидов
вполинуклеотидной цепи ДНК и РНК. Такая цепь стабилизируется 3',5'-фосфодиэфирными связями. Поскольку молекулярная масса нуклеиновых кислот колеблется в широких пределах (от 2•104 до 1010–1011), установить первичную структуру всех известных РНК и особенно ДНК весьма сложно. Тем не менее во всех нуклеиновых кислотах (точнее, в одноцепочечной нуклеиновой кислоте) имеется один и тот же тип связи – 3',5'-фосфодиэфирная связь между соседними нуклеотидами.
Первичная структура ДНК - порядок чередования дезоксирибонуклеозидмонофосфатов (дНМФ) в полинукпеотидной цепи.
Каждая фосфатная группа в полинукпеотидной цепи, за исключением фосфорного остатка на 5'-конце молекулы, участвует в образовании двух эфирных связей с участием 3'- и 5'-углеродных атомов двух соседних дезоксирибоз, поэтому связь между мономерами обозначают 3', 5'-фосфодиэфирной.
Концевые нуклеотиды ДНК различают по структуре: на 5'-конце находится фосфатная группа, а на 3'-конце цепи - свободная ОН-группа. Эти концы называют 5'- и 3'-концами. Линейная последовательность дезоксирибонуклеотидов в полимерной цепи ДНК обычно сокращённо записывают с помощью однобуквенного кода, например -A-G-C-T-T-A-C-A- от 5'- к 3'-концу.
В каждом мономере нуклеиновой кислоты присутствует остаток фосфорной кислоты. При рН 7 фосфатная группа полностью ионизирована, поэтому in vivo нуклеиновые кислоты существуют в виде полианионов (имеют множественный отрицательный заряд). Остатки пентоз тоже проявляют гидрофильные свойства. Азотистые основания почти нерастворимы
вводе, но некоторые атомы пуринового и пиримидинового циклов способны образовывать водородные связи. Первичная структура РНК - порядок чередования рибонуклеозидмонофосфатов (НМФ) в полинуклеотидной цепи. В РНК, как и в ДНК, нуклеотиды связаны между собой 3',5'-фосфодиэфирными связями. Концы полинуклеотидных цепей РНК неодинаковы. На одном конце находится фосфорилированная ОН-группа 5'-углеродного атома, на другом конце - ОН-группа 3'-углеродного атома рибозы, поэтому концы называют 5'- и 3'-концами цепи РНК. Гидроксильная группа у 2'-углеродного атома рибозы делает молекулу РНК нестабильной. Так, в слабощелочной среде молекулы РНК гидролизуются даже при нормальной температуре, тогда как структура цепи ДНК не изменяется.
Нуклеотидный состав ДНК подчиняется правилу Чаргаффа -г содержание А равно содержанию Т, а содержание Ц — содержанию Г
42. ПОНЯТИЕ О ВТОРИЧНОЙ СТРУКТУРЕ ДНК. КОМПЛЕМЕНТАРНОСТЬ АЗОТИСТЫХ ОСНОВАНИЙ, ВОДОРОДНЫЕ СВЯЗИ В КОМПЛЕМЕНТАРНЫХ ПАРАХ.
43. АМИНОКИСЛОТЫ, НОМЕНКЛАТУРА, КЛАССИФИКАЦИЯ ПО ПОЛЯРНОСТИ РАДИКАЛА И ПИЩЕВОЙ ЦЕННОСТИ, ПРИМЕРЫ.
Аминокислотами называются соединения, содержащие одновременно аминогруппы и карбоксильные группы.
По систематической номенклатуре названия аминокислот образуются из названий соответствующих кислот прибавлением приставки амино и указанием места расположения аминогруппы по отношению к карбоксильной группе.
Например:
Часто используется также другой способ построения названий аминокислот, согласно которому к тривиальному названию карбоновой кислоты добавляется приставка амино с указанием положения аминогруппы буквой греческого алфави-
та. Пример:
Для a-аминокислот, которые играют исключительно важную роль в процессах жизнедеятельности животных и растений, применяются тривиальные названия.
По химической природе радикала R α-аминокислоты делятся на алифатические, ароматические и гетероциклические
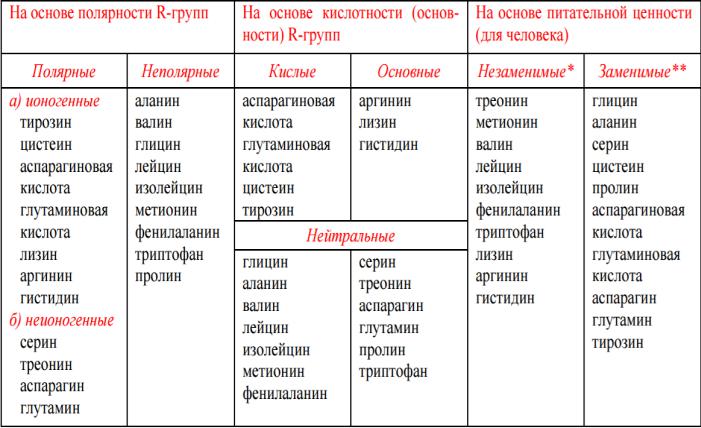
44. СТЕРЕОИЗОМЕРИЯ АМИНОКИСЛОТ.
Стереохимия аминокислот. Важнейшим свойством аминокислот, освобождающихся в процессе гидролиза природных белков в условиях, исключающих рацемизацию, является их оптическая активность. Это свойство связано с наличием в молекуле всех природных аминокислот (за ислючением глицина) в α-положении асимметрического атома углерода. Стереохимию аминокислот принято оценивать не по оптическому вращению, а исходя из абсолютной конфигурации всех четырех замещающих групп, расположенных вокруг асимметрического атома углерода в вершинах модели тетраэдра. Абсолютную конфигурацию аминокислот принято соотносить стереохимически с соединением, произвольно взятым для сравнения, а именно с глицериновым альдегидом, также содержащим асимметрический атом углерода. Все аминокислоты, образующиеся при гидролизе природных белков в условиях, исключающих рацемизацию, принадлежит к L-ряду. Таким образом, природные аминокислоты имеют пространственное расположение, аналогичное конфигурации L- глицеринового альдегида.
Во всех α-аминокислотах, кроме глицина, α-углеродный атом имеет 4 различных заместителя, т.е. является хиральным центром. Из-за этой структурной особенности аминокислоты могут существовать в различных стереоизомерных формах, отличающихся друг от друга различной пространственной ориентацией групп, присоединенных к α-углеродному атому. Пространственная конфигурация α-углеродного атома в аминокислотах определяется путем сравнения с эталонным соединением – глицеральдегидом. Два возможных стереоизомера глицеральдегида принято обозначать буквами L и D. В состав белков человеческого организма входят только L-аминокислоты. D-аминокислоты встречаются довольно редко, например, они входят в состав белков клеточной стенки бактерий, в состав некоторых пептидных антибиотиков.
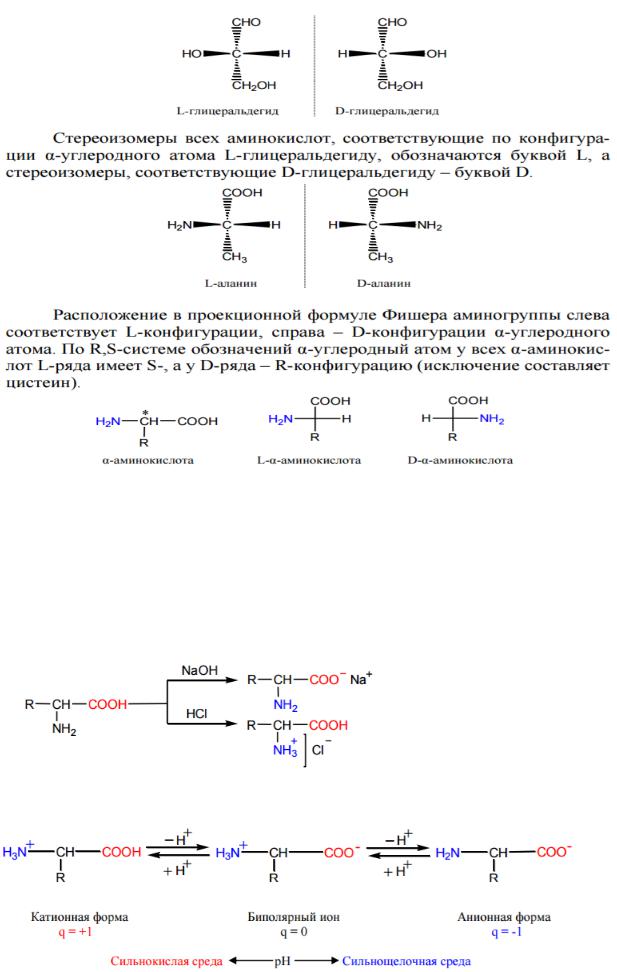
45. КИСЛОТНО-ОСНОВНЫЕ СВОЙСТВА АМИНОКИСЛОТ. БИПОЛЯРНЫЕ ИОНЫ, ИЗОЭЛЕКТРИЧЕСКАЯ ТОЧКА.
Кислотно-основные свойства. Эти свойства аминокислот определяют многие физико-химические и биологические свойства белков. На этих свойствах основаны, кроме того, почти все методы выделения и идентификации аминокислот. Аминокислоты легко растворимы в воде. Они кристаллизуются из нейтральных водных растворов в форме биполярных (амфотерных) ионов, а не в виде недиссоциированных молекул. В связи с этим, они могут проявлять как основные, так и кислотные свойства, что зависит еще от природы входящего в их состав радикала.
α-Аминокислоты являются амфотерными соединениями, что обусловлено наличием в их молекулах функциональных групп кислотного (COOH) и основного (NH2) характера. Поэтому α-аминокислоты образуют соли как со щелочами, так и с кислотами:
В водном растворе α-аминокислота существует в виде равновесной смеси биполярного иона, катионной и анионной форм молекул. Положение равновесия зависит от pH среды.
Изоэлектрическая точка (pI) — кислотность среды (pH), при которой определённая молекула или поверхность не несёт электрического заряда. Суммарный заряд аминокислоты определяется pH, т.е. заряд меняется вслед за изменением pH
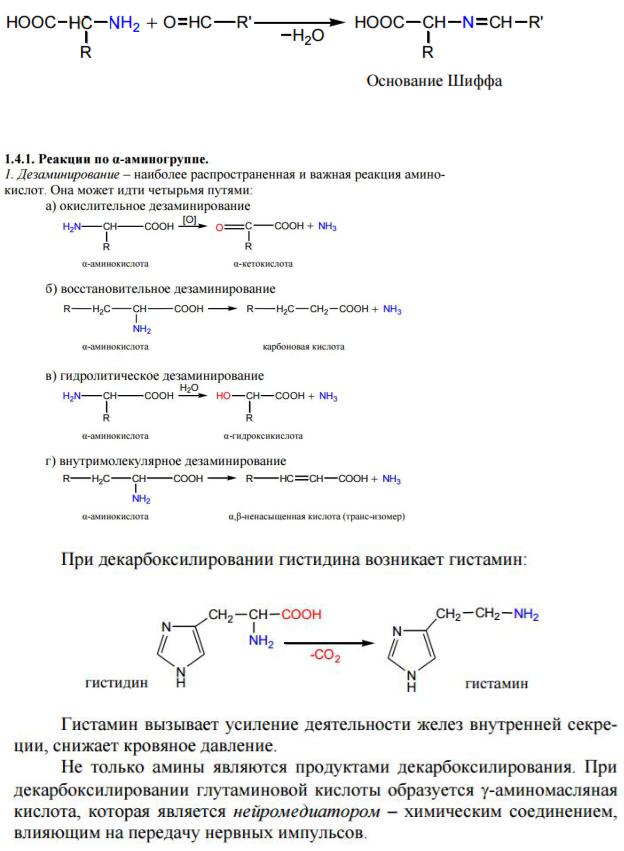
46. ХИМИЧЕСКИЕ СВОЙСТВА АМИНОКИСЛОТ, БИОЛОГИЧЕСКИ ВАЖНЫЕ СВОЙСТВА АМИНОКИСЛОТ.
Образование оснований Шиффа. При взаимодействии α-аминокислот с карбонильными соединениями образуются замещенные имины (основания Шиффа)
Основания Шиффа являются промежуточными продуктами в важном процессе превращения α-аминокислот в организме
– переаминировании (трансаминировании). Реакция осуществляется с участием ферментов трансаминаз (аминотрансфераз) и кофермента пиридоксальфосфата
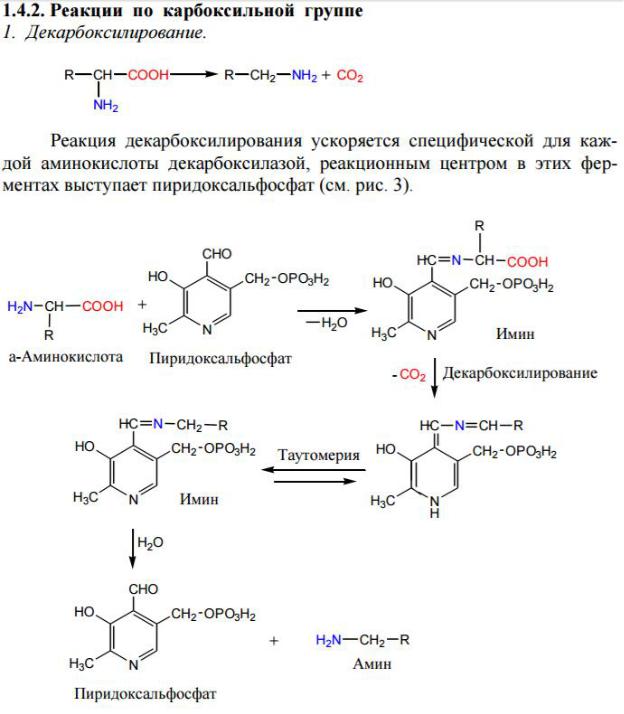
Важной особенностью аминокислот является их способность к поликонденсации, приводящей к образованию полиамидов, в том числе пептидов, белков, нейлона, капрона, энанта.
47. ФИЗИОЛОГИЧЕСКИ АКТИВНЫЕ ПЕПТИДЫ, ПРИМЕРЫ.
Пептиды, обладая высокой физиологической активностью, регулируют различные биологические процессы. По биорегуляторному действию пептиды принято делить на несколько групп:
/соединения, обладающие гормональной активностью (глюкагон, окситоцин, вазопрессин и др.); /вещества, регулирующие пищеварительные процессы (гастрин, желудочный ингибирующий пептид и др.); /пептиды, регулирующие аппетит (эндорфины, нейропептид-Y, лептин и др.);
/соединения, обладающие обезболивающим эффектом (опиоидные пептиды); /органические вещества, регулирующие высшую нервную деятельность, биохимические процессы, связанные с механизмами памяти, обучения, возникновением чувства страха, ярости и др.;
/пептиды, которые регулируют артериальное давление и тонус сосудов (ангиотензин II, брадикинин и др.). /пептиды, которые обладают противоопухолевым и противовоспалительным свойствами (Луназин)
48. УРОВНИ ОРГАНИЗАЦИИ БЕЛКОВОЙ МОЛЕКУЛЫ: ПЕРВИЧНАЯ СТРУКТУРА БЕЛКА, ЭЛЕКТРОННОЕ СТРОЕНИЕ ПЕПТИДНОЙ СВЯЗИ И ЕЕ ХАРАКТЕРИСТИКА, ЗАВИСИМОСТЬ СВОЙСТВ БЕЛКА ОТ ПЕРВИЧНОЙ СТРУКТУРЫ.
Первичная структура — последовательность аминокислот в полипептидной цепи. Важными особенностями первичной структуры являются консервативные мотивы — сочетания аминокислот, играющих ключевую роль в функциях белка. Консервативные мотивы сохраняются в процессе эволюции видов, по ним часто удаётся предсказать функцию неизвестного белка. Первичная структура предопределяет все дальнейшие виды организации белковой молекулы.
Пептидная связь — вид амидной связи, возникающей при образовании белков и пептидов в результате взаимодействия α-аминогруппы (—NH2) одной аминокислоты с α-карбоксильной группой (—СООН) другой аминокислоты. Из
двух аминокислот (1) и (2) образуется дипептид (цепочка из двух аминокислот) и молекула воды. По этой же схеме рибосома генерирует и более длинные цепочки из аминокислот: полипептиды и белки.
Анализ данных о первичной структуре белков позволяет сделать следующие общие выводы.
1.Первичная структура белков уникальна и детерминирована генетически. Каждый индивидуальный гомогенный белок характеризуется уникальной последовательностью аминокислот: частота замены аминокислот приводит не только к структурным перестройкам, но и к изменениям физико-химических свойств и биологических функций.
2.Стабильность первичной структуры обеспечивается в основном главновалентными пептидными связями; возможно участие небольшого числа дисульфидных связей.
3.В полипептидной цепи могут быть обнаружены разнообразные комбинации аминокислот; в полипептидах относительно редки повторяющиеся последовательности.
4.В некоторых ферментах, обладающих близкими каталитическими свойствами, встречаются идентичные пептидные структуры, содержащие неизменные (инвариантные) участки и вариабельные последовательности аминокислот, особенно в областях их активных центров. Этот принцип структурного подобия наиболее типичен для ряда протеолитических ферментов: трипсина, химотрипсина и др.
5.В первичной структуре полипептидной цепи детерминированы вторичная, третичная и четвертичная структуры белковой молекулы, определяющие ее общую пространственную конформацию.
Первичная структура инсулина у разных биологических видов несколько различается, как различается и его важность
в регуляции обмена углеводов. Наиболее близким к человеческому является инсулин свиньи, который различается с ним всего одним аминокислотным остатком: в 30 положении B-цепи свиного инсулина расположен аланин, а в инсулине человека —треонин; бычий инсулин отличается тремя аминокислотными остатками.
49. ВТОРИЧНАЯ СТРУКТУРА БЕЛКОВ, α-СПИРАЛЬ, β-СКЛАДЧАТЫЙ СЛОЙ, БЕСПОРЯДОЧНЫЙ КЛУБОК, СВЯЗИ, СТАБИЛИЗИРУЮЩИЕ ВТОРИЧНУЮ СТРУКТУРУ БЕЛКА.
Вторичная структура — локальное упорядочивание фрагмента полипептидной цепи, стабилизированное водородными связями. Ниже приведены самые распространённые типы вторичной структуры белков:
1)α-спирали — плотные витки вокруг длинной оси молекулы, один виток составляют 3,6 аминокислотных остатка, и шаг спирали составляет 0,54 нм (так что на один аминокислотный остаток приходится 0,15 нм), спираль стабилизирована водородными связями между H и O пептидных групп, отстоящих друг от друга на 4 звена. Спираль построена исключительно из одного типа стереоизомеров аминокислот (L). Хотя она может быть как левозакрученной, так и правозакрученной, в белках преобладает правозакрученная. Спираль нарушают электростатические взаимодействия глутаминовой кислоты, лизина, аргинина. Расположенные близко друг к другу остатки аспарагина, серина, треонина и лейцина могут стерически мешать образованию спирали, остатки пролина вызывает изгиб цепи и также нарушает α-спирали.
2)β-листы (складчатые слои) — несколько зигзагообразных полипептидных цепей, в которых водородные связи образуются между относительно удалёнными друг от друга (0,347 нм на аминокислотный остаток) в первичной структуре аминокислотами или разными цепями белка, а не близко расположенными, как имеет место в α-спирали. Эти цепи обычно направлены N-концами в противоположные стороны (антипараллельная ориентация). Для образования β-листов важны небольшие размеры боковых групп аминокислот, преобладают обычно глицин и аланин.
Стабильность вторичной структуры обеспечивается в основном водородными связями (определенный вклад вносят и главновалентные связи – пептидные и дисульфидные). Водородная связь представляет собой слабое электростатическое притяжение (взаимодействие, связь) между одним электроотрицательным атомом (например, кислородом или азотом) и водородным атомом, ковалентно связанным со вторым электроотрицательным атомом. По современным представлениям, водородная связь включает не только электростатические силы притяжения между полярными группами. но и электронные связи такого же типа, как в ряде комплексных соединений. Водородные связи, являясь нековалентными, отличаются малой прочностью. Поскольку в белковой молекуле число водородных связей очень велико (в образование водородных связей вовлечены все пептидные группы), они в сумме обеспечивают скручивание полипептидной цепи в спиральную структуру, сообщая ей компактность и стабильность.
50. ТРЕТИЧНАЯ И ЧЕТВЕРТИЧНАЯ СТРУКТУРЫ БЕЛКОВ, СВЯЗИ, ИХ СТАБИЛИЗИРУЮЩИЕ, ОСОБЕННОСТИ СТРОЕНИЯ И ФУНКЦИОНИРОВАНИЯ ОЛИГОМЕРНЫХ БЕЛКОВ НА ПРИМЕРЕ ГЕМОГЛОБИНА.
Третичная или трёхмерная структура — пространственное строение полипептидной цепи (набор пространственных координат составляющих белок атомов). Структурно состоит из элементов вторичной структуры, стабилизированных различными типами взаимодействий, в которых гидрофобные взаимодействия играют важнейшую роль. В стабилизации третичной структуры принимают участие:
1)диcульфи́дная связь — ковалентная связь между двумя атомами серы, входящими в состав серусодержащей аминокислоты цистеина. Образующие дисульфидную связь аминокислоты могут находиться как в одной, так и в разных полипептидных цепях белка. Дисульфидные связи образуются в процессе посттрансляционной модификации белков и служат для поддержания третичной и четвертичной структур белка;
2)ионные связи между противоположно заряженными боковыми группами аминокислотных остатков;
3)водородные связи;
4)гидрофильно-гидрофобные взаимодействия. При взаимодействии с окружающими молекулами воды белковая молекула «стремится» свернуться так, чтобы неполярные боковые группы аминокислот оказались изолированы от водного раствора; на поверхности молекулы оказываются полярные гидрофильные боковые группы.
Четверичная структура (или субъединичная, доменная) —способ укладки в пространстве отдельных полипептидных цепей, обладающих одинаковой (или разной) первичной, вторичной или третичной структурой, и формирование единого в структурном и функциональном отношениях макромолекулярно-го образования. Многие функциональные белки состоят из нескольких полипептидных цепей, соединенных не главновалентными связями, а неко-валентными (аналогичными тем, которые обеспечивают стабильность третичной структуры). Каждая отдельно взятая полипептидная цепь, получившая название протомера, мономера или субъединицы, чаще всего не обладает биологической активностью. Эту способность белок приобретает при определенном способе пространственного объединения входящих в его состав протомеров, т.е. возникает новое качество, не свойственное мономерному белку. Образовавшуюся молекулу принято называть олигомером (или мультимером). Олигомерные белки чаще построены из четного числа протомеров (от 2 до 4, реже от 6 до 8) с одинаковыми или разными молекулярными массами – от нескольких тысяч до сотен тысяч. В частности, молекула гемоглобина состоит из двух одинаковых α- и двух β-полипептидных цепей, т.е. представляет собой тетрамер. Молекула гемоглобина содержит четыре полипептидные цепи, каждая из которых окружает группу гема – пигмента, придающего крови ее характерный красный цвет. Основной вклад во взаимодействие субъединиц вносят гидрофобные взаимодействия. И α, и β-цепи относятся к α-спиральному структурному классу, так как содержат исключительно α- спирали. Каждая цепь содержит восемь спиральных участков. Простетическая группа нековалентно связана с гидрофобной впадиной молекулы гемоглобина.
Каждый индивидуальный белок, имеющий уникальную первичную структуру и конформацию, обладает и уникальной функцией, отличающей его от остальных белков. Набор индивидуальных белков выполняет в клетке множество разнообразных и сложных функций. Необходимое условие для функционирования белков - присоединение к нему другого вещества, которое называют "лиганд". Лигандами могут быть как низкомолекулярные вещества, так и макромолекулы. Взаимодействие белка с лигандом высокоспецифично и обратимо, что определяется строением участка белка, называемого центром связывания белка с лигандом или активным центром.
Активный центр белков - определённый участок белковой молекулы, как правило, находящийся в её углублении ("кармане"), сформированный радикалами аминокислот, собранных на определённом пространственном участке при формировании третичной структуры и способный комплементарно связываться с лигандом. В линейной последовательности полипептидной цепи радикалы, формирующие активный центр, могут находиться на значительном расстоянии друг от друга. Уникальные свойства активного центра зависят не только от химических свойств формирующих его аминокислот, но и от их точной взаимной ориентации в пространстве. Поэтому даже незначительные нарушения общей конформации белка в результате точечных изменений его первичной структуры или условий окружающей среды могут привести к изменению химических и функциональных свойств радикалов, формирующих активный центр, нарушать связывание белка с лигандом и его функцию. При денатурации активный центр белков разрушается, и происходит утрата их биологической активности.
Под комплементарностью понимают пространственное и химическое соответствие взаимодействующих молекул. Лиганд должен обладать способностью входить и пространственно совпадать с конформацией активного центра. Это совпадение может быть неполным, но благодаря конформационной лабильности белка активный центр способен к небольшим изменениям и "подгоняется" под лиганд. Кроме того, между функциональными группами лиганда и радикалами аминокислот, образующих активный центр, должны возникать связи, удерживающие лиганд в активном центре. Связи между лигандом и активным центром белка могут быть как нековалентными (ионными, водородными, гидрофобными), так и ковалентными.
51. КЛАССИФИКАЦИИ БЕЛКОВ.
Так, белки можно классифицировать:
1.по форме молекул (глобулярные или фибриллярные);
2.по молекулярной массе (низкомолекулярные, высокомолекулярные и др.);
3.по химическому строению (наличие или отсутствие небелковой части);
4.по выполняемым функциям (транспортные, защитные, структурные белки и др.);
5.по локализации в клетке (ядерные, цитоплазматические, лизосомальные и др.);
6.по локализации в организме (белки крови, печени, сердца и др.);
7.по возможности адаптивно регулировать количество данных белков: белки, синтезирующиеся с постоянной скоростью (конститутивные), и белки, синтез которых может усиливаться при воздействии факторов среды (индуцибельные);
8.по продолжительности жизни в клетке (от очень быстро обновляющихся белков, с Т1/2 менее 1 ч, до очень медленно обновляющихся белков, Т1/2 которых исчисляют неделями и месяцами);
9.по схожим участкам первичной структуры и родственным функциям (семейства белков).
Одной из самых старых и распространенных классификаций белков является классификация по форме молекулы.
Она делит белки на 2 группы: глобулярные и фибриллярные. К глобулярным относят белки, соотношение продольной и поперечной осей которых не превышает 1:10, а чаще составляет 1:3 или 1:4, т.е. белковая молекула имеет форму эллипса. Большинство индивидуальных белков человека относят к глобулярным белкам. Они имеют компактную структуру и многие из них, за счёт удаления гидрофобных радикалов внутрь молекулы, хорошо растворимы в воде. Фибриллярные белки имеют вытянутую, нитевидную структуру, в которой соотношение продольной и поперечной осей составляет более 1:10. К фибриллярным белкам относят коллагены, эластин, кератин, выполняющие в организме человека структурную функцию, а также миозин, участвующий в мышечном сокращении, и фибрин - белок свёртывающей системы крови.
По химическому строению белки делят на простые и сложные. Белки, содержащие в своём составе только полипептидные цепи, состоящие из аминокислотных остатков, называют простые белки. Примером простых белков могут служить основные белки хроматина - гистоны; в их составе содержится много аминокислотных остатков лизина и аргинина, радикалы которых имеют положительный заряд . Однако очень многие белки, кроме полипептидных цепей, содержат в своём составе небелковую часть, присоединённую к белку слабыми или ковалентными связями. Небелковая часть может быть представлена ионами металлов, какими-либо органическими молекулами с низкой или высокой молекулярной массой. Такие белки называют сложные белки. Прочно связанная с белком небелковая часть носит название простетической группы. Простетическая группа может быть представлена веществами разной природы. Например, белки, соединённые с гемом, носят название гемопротеины.
Белки, соединённые с остатком фосфорной кислоты, называют фосфопротеинами. Фосфорные остатки присоединяются сложноэфирной связью к гидроксильным группам серина, треонина или тирозина при участии ферментов, называемых протеинкиназами.
В состав белков часто входят углеводные остатки, придающие белкам дополнительную специфичность и часто уменьшающие скорость их ферментативного протеолиза. Такие белки носят название гликопротеинов. Многие белки крови, а также рецепторные белки клеточной поверхности относят к гликопротеинам.
Белки, функционирующие в комплексе с липидами, называют липопротеинами, а в комплексе с металлами - металло-
протеинами.
Сложный белок, состоящий из белковой части (апопротеин) и небелковой части (простетическая группа), называ-
ют "холопротеин".
В ходе эволюции в пределах одного биологического вида замены аминокислотных остатков могут приводить к возникновению разных белков, выполняющих родственные функции и имеющих гомологичные последовательности аминокислот. Такие белки, имеющие гомологичные участки полипептидной цепи, сходную конформацию и родственные функции,
выделяют в семейства белков
К семейству родственных белков относят сериновые протеазы. Это семейство ферментов, которые используют уникально активированный остаток серина, расположенный в активном центре, для связывания и каталитического гидролиза пептидных связей в белковых субстратах. Мишени для сериновых протеаз - специфические пептидные связи в белках (часто в других сериновых протеазах). Д ля всех белков этого семейства характерно наличие в активном центре остатков Сер195, Гис57, Асп102 (эту нумерацию используют независимо от их точного расположения в первичной структуре определённых сериновых протеаз). Выявлена также высокая схожесть их пространственных структур, несмотря на то, что только в 40% положений они содержат идентичные аминокислоты. Каталитический участок сериновых протеаз расположен в расщелине между двумя доменами. Некоторые аминокислотные замены привели к изменению субстратной специфичности этих белков и к возникновению функционального многообразия внутри этого семейства. Так, пищеварительные сериновые протеазы участвуют в переваривании (гидролитическом расщеплении пептидных связей) денатурированных пищевых белков. К ним относят трипсин, химотрипсин, эластазу, но каждый из этих ферментов предпочитает разрывать пептидные связи, образованные определёнными аминокислотами. Ещё большей субстратной специфичностью обладают сериновые протеазы, участвующие в тщательно контролируемых физиологических процессах, таких как активация каскада белков свёртывания крови, фибринолиза, активация белков системы комплемента, образования белковых гормонов. Иммуноглобулины, или антитела, - специфические белки, вырабатываемые В-лимфоцитами в ответ на попадание в организм чужеродных структур, называемых антигенами. В организме человека вырабатывается около 107 клонов В- лимфоцитов, каждый из которых специализирован на выработке одного из 107 видов иммуноглобулинов. Все иммуноглобулины характеризуются общим планом строения: состоят из четырёх полипептидных цепей: двух идентичных лёгких (L - от англ,light), содержащих около 220 аминокислотных остатков, и двух тяжёлых (Н - от англ. heavy), состоящих из 440 аминокислот каждая. Все 4 цепи соединены друг с другом множеством нековалентных и четырьмя дисульфидными связями. Лёгкие цепи состоят из 2 доменов: вариабельного (VL), находящегося в N-концевой области полипептидной цепи, и константного (CL), расположенного на С-конце. Каждый из доменов состоит из 2 слоев с β-складчатой структурой, где участки полипептидной цепи лежат антипараллельно. β-Слои связаны ковалентно дисульфидной связью примерно в середине домена. Тяжёлые цепи имеют 4 домена: один вариабельный (VH), находящийся на N-конце, и три константных (СН1, СН2, СH3). Домены тяжёлых цепей IgG имеют гомологичное строение с доменами лёгких цепей. Между двумя константными доменами тяжёлых цепей СH1, и СН2 есть участок, содержащий большое количество остатков пролина, которые препятствуют формированию вторичной структуры и взаимодействию соседних Н-цепей на этом отрезке. Этот участок называют "шарнирной областью"; он придаёт молекуле гибкость. Между вариабельными доменами тяжёлых и лёгких цепей находятся два идентичных участка, связывающих два одинаковых специфических антигена; поэтому такие антитела часто называют "биваленты". Основные функции антител - обнаружение и связывание чужеродных антигенов, находящихся в организме вне его клеток (в крови, лимфе, межклеточной жидкости, в слизистых секретах). Это происходит с помощью специфических антигенсвязывающих участков разных клонов иммуноглобулинов. Кроме, того, благодаря связыванию антигена с антителом облегчается процесс дальнейшего разрушения чужеродных веществ.
Специфичность пути разрушения комплекса антиген-антитело зависит от класса антител, которых существует 5 типов:
IgA, IgD, IgE, IgG, IgM.
52. ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА БЕЛКОВ, РАСТВОРИМОСТЬ, ИОНИЗАЦИЯ, ГИДРАТАЦИЯ, ДЕНАТУРАЦИЯ, РЕНАТУРАЦИЯ.
Индивидуальные белки различаются по своим физико-химическим свойствам: форме молекул, молекулярной массе, суммарному заряду молекулы, соотношению полярных и неполярных групп на поверхности нативной молекулы белка, растворимости белков, а также степени устойчивости к воздействию денатурирующих агентов.
Различия белков по молекулярной массе. Белки - высокомолекулярные соединения, но могут сильно отличаться по молекулярной массе, которая колеблется от 6000 до 1 000 000 Да и выше. Молекулярная масса белка зависит от количества аминокислотных остатков в полипептидной цепи, а для олигомерных белков - и от количества входящих в него протомеров (или субъединиц).
Различия белков по форме молекул. По форме молекул белки делят на глобулярные и фибриллярные. Глобулярные белки имеют более компактную структуру, их гидрофобные радикалы в большинстве своём спрятаны в гидрофобное ядро, и они значительно лучше растворимы в жидкостях организма, чем фибриллярные белки (исключение составляют мембранные белки).
Различия по растворимости белков. Растворимость белков в воде зависит от формы, молекулярной массы, величины заряда, соотношения полярных и неполярных функциональных групп на поверхности белка. Кроме этого, растворимость белка определяется составом растворителя, т.е. наличием в растворе других растворённых веществ. Например, некоторые белки легче растворяются в слабом солевом растворе, чем в дистиллированной воде. С другой стороны, увеличение концентрации нейтральных солей может способствовать выпадению определённых белков в осадок. Денатурирующие агенты, присутствующие в растворе, также снижают растворимость белков.
Различия по гидратации. На поверхности большинства внутриклеточных белков преобладают полярные радикалы, однако соотношение полярных и неполярных групп отлично для разных индивидуальных белков. Так, протомеры олигомерных белков в области контактов друг с другом часто содержат гидрофобные радикалы. Поверхности белков, функционирующих в составе мембран или прикрепляющиеся к ним в процессе функционирования, также обогащены гидрофобными радикалами. Такие белки лучше растворимы в липидах, чем в воде.
Различия по ионизации. Белки имеют в своём составе радикалы лизина, аргинина, гистидина, глутаминовой и аспарагиновой кислот, содержащие функциональные группы, способные к ионизации (ионогенные группы). Кроме того, на N- и С-концах полипептидных цепей имеются α-амино- и α-карбоксильная группы, также способные к ионизации. Суммарный заряд белковой молекулы зависит от соотношения ионизированных анионных радикалов Глу и Асп и катионных радикалов Лиз, Apг и Гис. Значение рН, при котором белок приобретает суммарный нулевой заряд, называют"изоэлектрическая точка" и обозначают как pI. В изоэлектрической точке количество положительно и отрицательно заряженных групп белка одинаково, т.е. белок находится в изоэлектрическом состоянии. Так как большинство белков в клетке имеет в своём составе больше анионогенных групп (-СОО-), то изоэлектрическая точка этих белков лежит в слабокислой среде. Изоэлектрическая точка белков, в составе которых преобладают катионогенные группы, находится в щелочной среде. Наиболее яркий пример таких внутриклеточных белков, содержащих много аргинина и лизина, - гистоны, входящие в состав хроматина. Белки, имеющие суммарный положительный или отрицательный заряд, лучше растворимы, чем белки, находящиеся в изоэлектрической точке. Суммарный заряд увеличивает количество диполей воды, способных связываться с белковой молекулой, и препятствует контакту одноимённо заряженных молекул, в результате растворимость белков увеличивается. Заряженные белки могут двигаться в электрическом поле: анионные белки, имеющие отрицательный заряд, будут двигаться к положительно заряженному аноду (+), а катионные белки - к отрицательно заряженному катоду (- ). Белки, находящиеся в изоэлектрическом состоянии, не перемещаются в электрическом поле.
53/54/55. РАСТВОРЫ ВМС КАК ЛИОФИЛЬНЫЕ КОЛЛОИДНЫЕ РАСТВОРЫ, ОСОБЕННОСТИ ОБРАЗОВАНИЯ МИЦЕЛЛ, УСТОЙЧИВОСТЬ И РАЗРУШЕНИЕ РАСТВОРОВ ПОЛИМЕРОВ, ВЫСАЛИВАНИЕ И СОЛЮБЛИЗАЦИЯ. 54. ОСОБЕННОСТИ РАСТВОРОВ ВМС, НАБУХАНИЕ И РАСТВОРЕНИЕ, ЗАВИСИМОСТЬ ВЕЛИЧИНЫ НАБУХАНИЯ ОТ РАЗЛИЧНЫХ ФАКТОРОВ, ИЗОЭЛЕКТРИЧЕСКАЯ ТОЧКА БЕЛКОВ. 55. АНОМАЛЬНАЯ ВЯЗКОСТЬ РАСТВОРОВ ВМС, ВЯЗКОСТЬ КРОВИ И ДРУГИХ БИОЛОГИЧЕСКИХ ЖИДКОСТЕЙ, ОНКОТИЧЕСКОЕ ДАВЛЕНИЕ ПЛАЗМЫ И СЫВОРОТКИ КРОВИ.
Высаливание. Метод выделения белков, основанный на различиях в их растворимости при разной концентрации соли в растворе. Соли щелочных и щёлочно-земельных металлов вызывают обратимое осаждение белков, т.е. после их удаления белки вновь приобретают способность растворяться, сохраняя при этом свои нативные свойства.
Чаще всего для разделения белков методом высаливания используют разные концентрации солей сульфата аммония - (NH4)2SO4. Чем выше растворимость белка, тем большая концентрация соли необходима для его высаливания. Молекулы ВМС имеют дифильный характер, так как содержат полярные (–COOH, –NH2, –OH и др.) и неполярные (– CH3, –CH2, –C6H5) функциональные группы. Чем больше полярных радикалов в молекуле ВМС, тем лучше оно растворимо. Растворимость ВМС зависит от величины и формы их молекул.
СВОЙСТВА РАСТВОРОВ ВМС (объединяющие их с истинными растворами)
1.Лекарственное вещество диспергировано до состояния молекул
2.При растворении ВМС растворы этих веществ образуются самопроизвольно
3.Растворы ВМС – гомогенные системы (нет границы раздела между растворяемым веществом и растворите-
лем)
4.Растворы ВМС – термодинамически равновесные системы
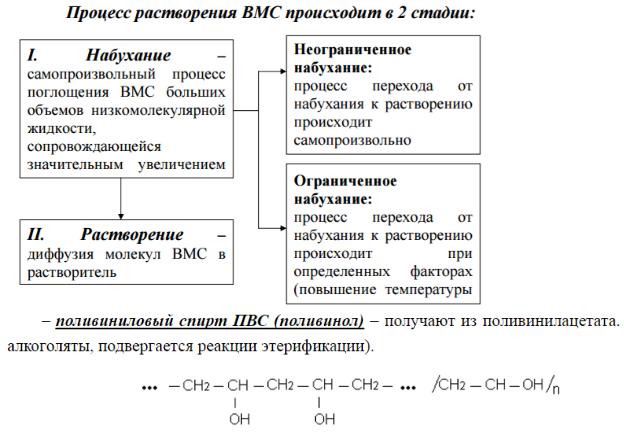
5. Для растворов ВМС характерно:
–броуновское движение;
–отсутствие явления Тиндаля
СВОЙСТВА РАСТВОРОВ ВМС (отличающие их от истинных)
1.Большой размер молекул
2.Низкое осмотическое давление
3.Малая диффузионная способность
4.Растворы ВМС не способны к диализу
5.Растворы ВМС могут изменяться под влиянием внешних факторов (добавление электролитов, изменение температуры и др.)
Коагуляция происходит в результате сжатия двойного электрического слоя и уменьшения или полного исчезновения электрического заряда, являющегося основным фактором устойчивости.
Высаливание – это уменьшение растворимости ВМС и выпадение в осадок.
Коацервация – раслаивание системы на два слоя.
Застудневание – особая промежуточная форма существования системы – студень или гель, причем, это состояние характеризуется полной утратой текучести.
Синерезис – явление застудневания, происходящее в самом студне, которое может привести к разделению системы на 2 фазы: концентрированный студень и растворитель, содержащий молекулы ВМС.
Коллоидные растворы представляют собой ультрамикрогетерогенную систему, в которой структурной единицей является комплекс молекул, атомов и ионов, называемых мицеллами. Мицелла является частицей дисперсной фазы, окруженная двойным электрическим слоем. Размер мицелл находится в пределах от 1 до 100 нм.
Строение мицеллы – ядро (отдельные молекулы гидрофобного вещества); гранула – адсорбционный слой ионов – противоионы (нейтрализуют гранулу) –диффузный слой ионов
56. КЛАССИФИКАЦИЯ СЛОЖНЫХ БЕЛКОВ.
В зависимости от химической природы простетических групп среди сложных белков выделяют следующие классы: Гликопротеиды, содержащие в качестве простетической группы ковалентно связанные углеводные остатки и их подкласс
— протеогликаны, с мукополисахаридными простетическими группами. В образовании связи с углеводными остатками обычно участвуют гидроксильные группы серина или треонина. Большая часть внеклеточных белков, в частности, имму-

ноглобулины — гликопротеиды. В протеогликанах углеводная часть составляет ~95 %, они являются основным компонентом межклеточного матрикса.
Липопротеиды, содержащие в качестве простетической части нековалентно связанные липиды. Липопротеиды, образованные белками-аполипопротеинами связывающимися с ними липидами и выполняют функцию транспорта липидов. Металлопротеины, содержащие негемовые координационно связанные ионы металлов. Среди металлопротеидов есть белки, выполняющие депонирующие и транспортные функции (например, железосодержащие ферритин и трансферрин) и ферменты (например, цинксодержащая карбоангидраза и различные супероксиддисмутазы, содержащие в качестве активных центров ионы меди, марганца, железа и других металлов)
Нуклеопротеины, содержащие нековалентно связанные ДНК или РНК, в частности, хроматин, из которого состоят хромосомы, является нуклеопротеидом.
Фосфопротеиды, содержащие в качестве простетической группы ковалентно связанные остатки фосфорной кислоты. В образовании сложноэфирной связи с фосфатом участвуют гидроксильные группы серина или треонина, фосфопротеинами являются, в частности, казеин молока:
Хромопротеиды — собирательное название сложных белков с окрашенными простетическими группами различной химической природы. К ним относится множество белков с металлсодержащей порфириновой простетической группой, выполняющие разнообразные функции — гемопротеины (белки, содержащие в качестве простетической группы гем — гемоглобин, цитохромы и др.), хлорофиллы; флавопротеиды с флавиновой группой, и др.
57. ГЕМОПРОТЕИНЫ, СРАВНИТЕЛЬНАЯ ХАРАКТЕРИСТИКА СТРУКТУР И ФУНКЦИЙ МИОГЛОБИНА И ГЕМОГЛОБИНА.
Белки, соединённые с гемом, носят название гемопротеины.
Миоглобин. Состоит из одной полипептидной цепи, содержащей 153 аминокислотных остатка (мол. м. 17800), к-рая уложена в плотную глобулу размером 4,5 х 2,5 нм. В специальной полости миоглобина ("кармане") помещается гем, который связан с остальной частью молекулы (глобином), как в гемоглобине. Около 75% полипептидной цепи находится в конформации α-спирали (все α-спирали правозакрученные). Между областями спирализации находятся 5 неспирализованных участков; такие же участки находятся на концах цепи. Внутренняя область молекулы состоит . из неполярных остатков лейцина, валина, метионина, фенилаланина и не содержит боковых полярных цепей глутаминовой и аспарагиновой к-т, глута-мина, аспарагина, лизина и аргинина. На наружной стороне молекулы расположены как полярные, так и неполярные аминокислотные остатки. Атом железа тема может находиться в 4 состояниях: в ферросостоянии (дезоксимиоглобин, Fe2 +), в феррисостоянии (метмиоглобин, Fe3 + , 6-й лиганд Н2О) и в низкоспиновых ферро- и феррисостояниях (соответственно Fe2+ и Fe3+ ). Связывание лигандов сопровождается конформационными изменениями белка, и, наоборот, конформационные изменения вблизи гема изменяют его электронное состояние и реакционную способность. Функция миоглобина запасать О2 в мышцах при его избытке и освобождать при недостатке основана на способно-
сти иона Fe2+ обратимо связывать молекулу О2 с образованием оксимиоглобина. Высвобождение из оксимиоглобина молекулы О2, необходимого работающей мышце, происходит в момент сокращения последней, когда в результате сжатия капилляров парциальное давление О2 резко падает. Белок выполняет роль водорастворимого носителя гема, предохраняет Fe2+ от окисления при его взаимодействии с О2 и регулирует величину сродства к О2.
Кровь осуществляет дыхательную функцию прежде всего благодаря наличию в ней гемоглобина. Физиологическая функциягемоглобина как переносчика кислорода основана на способности обратимо связывать кислород. Поэтому в легочных капиллярах происходит насыщение крови кислородом, а в тканевых капиллярах, где парциальное давление кислорода резко снижено, осуществляется отдача кислорода тканям.
Гемоглобин человека содержит 0,335% железа. Каждый грамм-атом железа (55,84 г) в составе гемоглобина при полном насыщениикислородом связывает 1 грамм-молекулу кислорода (22400 мл). Таким образом, 100 г гемоглобина могут связывать
а каждый грамм гемоглобина – 1,34 мл кислорода. Содержание гемоглобина в крови здорового человека составляет 13– 16%, т.е. в 100 мл крови 13–16 г гемоглобина. При РО2 в артериальной крови 107–120 гПа гемоглобин насыщен кислородом на 96%. Следовательно, в этих условиях 100 мл крови содержит 19–20 об.
% кислорода:
В венозной крови в состоянии покоя РО2 = 53,3 гПа, и в этих условиях гемоглобин насыщен кислородом лишь на 70– 72%, т.е. содержание кислорода в 100 мл венозной крови не превышает

Артериовенозная разница по кислороду будет около 6 об. %. Таким образом, за 1 мин ткани в состоянии покоя получают 200–240 млкислорода (при условии, что минутный объем сердца в покое составляет 4 л). При взаимодействии молекулы кислорода с одним из четырех гемов гемоглобина кислород присоединяется к одной из полови-
нокмолекулы гемоглобина (допустим, к α-цепи этой половинки). Как только такое присоединение произойдет, α- полипептидная цепь претерпевает конформа-ционные изменения, которые передаются на тесно связанную с ней β-цепь; последняя также подвергается конформационным сдвигам. β-Цепь присоединяет кислород, имея уже большее сродство к нему. Таким путем связывание одноймолекулы кислорода благоприятствует связыванию второй молекулы (так называемое кооперативное взаимодействие). После насыщения кислородом одной половины молекулы гемоглобина возникает новое, внутреннее, напряженное состояние молекулыгемоглобина, которое вынуждает и вторую половину гемоглобина изменить конфор-мацию. Теперь еще две молекулы кислорода, по-видимому, по очереди связываются со второй половинкой молекулы гемоглобина, образуя оксигемоглобин.
Организм располагает несколькими механизмами переноса СО2 от тканей к легким. Часть его переносится в физически растворенном виде. Растворимость СО2 в плазме крови в 40 раз превышает растворимость в ней кислорода, тем не менее при небольшой артериовенозной разнице РСО2 (напряжение СО2 в венозной крови, притекающей к легким по легочной артерии, равно 60 гПа, а в артериальной крови – 53,3 гПа) в физически растворенном виде может быть перенесено в покое 12–15 мл СО2, что составляет 6–7% от всего количества переносимого углекислого газа. Некоторое количество СО2 может переноситься в виде карбаминовой формы. Оказалось, что СО2 может присоединяться к гемоглобинупосредством карбаминовой связи, образуя карбгемоглобин, или карбаминогемо-глобин
Карбгемоглобин – соединение очень нестойкое и чрезвычайно быстро диссоциирует в легочных капиллярах с отщеплением СО2. Количество карбаминовой формы невелико: в артериальной крови оно составляет 3 об. %, в венозной – 3,8 об. % . В виде карбаминовой формы из ткани к легким переносится от 3 до 10% всего углекислого газа, поступающего из тканей в кровь. Основная масса СО2 транспортируется с кровью к легким в форме бикарбоната, при этом важнейшую роль играет гемоглобин эритроцитов.
Гемоглобин F — это белок-гетеротетрамер из двух α-цепей и двух γ-цепей глобина, или гемоглобин α2γ2. Этот вариант гемоглобина есть и в крови взрослого человека, но в норме он составляет менее 1 % от общего количества гемоглобина крови взрослого и определяется в 1-7 % от общего числа эритроцитов крови. Однако у плода эта форма гемоглобина является доминирующей, основной. Гемоглобин F обладает повышенным сродством к кислороду и позволяет сравнительно малому объёму крови плода выполнять кислородоснабжающие функции более эффективно. Однако гемоглобин F обладает меньшей стойкостью к разрушению и меньшей стабильностью в физиологически широком интервале pH и температур. В течение последнего триместра беременности и вскоре после рождения ребёнка гемоглобин F постепенно — в течение первых нескольких недель или месяцев жизни, параллельно увеличению объёма крови — замещается «взрослым» гемоглобином А (HbA), менее активным транспортёром кислорода, но более стойким к разрушению и более стабильным при различных значениях pH крови и температуры тела. Такое замещение происходит вследствие постепенного снижения продукции γ-цепей глобина и постепенного увеличения синтеза β-цепей созревающими эритроцитами. Повышенное сродство к кислороду HbF определяется его первичной структурой: в γ-цепях вместо лизина-143 (β-143 лизин у HbA находится серин-143, вносящий дополнительный отрицательный заряд. В связи с этим молекула HbA менее положительно заряжена и основной конкурент за связь гемоглобина с кислородом − 2,3ДФГ (2,3-дифосфоглицерат) — в меньшей степени связывается с гемоглобином, в этих условиях кислород получает приоритет и связывается с гемоглобином в большей степени
Гемоглобины взрослого человека
Вэритроцитах взрослого человека гемоглобин составляет 90% от всех белков данной клетки.
•Гемоглобин А - основной гемоглобин взрослого организма, составляет около 98% от общего количества гемоглобина, тетрамер, состоит из 2 полипептидных цепей α и 2 β (2α2β).
•Гемоглобин A2 находится в организме взрослого человека в меньшей концентрации, на его долю приходится около 2% общего гемоглобина. Он состоит из 2 α- и 2 δ-цепей.
•Гемоглобин А1с - гемоглобин А, модифицированный ковалентным присоединением к нему глюкозы (так называемый гликозилированный гемоглобин).
Гемоглобины, синтезирующиеся в период внутриутробного развития плода:
•Эмбриональный гемоглобин синтезируется в эмбриональном желточном мешке через несколько недель после оплодотворения. Представляет собой тетрамер 2α2ε. Через 2 нед после формирования печени плода в ней начинает синтезироваться гемоглобин F, который к 6 мес замещает эмбриональный гемоглобин.
•Гемоглобин F - фетальный гемоглобин, синтезируется в печени и костном мозге плода до периода его рождения. Имеет тетрамерную структуру, состоящую из 2 α- и 2 γ-цепей. После рождения ребёнка постепенно замещается на гемоглобин А, который начинает синтезироваться в клетках костного мозга уже на 8-м месяце развития плода.
53.КООПЕРАТИВНОЕ СВЯЗЫВАНИЕ КИСЛОРОДА ГЕМОГЛОБИНОМ, ЭФФЕКТ БОРА, ВЛИЯНИЕ 2,3-БФГ НА СРОДСТВО ГЕМОГЛОБИНА К КИСЛОРОДУ.
Эффективность транспорта кислорода регулируется
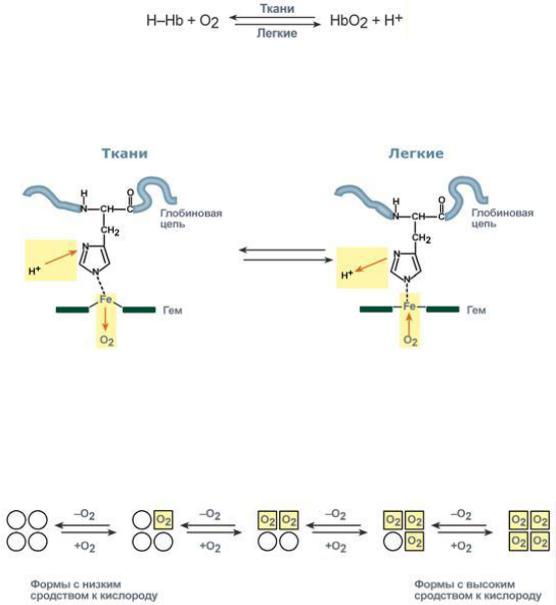
Изменение рН среды
Влияние рН на сродство гемоглобина к кислороду носит название эффекта Бора. При закислении среды сродство снижается, при защелачивании – повышается.
При повышении концентрации протонов (закисление среды) в тканях возрастает освобождение кислорода из оксигемоглобина. В легких после удаления угольной кислоты (в виде СО2) из крови и одновременном увеличении концентрации кислорода высвобождаются ионы Н+ из гемоглобина.
Реакция взаимодействия кислорода с гемоглобином упрощенно имеет вид:
Изменение сродства гемоглобина к кислороду в тканях и в легких при изменении концентрации ионов H+ и
О2 обусловлено конформационными перестройками глобиновой части молекулы. В тканях ионы водорода присоединяются к остаткам гистидина, образуя восстановленный гемоглобин (H-Hb) с низким сродством к кислороду. В лег-
ких поступающий кислород "вытесняет" ион водорода из связи с остатком гистидина гемоглобиновой молекулы.
Механизм эффекта Бора
Кооперативное взаимодействие
Взаимовлияние протомеров олигомерного белка друг на друга называется кооперативное взаимодействие.
В легких такое взаимодействие субъединиц гемоглобина повышает его сродство к кислороду и ускоряет присоединение кислорода в 300 раз. В тканях идет обратный процесс, сродство снижается и ускорение отдачи кислорода также 300кратное.
Схема кооперативного взаимодействия субъединиц гемоглобина
Объясняется такой феномен тем, что в легких при присоединении первой молекулы кислорода к железу (за счет 6-й координационной связи) атом железа втягивается в плоскость гема, кислород остается вне плоскости. Это вызывает перемещение участка белковой цепи и изменение конформации первого протомера. Такой измененный протомер влияет на другие субъединицы и облегчает связывание кислорода со второй субъединицей. Это меняет конформацию второй субъединицы, облегчая присоединение последующих молекул кислорода и изменение других протомеров.
