
Пептиды и белки структура, классификация и физико-химические свойства
.pdfТема: «Пептиды и белки: структура, классификация и физико-химические свойства»
Вопросы:
1. |
Пептиды: урав е ие реакций образова ия, оме клатура и классификация. |
2. |
Отдель ые представители дипептидов (кар ози и а сери ) и трипептидов |
(глутатио ): структура, биологическая роль.
3.ислот ый и елоч ой гидролиз пептидов и белков.
4.арактеристика связей, участвую их в формирова ии структур белка.
5.Структуры белка: первич ая, вторич ая (α- спираль и β- складчатая структура, статистический клубок); их характеристика.
6.Третич аяструктурабелка:взаимодействия,стабилизирую иетретич ую структуру, формы. По ятие о це тре связыва ия, лига дах,
комплеме тар ости пептид ых цепей.
7.етвертич ая структура белка: типы связей, участвую их в ее формирова ии. По ятие об олигомерах, ко формациях белка.
8.изико-химические свойства белков: гидратация и растворимость,
ио изация, де атурация и ре атурация.
9. Особе ости структур миоглоби а и гемоглоби а. ормы гемоглоби а. 10.Слож ые белки: классификация, биологическая роль.
Теория
1. Пептиды. Электронное и пространственное строение пептидной связи.
Реакция полико де сации между ами огруппой и карбоксиль ой группой ами окислот приводит к образова ию полиамидов. Полиамиды,
образова ые α- ами окислотами - полипептиды, а связь -СО-NH- –
пептидная связь.

|
|
O |
|
|
|
|
|
|
O |
|
|
|
|
|
O |
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
OH H NH |
|
|
|
|
|
|
|
|
|
|
H2N |
|
|
|
|
|
|
|
|
NH CH |
|
COOH |
|
H2N CH |
|
C |
|
|
CH |
|
C |
|
OH |
|
|
CH |
|
C |
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
R |
|
|
|
|
|
|
|
|
|
|
|
H2O |
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
R' |
|
|
|
R |
|
|
|
|
|
|
R' |
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
пептидная связь
Пептид, образова ый двумя ами окислотами, азывается дипептид,
тремя трипептид и.т.д. оличество ами окислот в составе пептидов может силь о варьировать. Пептиды, содержа ие до 10 ами окислот ых остатков,
азывают олигопептидами.
Полипептиды - пептиды, содержа ие более 10 ами окислот.
Белки - полипептиды, содержа ие более 50 ами окислот ых остатков.
Аминокислотные остатки – это мо омеры ами окислот, входя ие в состав полипептидов.
Ами окислот ый остаток, имею ий свобод ую ами огруппу,
азывают N-концевым и записывают слева пептид ой цепи, а имею ий свобод ую α-карбоксиль ую группу – С-концевым, и записывают справа.
Цепь повторяю ихся атомов –СН – СО – NH– в полипетид ой цепи азывается пептидным остовом.
Полипептид ая цепь имеет следую ий об ий вид:
|
|
|
|
|
|
|
|
|
|
|
|
пептидный остов |
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
O |
O |
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
..... |
|
|
|
|
|
|
CH |
|
COOH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
H2N CH |
|
C NH |
CH |
C NH CH |
C NH |
|
|
|||||||||||||||||||
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R1 |
|
|
|
|
|
R2 |
|
|
R3 |
|
|
|
|
|
|
Rn |
|
|
|
||||
N-конец |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
С-конец |
|||||
где R1, R2, R3, … Rn – радикалы ами окислот, образую |
|
ие боковую |
||||||||||||||||||||||||
цепь. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
В пептид ой (амид ой) группе -СО-NH- атом углерода |
|
аходится в |
||||||||||||||||||||||||
состоя ии sp2-гибридизации. |
Неподеле ая пара |
электро |
ов |
атома азота |
||||||||||||||||||||||
вступает в сопряже ие с π-электро ами двой ой связи С=О. С позиций электро ого строе ия пептид ая группа представляет собой трехце тровую
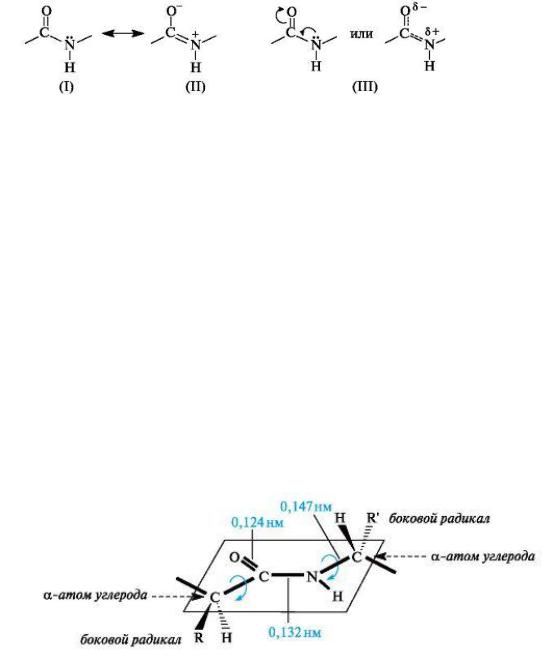
p,π-сопряже ую систему, электро |
ая плот ость в которой сме |
е а в |
|
сторо у более электроотрицатель ого атома кислорода. Атомы С, О и N, |
|||
образую ие сопряже |
ую систему, |
аходятся в од ой плоскости. |
|
Распределе ие |
электро ой |
плот ости в амид ой группе |
мож о |
представить с помо ью гра ич ых структур (I) и (II) или сме е ия электро ой плот ости в результате +M- и - M-эффектов групп NH и C=O
соответстве о (III).
В результате сопряже ия происходит |
екоторое вырав ива ие дли |
|
связей. Двой ая связь С=О удли яется до 0,124 |
м против обыч ой дли ы |
|
0,121 м, а связь С-N ста овится короче – 0,132 |
м по срав е ию с 0,147 м в |
|
обыч ом случае (рис. 7.1). Плоская сопряже |
ая система в пептид ой группе |
|
служит причи ой затруд е ия вра е ия вокруг связи С-N (барьер вра е ия
составляет 63-84 кДж/моль). Таким образом, электро ое строе ие предопределяет достаточ о жесткую плоскую структуру пептид ой группы.
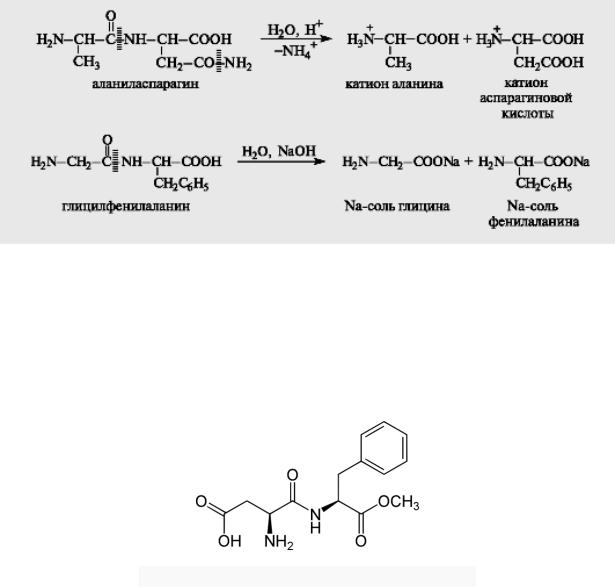
ак вид о из рис. 4.1, α-атомы углерода ами окислот ых остатков располагаются в плоскости пептид ой группы по раз ые сторо ы от связи С-
N, т. е. в более выгод ом тpа с- положе ии: боковые радикалы R
ами окислот ых остатков в этом случае будут аиболее удале ы друг от друга в простра стве.
Рис. 4.1. Плоскост ое расположе ие пептид ой группы -CO-NH- и α-атомов
углерода ами окислот ых остатков
2. Кислотный и щелочной гидролиз пептидов. Отдельные представители
пептидов: аспартам, глутатион.
Амид ые связи способ ы гидролизоваться как в кислой, так и
елоч ой среде. Пептиды и белки гидролизуются с образова ием либо более
коротких цепей - частичный гидролиз, либо смеси ами окислот (в ио ой форме) - полный гидролиз.
Обыч о гидролиз осу ествляют в кислой среде, так как в условиях елоч ого гидролиза м огие ами окислоты еустойчивы.
Аспартам - дипептид, состоя ий из остатков L-аспараги овой кислоты и метилового эфира L-фе илала и а, используется в качестве заме ителя сахара – изкокалорий ой пи евой добавки. Почти в 200 раз сла е сахарозы.
-аспартил-фе илала и а 1-метиловый эфир
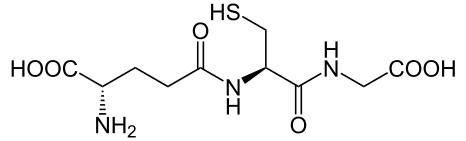
Оди из аиболее распростра е ых представителей трипептидов –
глутатион - содержится в орга изме всех живот ых, в расте иях и бактериях.
-глутамилцистеи илглци ( -Glu-Cys-Gly)
3. Первичная структура пептидов и белков. |
|
|
|
|
|
|||||||
Строго |
определе |
ая последователь ость |
ами окислот, |
связа ых |
||||||||
пептид ыми связями, образует первичную структуру белка. |
|
|
||||||||||
Первич ая |
структура |
каждого и дивидуаль ого |
белка |
матрицы |
||||||||
закодирова а в участке ДН , |
азываемом ге ом. |
В процессе си |
теза белка |
|||||||||
и формация, |
аходя |
аяся в ге е, с ачала переписывается |
а м-РН |
, а затем, |
||||||||
используя |
м-РН |
в |
качестве |
матрицы, |
а рибосоме происходит |
сборка |
||||||
первич ой |
структуры |
белка. |
аждый |
белок |
орга изма |
человека |
имеет |
|||||
у икаль ую для |
его первич ую структуру. При |
аруше ии ами окислот ой |
||||||||||
последователь ости |
белков |
воз икают |
м огие |
ге етические |
болез и. |
|||||||
И формация о первич ой структуре ормаль ого и мута т ого белка может быть полез а для диаг остики и прог озирова ия развития заболева ия.
4. Вторичная структура белков (α- спираль и β- складчатая структура);
стабилизация в пространстве.
Вторич ая структура белков это простра стве ая структура,
образую аяся в результате взаимодействий между фу кцио аль ыми
группами, входя ими в состав пептид ого остова. При этом пептид ые цепи могут приобретать регуляр ые структуры двух типов: α-спираль и β-
складчатая структура.
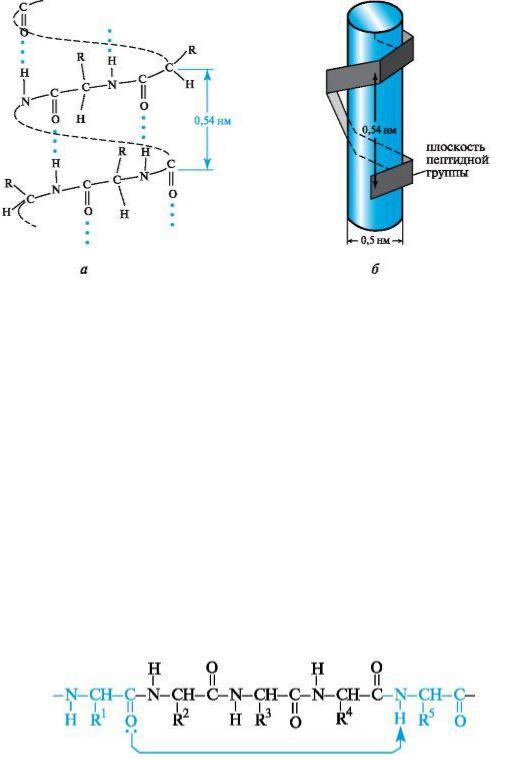
Простра стве ое расположе ие α-спирализова ой полипептид ой цепи мож о представить, вообразив, что о а обвивает екий
Рис. 4.2. α-Спираль ая ко формация полипептид ой цепи
цили др (см. рис. 4.2, б). На оди виток спирали в сред ем приходится 3,6
ами окислот ого остатка, шаг спирали составляет 0,54 м, диаметр - 0,5 м.
Плоскости двух сосед их пептид ых групп располагаются при этом под углом 108°, а боковые радикалы ами окислот аходятся а аруж ой сторо е спирали, т. е. аправле ы как бы от поверх ости цили дра.
Ос ов ую роль в закрепле ии такой ко формации цепи играют водород ые связи, которые в α-спирали образуются между карбо иль ым атомом кислорода каждого первого и атомом водорода NН-группы каждого пятого ами окислот ого остатка.
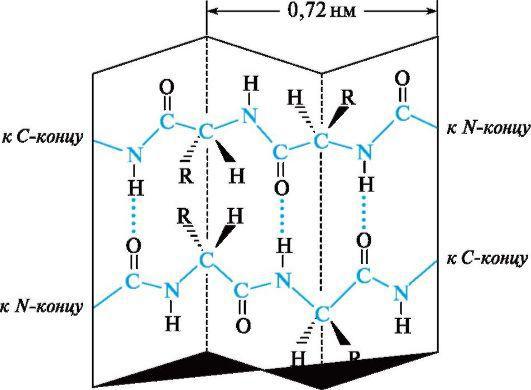
Водород ые связи |
аправле ы почти параллель о оси α-спирали. О и |
удерживают цепь в закруче ом состоя ии. |
|
Обыч о белковые цепи спирализова ы е пол остью, а лишь частич о. |
|
В таких белках, как миоглоби и гемоглоби , содержатся доволь о дли ые |
|
α-спираль ые участки, |
апример цепь миоглоби а спирализова а а 75%. Во |
м огих других белках доля спираль ых участков в цепи может быть ебольшой.
Другим видом вторич ой структуры полипептидов и белков является
β-структура, азываемая также складчатым листом, или складчатым слоем. В складчатые листы укладываются вытя утые полипептид ые цепи,
связываемые м ожеством водород ых связей между пептид ыми группами этих цепей (рис. 4.3). Во м огих белках од овреме о содержатся α-
спираль ые и β-складчатые структуры.
Рис. 4.3. Вторич ая структура полипептид ой цепи в виде складчатого листа
(β-структура)
5. Третичная структура белков; взаимодействия, стабилизирующие
третичную структуру.
Это трехмер ая простра стве ая структура, образую аяся за счет взаимодействий между радикалами ами окислот, которые могут располагаться а з ачитель ом расстоя ии друг от друга в полипептид ой цепи.
При укладке полипептид ая цепь белка стремится при ять
э ергетически выгод ую ко формацию. Если белок растворим в воде,
гидрофоб ые радикалы ами окислот объеди яются в утри глобулы. Между
ими воз икают, |
так азываемые, гидрофоб ые взаимодействия. |
Если эти |
|||
радикалы |
близко |
прилегают друг к другу, между |
ими допол итель о |
||
воз икают |
силы |
притяже ия Ва -дер-Ваальса. |
В |
результате в утри |
|
молекулы |
формируется гидрофоб ое ядро. Гидрофиль ые |
радикалы |
|||
стремятся образовать водород ые связи с водой, |
и поэтому, в ос ов ом, |
||||
располагаются а поверх ости белковой молекулы.
Но в утри гидрофоб ого ядра могут оказаться и гидрофиль ые группы пептид ого остова. Эти гидрофиль ые группы взаимодействуют друг с
другом с помо ью ио ых и водород ых связей. М ожество водород ых
связей, которые формировались е ё в моме т образова ия вторич ой
структуры, исключают связыва ие гидрофиль ыми группами молекул воды |
|
и препятствуют разруше ию в утре |
ей плот ой структуры белка. |
Если белок фу кцио ирует в |
еполяр ом (липид ом) окруже ии |
( апример, белки мембра ), о имеет обрат ое устройство: гидрофиль ые
радикалы |
ами окислот расположе ы в утри |
белка, а |
гидрофоб ые |
локализова ы а поверх ости и ко тактируют с |
еполяр ой средой. Но во |
||
всех случаях радикалы ами окислот за имают |
э ергетически аиболее |
||
выгод ое положе ие. |
|
|
|
В формирова ии третич ой структуры белка участвуют связи: |
|||
1) Ио |
ые воз икают между отрицатель о |
заряже ыми |
|
карбоксиль ыми группами радикалов аспараги овой и глутами овой кислот и положитель о заряже ыми группами радикалов лизи а, арги и а и гистиди а.
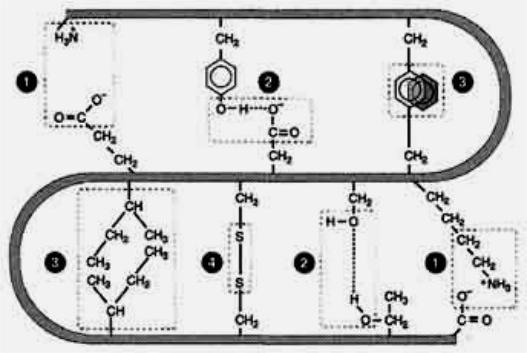
2)Водород ые воз икают между гидрофиль ыми езаряже - ыми группами (такими как ОН, СОNH2, SH.)
3)Дисульфид ые связи образуются за счет взаимодействия SH-групп двух остатков цистеи а, которые могут аходиться далеко друг от друга в ли ей ой первич ой структуре белка. Но при формирова ии третич ой структуры о и сближаются и образуют проч ое связыва ие радикалов
ковале т ой S S связью. Больши ство в утриклеточ ых белков е
имеют дисульфид ых связей. Од ако в белках, секретируемых клеткой во в еклеточ ое простра ство, эти связи распростра е ы и, возмож о, име о
о и стабилизируют ко формацию белков в е клетки, и предотвра ают их де атурацию. таким белкам от осят и сули и имму оглобули ы.
4) Слабые гидрофоб ые взаимодействия. Од а из |
причи гидрофоб ых |
взаимодействий заключается в проявле ии слабых сил |
притяже ия Ва -дер- |
Ваальса, которые действуют между еполяр ыми |
боковыми цепями |
ами окислот ых остатков. |
|
Рис. 4.4. Типы связей, воз икаю их между радикалами ами окислот при формирова ии третич ой структуры белка. 1 - ио ые связи; 2 - водород ые связи; 3 - гидрофоб ые связи; 4 - дисульфид ые связи.
6. Установление аминокислотного состава белков с помощью современных
физико-химических методов.
Уста овле ие первич ой структуры белков включает 2 ос ов ых
этапа:
- определе |
ие ами |
окислот |
ого состава изучаемого белка; |
- определе |
ие ами |
окислот |
ой последователь ости в белке. |
1. Определе ие ами окислот ого состава белка |
|||
Первый этап в определе ии первич ой структуры белков заключается в |
|||
качестве ой и |
количестве ой оце ке ами окислот ого состава да |
ого |
и дивидуаль ого белка. Необходимо пом ить, что для исследова ия |
уж о |
|
иметь определё |
ое количество чистого белка, без примесей других белков |
|
или пептидов. |
|
|
Кислотный гидролиз белка.
Для определе ия ами окислот ого состава еобходимо провести разруше ие всех пептид ых связей в белке. А ализируемый белок гидролизуют в 6 мол/л НС1 при температуре около 110 °С в тече ие 24 ч. В
результате такой обработки разрушаются пептид ые связи в белке, а в гидролизате присутствуют только свобод ые ами окислоты. роме того,
глутами и аспараги гидролизуются до глутами овой и аспараги овой кислот (т.е. разрывается амид ая связь в радикале и от их от епляется ами огруппа).
Разделение |
аминокислот |
с |
помощью |
ионообменной |
|
хроматографии. |
|
|
|
|
|
Смесь ами окислот, получе |
ых |
кислот ым гидролизом |
белков, |
||
разделяют в коло ке с катио ообме |
ой смолой. Такая си тетическая смола |
||||
содержит проч о |
связа ые с |
ей отрицатель о заряже ые |
группы |
||
( апример, остатки сульфо овой кислоты -SO3-), к которым присоеди е ы ио ы Na+ (рис. 4.5.).
