
ФИЗИЧЕСКАЯ ХИМИЯ ДИСПЕРСНЫХ СИСТЕМ И ПОВЕРХНОСТНЫХ ЯВЛЕНИЙ
.pdfСвободнодисперсные – это системы, в которых частицы дисперсной фазы не связаны между собой и могут свободно перемещаться. Такие системы не оказывают сопротивления сдвиговому усилию, обладают текучестью и другими своиствами, характерными для обычных жидкостеи. К ним относятся: аэрозоли, разбавленные суспензии и эмульсии, лиозоли.
Связнодисперсные – это системы, в которых частицы связаны друг с другом за счет межмолекулярных сил, образуя в дисперсионнои среде своеобразные пространственные сетки или каркасы (структуры). Частицы такои структуры могут совершать только колебательные движения. Сюда относятся капиллярно-пористые тела, мембраны, гели (образовавшиеся из золеи в результате потери ими устоичивости), студни, твердые растворы.
Свободнодисперсные системы во времени непрерывно изменяют свой дисперсный состав в сторону укрупнения частиц, вплоть до полного расслоения на две макрофазы, поэтому их часто называют нестабилизированными.
Связнодисперсные системы могут сохранять свою дисперсность на определенном постоянном уровне в течение длительного времени, поэтому называются иначе
стабилизированными.
Классификация по характеру взаимодействия дисперсной фазы с дисперсионной средой (межфазному взаимодействию). По характеру взаимодействия между частицами дисперсной фазы и молекулами дисперсионной среды коллоидные и грубодисперсные системы подразделяются на лиофильные (от греческого lyo – растворяю, philia – люблю) и лиофобные (phobia – страх, нелюбовь).
Лиофильные (в воде - гидрофильные) системы характеризуются сильно выраженным взаимодействием частиц дисперсной фазы с молекулами дисперсионной среды. В результате такого взаимодействия из молекул растворитеся на поверхности частиц дисперсной фазы образуются сольватные оболочки, которые препятствуют слипанию частиц и уменьшают поверхностную энергию. Лиофильные системы термодинамически устойчивы, могут образовываться самопроизвольно и не требуют добавок стабилизаторов. Они немногочисленны и в природе встречаются редко. К ним можно отнести растворы некоторых поверхностно-активных веществ, определенные сорта глин.
В лиофобных системах межмолекулярное взаимодеиствие слабое, диспергирование происходит за счет внешнеи работы. Образующиеся дисперсии термодинамически неустоичивы, существуя длительное время в метастабильном состоянии.
Сравнительная характеристика систем различной степени дисперсности представлена в табл.4 :

|
|
|
Таблица 4 |
|
Свойства систем различной степени дисперсности |
|
|
||
Грубодисперсные |
Коллоидно-дисперсные |
Молекулярные и |
||
(микрогетерогенные) |
(ультрамикрогетерогенные) |
ионные (истинные) |
||
системы |
системы |
растворы |
|
|
Гетерогенные |
Гетерогенные |
Гомогенные |
|
|
Термодинамически |
Термодинамически неустойчивы, |
Термодинамически |
|
|
неустойчивы |
но устойчивы кинетически |
устойчивы |
|
|
Частицы не проходят через |
Частицы проходят через бумаж- |
Частицы проходят |
через |
|
бумажный фильтр |
ный фильтр |
бумажный фильтр |
|
|
Частицы не проходят через |
Частицы не проходят через |
Частицы проходят |
через |
|
ультрафильтры (мембраны) |
ультрафильтры (мембраны) |
ультрафильтры |
(мембра- |
|
|
|
ны) |
|
|
Отражают свет, поэтому не- |
Прозрачные, но рассеивают свет, |
Прозрачные, неопалесци- |
||
прозрачны |
поэтому опалесцируют и дают |
рующие, конус |
Тиндаля |
|
|
конус Тиндаля |
не наблюдается |
|
|
Частицы видны в оптиче- |
Частицы видны в электронном |
Частицы не видны в со- |
||
. ском микроскопе |
микроскопе, в ультрамикроскопе |
временных микроскопах |
||
Отличительной особенностью истинных растворов является то, что частицы дисперсной фазы в них представляют собой отдельные молекулы или ионы, в данных системах отсутствует межфазная поверхность и поэтому, в отличие они являются гомогенными.
В коллоидно-дисперсных системах (или золях) частицы дисперсной фазы образованы несколькими десятками либо сотнями молекул, ионов или атомов, соединенных друг с другом различными связями, поэтому большая часть всех молекул или атомов вещества дисперсной фазы находится на поверхности его частичек, т.е. на границе раздела фаз. Вследствие этого коллоидные системы приобретают особые свойства, которые резко отличают их от других типов дисперсных систем.
7. Методы получения дисперсных систем. Методы очищения коллоидных растворов: диализ, электродиализ, ультрафильтрация. Физико-химические принципы функционирования искусственной почки.
Для получения дисперсных систем необходимо:
подобрать такие компоненты системы, чтобы вещество дисперсной фазы не растворялось самопроизвольно в дисперсионной среде с образованием истинного раствора;
довести размеры частиц дисперсной фазы до соответствующей величины;
равномерно распределить дисперсные частицы по всему объему раствора, не превышая заданного уровня их концентрации;
определенным способом стабилизировать дисперсную систему, чтобы сохранить ее степень дисперсности и свойства в течение достаточно длительного времени (например, ввести добавки специальных веществ – стабилизаторов).
Дисперсные частицы, в том числе и коллоидные, могут быть образованы двумя способами:
путем дробления (диспергирования) более крупных частиц;
путем агрегации (конденсации) молекул и ионов истинных растворов.
Всоответствии с этим различают диспергационные и конденсационные методы получения дисперсных частиц.
Диспергационные методы используют в основном для получения грубодисперсных частиц от 10–6м и выше. С помощью специальных приспособлений или устройств удается снизить их размеры до 10–7 м, но в промышленных процессах диспергирования обычно получают более крупные частицы.
Для диспергирования твердых тел используют механические, ультразвуковые, химические методы, взрывы.
Механическое измельчение твердых веществ осуществляется в соответствующих установках: дробильных аппаратах, мельницах различного типа и т.п. В них измельчаемый материал подвергается сильным механическим нагрузкам (растяжению, сжатию, ударам), которые приводят к разрушению больших образцов вещества на мелкие частицы
Ультразвуковой метод используют для диспергирования твердых веществ, помещенных
вжидкость. Для этих целей воздействуют на систему звуковыми волнами с частотой колебаний более 20 000 Гц. Ультразвук создает резкие чередования сжатия и расширения, в результате чего появляются разрывающие силы, ведущие к раздроблению образца.
Химическое диспергирование или метод пептизации заключается в раздроблении свежеприготовленных рыхлых осадков на отдельные частицы при добавлении к ним растворов электролитов или поверхностно-активных веществ. Данные соединения (их иначе называют пептизаторами, по аналогии с ферментом пепсином, вызывающим гидролиз белковых макромолекул) уменьшают взаимодействие между частицами осадка и облегчают их переход в состояние золя. При этом степень дисперсности вещества фактически не изменяется, т.к. частицы рыхлого осадка уже имеют нужные размеры, но находятся в связанном состоянии за счет сил межмолекулярного взаимодействия и разделены тонкими прослойками из молекул дисперсионной среды.
Слежавшиеся осадки со слипшимися частицами, лишенными прослоек из растворителя, не поддаются диспергированию путем пептизации.
Пептизация имеет биологическое значение: используется для рассасывания атеросклеротических бляшек в кровеносных сосудах, выведения почечных и печеночных камней. Действие антикоагулянтов при тромбофлебитах сводится, в сущности, к явлению пептизации.
Для диспергирования жидкостей и получения мелких капель в аэрозолях и эмульсиях используют преимущественно механические методы: встряхивание, быстрое перемешивание, сопровождаемое кавитационными разрывами, воздействие ультразвука. Применяют также распыление при быстром течении жидкости через тонкие отверстия.
Процессы диспергирования жидкостей имеют большое прикладное значение в энергетике – для обеспечения эффективного сжигания жидкого топлива; в медицине – при приготовлении эмульсионных систем.
Для получения газовых пузырьков в жидкости применяют метод барботирования – прохождение газовой струи через жидкость с достаточно большой скоростью; при этом струя становится неустойчивой и начинает дробиться на отдельные небольшие пузырьки;
Процессы диспергирования активно протекают в природе. Приливно-отливные явления океанов и морей, разрушающее действие прибоя, резкие колебания температур, ветер и другие явления развивают колоссальные силы, которые дробят горные породы до дисперсных частиц. Постоянное действие ледников и рек также приводит к интенсивным процессам измельчения слагающих пород. Мощным фактором механического диспергирования является расширение воды при ее замерзании. Проникая глубоко в трещины породы и замерзая там, вода вызывает дробление ее на частицы различного размера (в том числе и коллоидного).
Конденсационные методы позволяют получить дисперсные частицы с любыми размерами, в том числе и 10–8 – 10–9 м. Поэтому они широко применяются в нанотехнологиях. Различают методы физической и химической конденсации. И в том, и в другом случае дисперсные частицы образуются в виде новой фазы из исходной гомогенной среды. Общим условием для их возникновения является состояние пресыщения раствора или пара, которое достигается изменением параметров равновесной системы (температуры, давления). Чем больше возникает в исходной системе зародышей новой фазы и чем меньше скорость их образования, тем выше степень дисперсности получаемых частичек.
Методы физической конденсации:
Конденсацией паров различных веществ в газовой среде получают аэрозоли. В природных условиях таким образом образуются туман, облака. Совместной конденсацией
нерастворимых друг в друге веществ можно получать лиозоли, например, коллоидный раствор натрия в бензоле.
Лиозоли металлов получают и с помощью электрического метода, сущность которого заключается в образовании вольтовой (электрической) дуги между электродами из металла, которые погружены в охлаждаемую жидкость с высокой диэлектрической проницаемостью (например, в Н2О). В дуге под действием высокой температуры металл электродов испаряется, а затем его пары конденсируются в жидкости с образованием коллоидных частиц
Для получения твердых дисперсных частиц с помощью кристаллизации из раствора используют метод замены растворителя. Он заключается в том, что истинный раствор вещества при постоянном перемешивании приливают к растворителю, в котором исходное вещество практически нерастворимо. Возникающее пресыщение приводит к образованию дисперсных частиц.
Так, если спиртовой раствор канифоли небольшими порциями прибавлять в Н2О, то образуется коллоидный раствор канифоли в воде. В данном случае спирт хорошо смешивается с Н2О, а канифоль плохо в ней растворяется и поэтому выделяется в виде высокодисперсной фазы. Кроме канифоли, этим методом можно получить золи серы, фосфора, мастики и т.п.
Растворители, используемые в данном методе, должны неограниченно смешиваться друг с другом.
Методы химической конденсации. В этих методах новая фаза образуется при протекании гомогенных химических реакций, приводящих к образованию нерастворимых в данной среде веществ. Это могут быть реакции восстановления, окисления, обмена, гидролиза и т.д.
Как правило, высокодисперсные частицы получают добавлением в разбавленный раствор одного из реактивов при интенсивном перемешивании небольшого количества раствора второго реактива.
Таким образом, один из исходных реагентов должен быть взят в избытке, чтобы служить стабилизатором получаемого лиозоля. Если вещества будут взяты в эквивалентных количествах, то золь не образуется.
Примером образования дисперсных систем с помощью метода химической конденсации могут служить процесс получения гидрозоля серы окислением сероводорода сернистой кислотой: 2H2S + H2SO3 = 3S↓ + 3H2O;
Для очистки золей от примесей нежелательных низкомолекулярных соединений применяют диализ или ультрафильтрацию.
Диализ основан на способности молекул или ионов малых размеров проходить через полупроницаемые пленки или мембраны, тогда как крупные частицы дисперсной фазы такой способностью не обладают.
Полупроницаемыми являются различные растительные, животные и искусственные мембраны. Их можно приготовить из пергамента, бычьего, свиного, рыбьего пузыря, коллодия, целлофана и т.д.
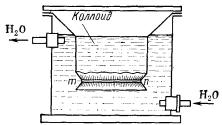
Приборы, в которых осуществляется диализ, называются диализаторами. Простейший из них, предложенный еще в 19 веке английским химиком Т. Грэмом, состоит из вставленных друг в друга стеклянных сосудов (рис. 12). Дно, либо боковая стенка одного из них (внутреннего) затянуты полупроницаемой мембраной. В этот сосуд помещают очищаемый гидрозоль. В другой сосуд (внешний) наливают дистиллированную воду, которую периодически или непрерывно заменяют.
Рис. 12. Схема простейшего диализатора: тп – полупроницаемая перепонка (мембрана)
За счет диффузии низкомолекулярные примеси постепенно переходят через мембрану из золя во внешний сосуд с растворителем.
Недостатком данного метода является большая длительность процесса очистки (в течение нескольких суток).
Если в качестве низкомолекулярных примесей выступают электролиты, то скорость очистки можно существенно увеличить используя для этого постоянный электрический ток. Такой процесс называется электродиализом.
Недостатком электродиализа является то, что с его помощью нельзя очистить золь от примесей неэлектролитов.
Более универсальным методом очистки золей является ультрафильтрация, когда удаление примесей осуществляется через специально приготовленные плотные фильтры или мембраны, непроницаемые для коллоидных частиц.
Для ускорения процесса очистки ультрафильтрацию проводят при перепаде давления по обе стороны фильтра: под разряжением (вакуумом) или под повышенным давлением.
Ультрафильтрацию используют не только для очистки золей, но и для образования их концентрированных растворов из разбавленных.
Процесс ультрафильтрации лежит в основе функции почек. Ток жидкости через биологическую мембрану обеспечивается ее гидростатическим давлением, создаваемым стенками капилляров.
В основе работы аппарата «искусственная почка» лежит принцип диализа — удаление низкомолекулярных веществ из коллоидных растворов за счет диффузии и разницы осмотического давления с обеих сторон полупроницаемой целлофановой мембраны. Ионы калия, натрия, кальция, хлора, молекулы мочевины, креатинина, аммиака и др. свободно проникают через поры целлофана. В то же время более крупные молекулы белка, форменные элементы крови и бактерии не могут преодолеть целлофанового барьера.
Кровь от больного поступает по катетеру при помощи насоса в диализатор. Проходя между целлофановыми пластинами диализатора, кровь больного через целлофановую мембрану соприкасается с протекающим навстречу диализирующим раствором. После диализатора кровь по катетеру возвращается в венозную систему больного. Протекающая диализирующая жидкость стандартна и содержит все основные ионы крови (К·, Na· и др.), глюкозу в концентрации, соответствующей концентрации таковых в крови здорового человека.
8. Молекулярно-кинетические свойства коллоидно-дисперсных систем: броуновское движение, диффузия, осмотическое давление. Оптические своиства коллоидных систем. Опалесценция.
Коллоидным растворам присущи такие молекулярно-кинетические свойства, как: тепловое движение частиц дисперсной фазы, диффузия и осмос, только выражены они слабее. Это объясняется бóльшими размерами коллоидных частиц и меньшей их концентрацией по сравнению с молекулами и ионами истинных растворов.
Важнейшим фактором, влияющим на молекулярно-кинетические свойства золей, является броуновское движение частиц дисперсной фазы.
Броуновское движение – тепловое движение частиц дисперсной фазы.
Соударяясь с частицами дисперсионной среды – частицы дисперсной фазы получают постоянно меняющийся импульс движения и перемещаются. Само движение частиц является скачкообразным и хаотическим. Установлено, что коллоидная частица изменяет направление своего движения приблизительно 1012 раз за 1 секунду.
Скорость броуновского движения коллоидных частиц зависит от их радиуса и вязкости дисперсионной среды. При этом природа самой частицы на ее движение влияния не оказывает.
Чем больше размеры частиц, тем выше вероятность взаимной компенсации ударов с различных направлений, поэтому у частиц дисперсных систем размером 4 · 10–6 м ÷ 5 · 10–6 м наблюдаются только небольшие колебательные движения около некоторого центра, а при более крупных размерах частиц (в грубодисперсных системах) их броуновское движение не наблюдается.
Диффузия – самопроизвольный процесс выравнивания концентраций молекул растворенных веществ или частиц дисперсной фазы во всем объеме системы.
Диффузия частиц в золях протекает в сотни раз медленнее, чем в истинных растворах изза гораздо больших размеров частиц и подчиняется тем же законам: идет в направлении уменьшения концентрации, скорость диффузии прямо пропорциональна площади поверхности, через которую проходит вещество и градиенту его концентрации.
Осмос (в переводе с греч - толчок) – преимущественно диффузия дисперсионной среды (растворителя) через полупроницаемую мембрану из раствора или золя с меньшей концентрацией вещества в раствор или золь с большей концентрацией.
Осмос – самопроизвольный процесс, приводящий к выравниванию концентраций. Коллоидные растворы, как и истинные, обладают осмотическим давлением, но оно имеет гораздо меньшую величину.
Частицы коллоидных растворов имеют большие размеры (по сравнению с размерами частиц истинных растворов), но их концентрация и величина осмотического давления - значительно меньше В зависимости от размера коллоидных частиц и молекул, либо ионов растворенного вещества, истинного раствора эта разница может достигать 103÷106 раз. Соответственно, во столько же раз будет отличаться и величина осмотического давления в данных системах.
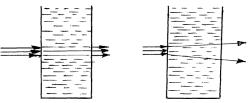
Рассеяние света (опалесценция). При прохождении луча света через коллоидный раствор наблюдается светящийся конус рассеянного света (эффект Тиндаля) (рис. 13). В истинных растворах луч света невидим (раствор оптически пуст).
а б
Рис. 13. Оптические свойства дисперсных систем: а – истинных растворов, б – золей;
Рассеяние света очень резко зависит от соотношения длины световои волны и размеров частиц. Если размеры взвешанных частиц меньше длины световои волны λ, а расстояние
между частицами больше световои волны, то происходит рассеяние света, а когда размер частицы значительно больше длины световои волны наблюдается отражение света и конус Тиндаля пропадает.
Поскольку рассеяние более коротких волн голубои части спектра происходит интенсивнее, то коллоидныи раствор в проходящем свете имеет красноватую окраску, а в боковом – голубоватую. Впоследствии такое свечение стали называть опалесценцией.
Опалесценция – рассеяние света частицами дисперсной фазы.
Известно, что если луч света проходит через большую толщу среды, светорассеяние заметно себя проявляет. Так, луч солнечного света, проходящии через большую толщу атмосферы, рассеивается, что и определяет освещенность неба и его голубои цвет, связанныи с преимущественным рассеянием коротковолновои голубои части спектра. Когда солнце находится в зените, «белыи» луч относительно мало обедняется лучами голубои части спектра, и поэтому мы не замечаем слегка красноватого оттенка прямых солнечных лучеи. На закате солнца лучи света проходят через слои атмосферы, большии в несколько десятков раз. Поэтому «белыи» луч заметно обедняется голубои частью спектра и приобретает красную окраску.
9. Строение коллоидных частиц и механизм образования двоиного электрического слоя (ДЭС) частиц золя. Электрокинетические явления в дисперсных системах:
электрофорез, электроосмос.
Дисперсную фазу коллоидных растворов составляют коллоидные частицы, называемые мицеллами (от латинского micelle – крошка, крупинка).
В составе мицеллы различают две составные части: внутреннюю – электронейтральную, называемую агрегатом, и внешнюю – ионогенную, состоящую из двух ионных слоев или сфер. В связи с этим, внешнюю часть называют двойным электрическим слоем (ДЭС).
Агрегат составляет - нерастворимое соединение, состоящее из атомов, разноименно заряженных ионов либо нейтральных молекул. Число их может изменяться в интервале от нескольких сотен до нескольких десятков тысяч.
Двойной электрический слой мицеллы состоит из адсорбционного и диффузного слоев.
Ионы адсорбционного слоя прочно удерживаются на его поверхности за счет электростатических сил притяжения и сил другой природы. Они граничат со слоем жидкости, смачивающим твердую часть частицы.
Ионы диффузного слоя связываются с ядром только за счет электростатических сил. Они располагаются в прилегающем к нему слое жидкости и под влиянием теплового движения могут свободно перемещаться в нем.
ДЭС на поверхности коллоидных частиц в золях чаще всего формируется
адсорбционным путем.
Механизм образования ДЭС коллоидной частицы адсорбционным путем:
В качестве примера возьмем золь, полученный с помощью метода химической агрегации
врезультате смешивания истинных растворов двух веществ: нитрата серебра и иодида калия AgNO3 + KI = KNO3 + AgI ↓ молекулярное уравнений реакции
Ag+ + I– = AgI ↓ сокращенное ионное уравнение реакции
Как следует из уравнения реакции, частицы дисперсной фазы в данном золе образуются
за счет связывания друг с другом ионов Ag+ и I–.
Взависимости от молярного соотношения исходных веществ возможны два конечных результата.
1. Исходные вещества взяты в стехиометрическом соотношении, т.е. n(AgNO3) = n(KI).
Вэтом случае ионы Ag+ и I– присутствуют в равных количествах и поэтому принимают одинаковое участие в построении кристаллической решетки частиц осадка, встраиваясь в нее практически одновременно. При этом частицы дисперсной фазы на протяжении всего этапа своего роста будут оставаться электронейтральными, их размеры со временем превысят размеры коллоидных частиц (> 10–7 м). За счет действия силы тяжести и процесса агрегации (т.е. слипания частиц друг с другом) вещество дисперсной фазы в итоге выпадает в осадок и образования золя не произойдет.
2. Одно из исходных веществ возьмем в избытке, например - нитрат серебра (AgNO3). Оно будет играть роль стабилизатора и позволит ограничить, а затем и полностью прекратить увеличение размеров частиц дисперсной фазы, сохраняя их в пределах 10–9÷10–7 м.
Концентрация ионов Ag+ в растворе будет больше, чем концентрация иодид-ионов (I–). Это приведет к тому, что в процессе роста ядра мицеллы достраивание его кристаллической решетки будет осуществляться в первую очередь за счет ионов Ag+. Они, прочно входя в структуру ионной решетки, станут накапливаться на поверхности частицы (агрегата), сообщая ей положительный электрический заряд.
Ионы I– при этом всегда будут запаздывать, т.к. их содержание в растворе гораздо меньше, по сравнению с ионами Ag+.
