
ФИЗИЧЕСКАЯ ХИМИЯ ДИСПЕРСНЫХ СИСТЕМ И ПОВЕРХНОСТНЫХ ЯВЛЕНИЙ
.pdf
полярной фазой, а неполярное – неполярной (принцип «подобное смешивается с подобным»).
При адсорбции полярная группа, обладающая большим сродством с полярнои фазои (например, с водои) втягивается в нее. В то же время неполярная группа выталкивается в неполярную фазу (рис. 7).
а) |
б) |
рис. 7. Строение мономолекулярного слоя: а) при малой концентрации ПАВ; б) при высокой концентрации ПАВ.
На границе раздела двух несмешивающихся жидкостей (например, воды и масла) молекулы водорастворимого ПАВ будут ориентированы своей полярной, гидрофильной частью к воде, а гидрофобной - к неполярному маслу. При небольшой концентрации ПАВ углеводородные цепи лежат на поверхности, а неполярная группа выталкивается в неполярную фазу. По мере увеличения концентрации ПАВ углеводородные цепи поднимаются, и при концентрации, соответствующей образованию мономолекулярного слоя, полностью заполняющего поверхность раздела, они размещаются перпендикулярно поверхности (его называют молекулярным частоколом Лэнгмюра).
Для характеристики поверхностнои активности молекул ПАВ используют их гидрофильно-липофильныи баланс (ГЛБ) или полярно-неполярный баланс. ГЛБ заключается
втом, что в молекуле любого ПАВ имеется определенное соотношение между активностями гидрофильных и гидрофобных групп, от которого зависит положение ПАВ на границе раздела фаз (рис.8) и пригодность ПАВ для тои или инои цели. Так, при использовании ПАВ
вкачестве моющих средств применяют вещества, в молекуле которых гидрофобные своиства выражены незначительно меньше, чем гидрофильные своиства.
рис. 8. Влияние ГЛБ на положение ПАВ в поверхностном слое
Поступление питательных веществ и выведение продуктов метаболизма через клеточные мембраны подчиняются закону распределения между неполярной фазой липидного слоя мембран и полярными фазами внутри и межклеточной жидкостей. Водонерастворимые соединения: жиры, барбитураты, многие анестетики – хорошо растворимы в липидах, поэтому они сорбируются липидным слоем мембран, изменяя их физиологические свойства.
4. Особенности адсорбции из растворов. Иониты, их применение.
Адсорбция растворенных веществ твердыми адсорбентами – более сложныи процесс, чем адсорбция газов твердыми телами, поскольку она осложняется рядом факторов:
присутствием третьего компонента – растворителя, молекулы которого могут конкурировать с молекулами адсорбата за места на поверхности адсорбента;
взаимодеиствием между молекулами адсорбата и растворителя;
электростатическим взаимодеиствием между поверхностью адсорбента и ионами адсорбата, если он является электролитом.
Адсорбция будет эффективней, если:
растворитель имеет низкое сродство к адсорбенту (плохо смачивает поверхность адсорбента) и адсорбтиву (плохо растворяет вещество);
поглощаемое вещество имеет высокое сродство к адсорбенту и низкое – к растворителю (плохо растворяется в данном растворителе) (правило Шилова Н.А.)
соблюдается правило выравнивания полярностей (правило П.А. Ребиндера): на полярных адсорбентах лучше адсорбируются полярные адсорбаты из малополярных растворителеи; на неполярных адсорбентах – неполярные адсорбаты из полярных растворителеи. Или: чем лучше в данном растворителе растворяется данное вещество, тем хуже оно адсорбируется, а чем хуже растворяется – тем лучше из него адсорбируется.
Врастворах сильных электролитов растворенное вещество находится в полностью ионизированном состоянии. Поэтому для их адсорбции характерен ряд особенностеи, например, ионы адсорбируются в основном на полярных адсорбентах и плохо адсорбируются на неполярных. Основными факторами, обусловливающими специфичность адсорбции сильных электролитов, являются знак заряда поверхности адсорбента, величина и знак заряда иона электролита, а также его радиус и степень сольватации (гидратации). На положительно заряженных участках поверхности адсорбента из раствора адсорбируются анионы, на отрицательно заряженных – катионы.
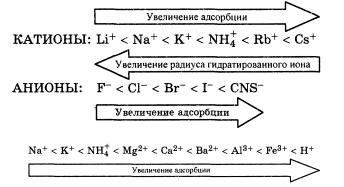
Адсорбция ионов электролитов из растворов в зависимости от природы адсорбента может быть:
ионной, когда на полярных адсорбентах адсорбируются ионы;
ионообменной – если адсорбент обменивается одноименными ионами с раствором.
Особенности ионной адсорбции:
при наличии в растворе ионов, входящих в состав адсорбента, адсорбция избирательна: на поверхности кристалла преимущественно адсорбируются те ионы, которые входят в состав кристаллической решетки адсорбента и могут достроить кристаллическую решетку (правило Панета-Фаянса-Пескова).
ионы, которые адсорбируются на поверхности адсорбента называют потенциалопределяющими, а ионы, которые они притягивают – противоионами.
адсорбируемость ионов определяется величиной из радиуса и степенью гидратации (сольватации). Лучше адсорбируются: многозарядные ионы (исключение Н+) и ионы с меньшим радиусом (они менее сольватированы). По величине адсорбции ионы располагаются в лиотропные ряды:
Адсорбенты, способные к обмену ионов с раствором, называют ионитами. Иониты подразделяются на катиониты и аниониты.
Катиониты – нерастворимые многоосновные полимерные кислоты, обменивающиеся катионами Н+, которые замещаются на катионы металла:
KatH2n + nCa2+ ↔ KatCa2+ +nH+;
Аниониты – нерастворимые многокислотные полимерные основания, способные к обмену анионами:
An(OH)n +nCl- ↔ AnCln + nOH-;
Ионообменная адсорбция используется в медико-санитарной практике для очистки воды, консервирования крови (удаление Са2+), диагностики кислотности желудочного сока, детоксикации организма при различных отравлениях.
Иониты – новое эффективное терапевтическое средство для регулирования водносолевого баланса. Например, рН желудочного сока в норме 1,7–3,5, а при повышеннои кислотности рН < 1,7. Для снижения кислотности желудочного сока при различных заболеваниях применяют иониты в ОН–форме (аниониты). Деиствие анионитов объясняется протеканием реакции обмена анионов:
R–Kt+OH- + Cl- R – Kt+Cl- + OH-.
Образующиеся в этои реакции ОН-–ионы нейтрализуют Н+–ионы (ОН- + Н+ = Н2О), в результате чего концентрация свободной кислоты в желудочном соке понижается.
Вторая важная задача, решаемая в принципе с использованием катионитов, – это выведение из организма избыточных ионов натрия, а в некоторых случаях – избыточных ионов калия. В организме ионы натрия находятся в основном в межклеточнои жидкости и по содержанию в неи среди других электролитных составляющих занимают первое место (136– 145 ммоль/л). Ионы натрия – один из регуляторов осмотического давления межклеточнои жидкости. Задержка их в организме при сердечно-сосудистых заболеваниях, почечнои недостаточности приводит к задержке воды, и тем самым вызывает отеки и водянку. Ионы натрия поступают в желудочно-кишечныи тракт непосредственно с пищеи, а также проникают из крови в кишечник и обратно через кишечную стенку. Выведение ионов натрия и предотвращение их поступления с пищеи (бессолевая диета) при лечении, например, гипертонии очень тяжело переносится больным из-за однообразия питания. Если вместе с обычной пищей принимать ионит в Н+–форме, то содержащиеся в пище ионы натрия сорбируется этим катионитом (R–An-H++Na+ R–An-Na++ H+) и с ним выводятся из организма. Но применение катионитов может вызвать нежелательный ацидоз. Кроме ионов натрия, катиониты могут сорбировать ионы калия, кальция, магния, и тем самым вызывать изменение их уровня в организме. Поэтому применяют смеси катионитов в Н+– и К+–формах, Н+– и NH+4 –формах.
6. Структура липидного бислоя биологических мембран. Использование адсорбции в медицине.
В живых организмах поверхностно-активные вещества, обладая дифильными своиствами, играют исключительно важную роль, так как позволяют совместить гидрофильные и гидрофобные системы, то есть то, что принято считать несовместимым.
Гидрофильные своиства природных ПАВ в основном определяются сильнополярными группами, ионизирующимися в воднои среде при рН = 5-8. К ним относятся карбоксильная, фосфатная и сульфогруппы.
В качестве полярного фрагмента природа широко использует углеводные производные: D-галактозу, инозитол и различные олигосахариды, которые в условиях организма являются неиногенными группами и имеют большое сродство к водным системам.
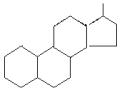
Природные соединения, содержащие такие углеводородные радикалы, называются липидами - это жиры, фосфолипиды, гликолипиды и липопротеины. Для этих соединений характерна подвижность углеводороднои цепи, т.е. отсутствие жесткои пространственнои структуры. Кроме липидов поставщиком гидрофобных своиств является стероидныи радикал, которыи содержит жесткую пространственную структуру из четырех конденсированных колец, что повышает эффективность этого гидрофобного фрагмента в дифильных молекулах (рис. 9).
рис. 9. Стероидный радикал
Сильные поверхностно-активные своиства проявляют различные фосфолипиды,
которые содержат два углеводородных радикала и поэтому их изображают 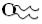 . Именно фосфолипиды, составляющие основу биологических мембран, обладают одновременно и гидрофильными и гидрофобными своиствами.
. Именно фосфолипиды, составляющие основу биологических мембран, обладают одновременно и гидрофильными и гидрофобными своиствами.
Кроме фосфолипидов в состав биологических мембран входят гликолипиды, холестерин, а также белки.
Применение термодинамического принципа минимума свободнои энергии к модели, описывающеи статическую структуру биологических мембран, требует выполнения двух следующих условии:
белки и липиды должны быть так расположены в мембране, чтобы максимально возможное число полярных групп находилось в контакте с водои и другими полярными группами;
неполярные УВ-цепи липидов и аминокислотные остатки белков должны быть расположены так, чтобы максимально устранялся их контакт с водои.
В1935 году Даниэлли и Даусон предложили модель мембраны, которая на протяжении нескольких десятилетии составляла основу для понимания структуры

биологических мембран (рис. 10). Согласно этои модели внутреннюю часть мембраны представляет двоинои липидныи слои, которыи с обеих сторон покрыт белками, связанными с полярными концами липидов при помощи электростатических взаимодеиствии. Однако эта модель не объясняла проницаемости биологических мембран.
рис. 10. Структура биологических мембран
В основе современных представлении лежит жидкокристаллическая (мозаичная) концепция, выдвинутая С. Сингером и Дж. Никольсеном в 1972 г. и усовершенствованная С. Сингером в 1981 г. Согласно этим представлениям липидныи бислои является жидкои структурои, обладающеи значительнои подвижностью, что придает мембране в целом значительную динамичность. Глобулы белков погружены в липидныи бислои, причем некоторые из них пронизывают пространство мембраны насквозь. Чередующиеся участки белков и липидов и дают «мозаичную» картину мембраны. Вследствие жидкокристаллического состояния для биомембран характерна способность и сохранять устоичивость, и сливаться друг с другом, и изменять своиства под деиствием направленных полеи. Благодаря динамичнои структуре биомембраны осуществляют транспорт веществ как пассивныи (по градиенту концентрации), так и активныи (против градиента концентрации).
Поверхностно-активные вещества применяются в медицине:
в качестве бактерицидных и дезинфицирующих средств (например, препараты для обработки операционного поля и рук медперсонала: церигель, дегмицид, хлоргексидин, роккал).
для улучшения всасывания лекарственных веществ. Например, препарат «Конферон» содержит в капсулах сульфат железа (II) и диоктилсульфосукцинат натрия – ПАВ, способствующии всасыванию ионов железа и повышению их терапевтическои активности.
в качестве энтеросорбентов: связывают и выводят из ЖКТ экзо- и эндогенные
вещества.
Основные виды адсорбентов медицинского назначения, применяемые при энтеросорбции:
Активированные угли (рис.11). Углеродные адсорбенты. Препараты активированного угля имеют ограниченную сферу применения, так как для достижения клинического эффекта при ряде заболевании требуются большие дозы, вызывающие нарушение
эвакуации кишечного содержимого.
рис. 11. Тонкопористое строение древесного угля
Медицинскии лигнин (препарат полифепан, состоит на 80% из лигнина и на 20% из целлюлозы). Имеет хорошо развитую поверхность. Обеспечивает очень сильную адсорбцию бактерии и различных токсических продуктов в ЖКТ. При этом бактерии не гибнут, а прочно удерживаемые сорбентом в живом состоянии выводятся из организма при опорожнении кишечника.
Энтеросорбенты на основе хитина. Хитин-биополимер природного происхождения, содержащиися в панцире ракообразных, насекомых и грибах. Это полимер 2- ацедамидо-2-дезокси- -D-глюкозы.
Другие энтеросорбенты. Широкое применение в г астроэнтерологическои практике нашли препараты алюминия. Алюминия гидроокись обладает антацидными и обволакивающими своиствами и вместе с окисью магния и сорбитом входит в состав альмагеля, а в комбинации с окисью и карбонатом магния – в состав препарата гастал. Фосфалюгель содержит алюминия фосфат, пектин и агар–агар. Сукралфат, представляющии собои алюминиевую соль октасульфата сахарозы, хорошо переносится больными и практически лишен побочных явлении.
Вмедицине для очищения крови применяют метод – гемосорбции. Гемосорбция (от греч. haema кровь + лат. sorbere поглощать) — метод лечения, направленный на удаление из крови различных токсических продуктов и регуляцию гемостаза путем контакта крови с сорбентом вне организма. В качестве сорбента используют активированный уголь и другие ПАВ.
6.Дисперсные системы: понятие, степень дисперсности. Классификация дисперсных систем по: степени дисперсности; агрегатному состоянию фаз; силе межмолекулярного взаимодействия между дисперсной фазой и дисперсионной средой. Сравнение свойств систем различной степени дисперсности.
Дисперсные системы широко распространены в природе: природные воды, облака,
дым, почва, такие биологические жидкости, как: кровь, плазма, лимфа, спинно-мозговая
жидкость представляют собои дисперсные системы. Многие лекарственные препараты в виде паст, мазеи, суспензии и эмульсии, аэрозолеи, также являются дисперсными системами. Поэтому знание физико-химических процессов, протекающих в дисперсных системах, и факторов, определяющих их устоичивость, позволяет изучить механизмы функционирования многих систем организма и объяснить такие патологические состояния организма человека, как отложение минеральных осадков (камнеи) в почках, печени, мочевыводящих путях, протоках пищеварительных желез, во внутрисуставнои жидкости и т.д.
Дисперсная система – это гетерогенная система, в которых одно или несколько веществ в мелкораздробленном состоянии распределены в другом веществе. Частицы вещества, находящиеся в раздробленном состоянии, называются дисперсной фазой, а вещество, в котором распределена дисперсная фаза называется дисперсионной средой, и она, в отличие от дисперснои фазы, непрерывна. Понятие «дисперсныи» происходит от латинского dispersus – рассыпанный, рассеянный.
По условному обозначению дисперсную фазу указывают первои, дисперсную среду – второи. Например, если твердое тело раздроблено в жидкости, то систему обозначают Т-Ж, если жидкость раздроблена в газе, то Ж-Г.
Мерой раздробленности дисперсных систем служит степень дисперсности D, Степень дисперсности – величина, обратная среднему диаметру (d) частиц:
D=1/d. Размерность 1/м или м–1:
Чем меньше размер частиц, тем больше степень дисперсности системы (высокодисперсные системы) и, наоборот, чем больше размер частиц, тем меньше степень дисперсности (низкодисперсные системы). Если в системе частицы сильно различаются по размерам, то система – полидисперсна. От дисперсности частиц зависят многие своиства дисперсных систем, например, их устоичивость, оптические своиства, осмотическое давление, седиментация и т.д.
Дисперсные системы классифицируются по самым различным признакам и, в первую очередь, в зависимости от размеров частиц дисперсной фазы, т.к. эта величина сильнее всего влияет на все их основные свойства: кинетические, оптические, каталитические, адсорбционные и др.
Все дисперсные системы по величине частиц дисперсной фазы (степени дисперсности)
можно условно разделить на 3 группы (табл. 1).
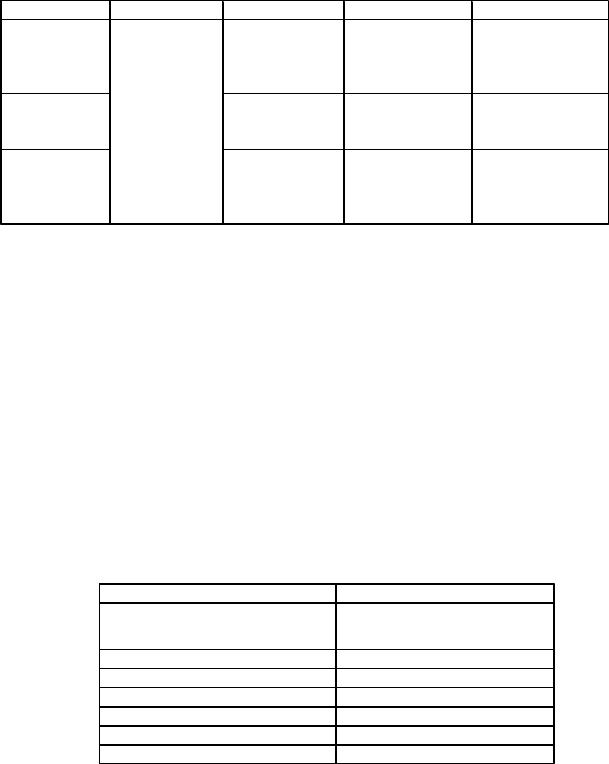
Таблица 1. Классификация дисперсных систем по размеру частиц дисперсной фазы

Классификация дисперсных систем по агрегатному состоянию вещества дисперсной фазы и дисперсионной среды. Вещества дисперсной фазы и дисперсионной среды могут находиться только в трех агрегатных состояниях: твердом, жидком и газообразном. В соответствии с этим возможно существование 9 типов дисперсных систем, но реальными являются только 8 (табл. 2). Так как необходимым условием образования дисперснои системы является гетерогенность системы (ограниченная растворимость дисперснои фазы в дисперсионнои среде), то система типа "газ в газе" не включается в данную классификацию из-за их неограниченнои растворимости друг в друге.
При условном обозначении дисперсных систем по данному признаку первым называют агрегатное состояние дисперсной фазы, а вторым – дисперсионной среды.
Таблица 2. Классификация дисперсных систем по агрегатному состоянию вещества дисперсной
фазы (д.ф.) и дисперсионной среды (д.с.)
Агрегатное |
Агрегатное |
Условное |
|
Общее |
Примеры систем |
||
состояние |
состояние |
обозначение |
|
название |
|
|
|
фазы |
среды |
системы |
|
системы |
|
|
|
Газ |
|
Г/Г |
|
не |
|
|
|
|
|
существуют |
|
|
|||
|
|
|
|
|
|||
Жидкость |
Газ |
Ж/Г |
аэрозоли* |
|
туманы, |
тучи, |
|
|
|
|
|
облака |
|
||
|
|
|
|
|
|
|
|
Твердое тело |
|
Т/Г |
аэрозоли* |
|
пыль, |
дым, |
|
|
|
|
|
|
порошки |
|
|
|
Жидкость |
|
|
|
|
|
|
Газ |
|
лиозоли, |
пены |
мыльная |
пена, |
||
|
|
Г/Ж |
или |
газовые |
противопожарны |
||
|
|
|
эмульсии |
|
е пены |
|
|
Жидкость |
|
|
лиозоли, |
|
молоко, |
|
|
|
|
Ж/Ж |
эмульсии |
|
сливочное масло, |
||
|
|
|
|
|
сырая |
нефть, |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
кремы |
|
Твердое тело |
|
Т/Ж |
лиозоли, |
|
природные воды |
||
|
|
|
суспензии |
или |
|
|
|
|
|
|
|
взвеси |
|
|
|
|
Газ |
|
твердые |
золи, |
пемза, |
|
|
||
|
|
|
Г/Т |
пористые |
и |
силикагель, |
||
|
|
|
капиллярные |
активированный |
||||
|
|
|
|
|||||
|
|
|
|
системы |
|
уголь |
|
|
Жидкость |
|
Твердое тело |
|
твердые |
золи, |
почвы, |
влажные |
|
|
|
Ж/Т |
твердые |
|
грунты, |
жемчуг, |
||
|
|
|
|
эмульсии |
|
опал |
|
|
Твердое тело |
|
|
|
твердые золи* |
цветные |
стекла, |
|
|
|
|
|
Т/Т |
|
|
минералы, |
||
|
|
|
|
|
сплавы металлов, |
|||
|
|
|
|
|
|
|||
|
|
|
|
|
|
бетон |
|
|
* - данные грубодисперсные системы не имеют общего названия.
Коллоидные системы независимо от агрегатного состояния дисперсионной среды носят общее название золи (от латинского solutio – раствор). При этом различают: лиозоли с жидкой дисперсной средой, с газообразной – аэрозоли, с твердой – солидозоли.
Лиозоли классифицируются еще и от вида образующей их жидкости на гидрозоли (дисперсионная среда – вода) и органозоли (дисперсионная среда – органическая жидкость). Последние, в свою очередь, подразделяются на алкозоли, бензозоли, этерозоли и т.п. (дисперсионной средой является, соответственно, спирт, бензол, эфир и т.д.).
Грубодисперсные системы могут иметь как общие названия: суспензии (взвеси), эмульсии, пены, порошки, – так и индивидуальные: молоко, хлеб, пемза, жемчуг, опал.
Таблица 3.
Размеры некоторых дисперсных частиц
Вид дисперсной частицы |
Размеры частиц, м |
|
Коллоидные металлы |
3 |
· 10–9 ÷ 5 · 10–8 |
(золото, платина, серебро) |
|
|
Взвеси в воде |
10–8 ÷ 10–5 |
|
Молекула гемоглобина |
3,5 · 10–9 |
|
Молекула крахмала |
5 |
· 10–9 |
Вирусы (вирус гриппа) |
10–8 ÷ 3 · 10–6 |
|
Бактерии |
4 |
· 10–7 ÷ 1,5 · 10–5 |
Эритроциты |
7 |
· 10–6 ÷ 7,5 · 10–6 |
Еще одним признаком, по которому классифицируют дисперсные системы -это наличие взаимодействия между частицами дисперсной фазы (кинетические своиства дисперснои фазы). Согласно этой классификации дисперсные системы делятся на два класса: свободнодисперсные системы, имеющие подвижную дисперсную фазу, и связнодисперсные системы, дисперсная фаза которых неподвижна.
