
ФИЗИЧЕСКАЯ ХИМИЯ ДИСПЕРСНЫХ СИСТЕМ И ПОВЕРХНОСТНЫХ ЯВЛЕНИЙ
.pdfФИЗИЧЕСКАЯ ХИМИЯ ДИСПЕРСНЫХ СИСТЕМ И ПОВЕРХНОСТНЫХ ЯВЛЕНИЙ
Вопросы к теме:
1.Особенности энергетического состояния поверхностей раздела фаз. Поверхностная энергия и поверхностное натяжение.
2.Поверхностно-активные и поверхностно-инактивные вещества, их классификация. Изотерма поверхностного натяжения. Правило Дюкло–Траубе.
3.Сорбция. Удельная адсорбция. Распределение веществ на границе раздела фаз.
4.Особенности адсорбции из растворов. Иониты, их применение.
5.Структура липидного бислоя биологических мембран. Использование адсорбции в медицине.
6.Дисперсные системы и их классификация по: степени дисперсности; агрегатному состоянию фаз; силе межмолекулярного взаимодействия между дисперсной фазой и дисперсионной средой. Сравнение свойств систем различной степени дисперсности.
7.Методы получения ДС. Методы очищения коллоидных растворов: диализ, электродиализ, ультрафильтрация. Физико-химические принципы функционирования искусственной почки.
8.Молекулярно-кинетические своиства коллоидно-дисперсных систем: броуновское движение, диффузия, осмотическое давление. Оптические своиства коллоидных систем. Опалесценция.
9.Устойчивость коллоидных растворов: агрегативная и кинетическая (седиментационная). Факторы, влияющие на устойчивость лиозолей.
10.Коагуляция коллоидных растворов, ее виды. Коагуляция электролитами. Коллоидная защита и ее значение.
11.Задачи.
1. Особенности энергетического состояния поверхности раздела фаз. Поверхностная энергия и поверхностное натяжение.
Организм человека представляет собой гетерогенную систему с двумя или более фазами, которые отделены друг от друга поверхностью раздела, например: кожные покровы, стенки кровеносных сосудов, мембраны клеток и т.д. На данных поверхностях протекают многие жизненно важные биологические процессы, причем начальной стадией их осуществления является адсорбция соответствующих компонентов.
По агрегатному состоянию граничных фаз все поверхности раздела могут быть:
-подвижными, если жидкая фаза граничит с газом (ж/г) или другой несмешивающейся жидкостью (ж/ж). В таких системах молекулы поверхностного слоя из-за теплового движения постоянно обмениваются положением с молекулами, расположенными внутри системы;
-и неподвижными, если молекулы твердой фазы граничат с газом (т/г) или жидкостью (т/ж).
Толщина поверхностного слоя составляет несколько молекулярных диаметров. Чаще всего он имеет толщину, равную диаметру одной молекулы, поэтому его называют мономолекулярным.
Процессы, протекающие на границе раздела фаз, называют поверхностными явлениями. Энергия частиц на поверхности и в объеме жидкости различна. Молекулы, находящиеся в
объеме жидкости, со всех сторон окружены молекулами в той же фазе, поэтому равнодействующая сил их межмолекулярного взаимодействия равна нулю. Молекулы, находящиеся на поверхности жидкости, испытывают различное воздействие со стороны многочисленных молекул жидкости и малочисленных молекул пара (расстояния между молекулами в газообразном состоянии больше), поэтому равнодействующая сил межмолекулярного взаимодействия не равна нулю и направлена в сторону жидкости (рис. 1). С термодинамическои точки зрения такое состояние энергетически невыгодно. Поэтому молекулы поверхностного слоя стремятся удалиться внутрь жидкои фазы, что приводит к уменьшению площади поверхности раздела фаз. Этим объясняется шарообразная форма мелких капелек и идеально гладкая поверхность жидкости в широком сосуде.
Пар
Жидкость |
Рис.1. Действие межмолекулярных сил внутри жидкости и на ее поверхности.
Таким образом, молекулы поверхностного слоя из-за нескомпенсированности межмолекулярных сил притяжения имеет избыточную внутреннюю энергию по сравнению с молекулами в объеме жидкости.
Энергия межмолекулярного взаимодействия частиц поверхностного слоя с частицами каждой из контактирующих фаз, называется свободной поверхностной энергией Гиббса (GS).
Она зависит от количества частиц в поверхностном слое, от площади поверхности и имеет выражение:
GS =σ. S
Поверхностная энергия, приходящаяся на единицу площади поверхности, называется поверхностным натяжением (или коэффициентом поверхностного натяжение или
удельной свободной поверхностной энергией) (σ).
σ=GS / S
Удельную свободную поверхностную энергию для подвижных поверхностей раздела называют коэффициентом поверхностного натяжения (поверхностным натяжением) и
обозначают σ г/ж или σ ж/ж.
По своему физическому смыслу поверхностное натяжение – стремление жидкого или твердого вещества уменьшить избыток поверхностной энергии. Она измеряется работой, затрачиваемой на создание единицы площади поверхности раздела фаз (единицы измерения σ - Дж/м2 или в Н/м. (Н — Ньютон). Чем сильнее взаимодействие между молекулами, тем больше величина поверхностного натяжения.
Величина поверхностного натяжения зависит от:
природы контактирующих фаз: так, для полярных жидкостей вследствие более сильного межмолекулярного взаимодействия поверхностное натяжение существенно выше, чем для неполярных жидкостей. Из всех жидкостей вода (кроме ртути) имеет самое высокое значение поверхностного натяжения за счет образования межмолекулярных водородных связей. Благодаря высокому поверхностному натяжению вода легко поднимается по капиллярам в тканях живых организмов и растений. Поверхностное натяжение воды при температуре 20 С составляет 72,75 мН/м.
природы и концентрации растворенных веществ: чем меньше силы молекулярного
взаимодействия между |
молекулами разных фаз, тем больше поверхностное |
натяжение. |
|
температуры: с ростом температуры снижается различие в энергии частиц контактирующих фаз, поэтому поверхностное натяжение уменьшается. При критической температуре, когда полностью исчезает различие между паром и жидкостью, σ = 0.
давления (на границе г/ж или г/т): с ростом давления поверхностное натяжение
уменьшается из-за увеличения концентрации молекул в газовой фазе и уменьшения поверхностной энергии.
Коэффициент поверхностного натяжения для подвижных поверхностей раздела экспериментально определяют при помощи сталагмометра (с греч. stalagma - капля) по скорости истекания капель из капилляра (сталагмометрический способ), используют и другие методы.
Поверхностное натяжение для неподвижных поверхностей раздела экспериментально определить трудно, но ее значение оценивают по способности твердой поверхности к смачиванию. Изменение поверхностного натяжения биологических жидкостеи используется в диагностических целях. К примеру, поверхностное натяжение плазмы крови значительно
изменяется при различных заболеваниях (анафилактическии шок, рак и др.). С возрастом человека поверхностное натяжение сыворотки крови уменьшается.
Согласно второму закону термодинамики самопроизвольно протекают процессы, приводящие к уменьшению энергии Гиббса. Для поверхностных явлений уменьшение удельной поверхностной энергии Гиббса ( Gs=Gs(кон)-Gs(нач)= σ. S<0) возможно при:
уменьшении площади поверхности ( S<0) за счет слияния капель жидкости или газа (адгезия) или при слипании частиц в дисперсных системах (коагуляция).
снижении поверхностного натяжения ( σ<0) за счет поглощения веществ поверхностным слоем.
2. Поверхностно-активные и поверхностно-инактивные вещества, их классификация. Изотерма поверхностного натяжения. Правило Дюкло–Траубе.
В чистых жидкостях уменьшение поверхностной энергии происходит только путем сокращения площади поверхности. В растворах понижение свободнои поверхностнои энергии может происходить за счет уменьшения поверхностного натяжения в результате адсорбции растворенного вещества в поверхностном слое жидкости.
Способность растворенного вещества изменять поверхностное натяжение жидкости называется поверхностной активностью (обозначение g).
По способности менять поверхностное натяжение растворителя, все вещества делят
на:
поверхностно активные вещества (ПАВ) понижают поверхностное натяжение чистого растворителя ( σ 0) и поэтому накапливаются в поверхностном слое. Их концентрация в поверхностном слое в десятки тысяч раз больше, чем в объеме. ПАВ обладают малой растворимостью и меньшим поверхностным натяжением по сравнению с поверхностным натяжением чистого растворителя. В водных растворах свойства ПАВ проявляют многие органические вещества, например, спирты и кислоты алифатического ряда, сложные эфиры, белки и др.
поверхностно инактивные вещества (ПИВ) незначительно повышают поверхностное натяжение ( σ 0), поэтому накапливаются в объеме фазы. ПИВ часто хорошо растворимы, имеют большее поверхностное натяжение по сравнению с чистым растворителем и стремятся перейти вглубь раствора, чтобы увеличение поверхностного натяжение оказалось минимальным (рис. 2). К таким веществам в водных растворах относятся многие неорганические кислоты, основания и соли, полярные молекулы и ионы которых сильнее взаимодействуют с водой, чем между
собой. Свойства ПИВ проявляют и некоторые органические соединения, например, - аминокислоты. Такие молекулы стремятся внутрь системы.
1 |
2 |
3 |
S |
S |
S |
Cs |
|
|
V |
V |
V |
Cv |
|
|
ПАВ |
ПИВ |
ПНВ |
Рис.2. Возможные случаи распределения растворенного вещества между поверхностным слоем и объемом жидкой фазы (воды). Концентрация растворенного вещества: Cs в поверхностном слое; Cv - в объеме фазы.
поверхностно-неактивные вещества (ПНВ) практически не изменяют поверхностное
натяжение жидкости, в которой они растворены ( σ = 0), поэтому их концентрация в поверхностном слое такая же, как и в объеме фазы. К ним относятся: глюкоза, сахароза и другие вещества.
Молекулы ПАВ дифильны, т.е. в их структуре присутствует полярный фрагмент (гидрофильный) и неполярный (гидрофобный). Дифильные молекулы принято изображать в виде «головастика» 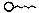 , в котором «голова»
, в котором «голова»  соответствует полярной группе: (–COOH, – OH, –SO3Н, -ОРО3Н2, и др.), а хвост – гидрофобному фрагменту (углеводородныи радикал- R, содержащий более 10 атомов углерода). ПАВ позволяют совместить между собой гидрофильные и гидрофобные системы, совмещая несовместимое согласно правилу: подобное сочетается с подобным. Полярный фрагмент всегда обращен к полярной (гидрофильной) фазе (вода, силикагель), а неполярный – к неполярной (гидрофобной) фазе (масло, уголь).
соответствует полярной группе: (–COOH, – OH, –SO3Н, -ОРО3Н2, и др.), а хвост – гидрофобному фрагменту (углеводородныи радикал- R, содержащий более 10 атомов углерода). ПАВ позволяют совместить между собой гидрофильные и гидрофобные системы, совмещая несовместимое согласно правилу: подобное сочетается с подобным. Полярный фрагмент всегда обращен к полярной (гидрофильной) фазе (вода, силикагель), а неполярный – к неполярной (гидрофобной) фазе (масло, уголь).
ПАВ в зависимости от способности к диссоциации делят на электролиты (ионогенные ПАВ) и неэлектролиты (неионогенные ПАВ).
Ионогенные ПАВ классификацируют по характеру полярной группы на:
анионоактивные ПАВ (полярная группа - кислотная), например, соли высших карбоновых кислот RCOONa, алкилсульфаты ROSO3Na, где R - углеводородная цепь с числом атомов углерода 10, фосфолипиды (рис.3), желчные кислоты, гликолипиды.

рис.3 Фосфолипиды как молекулы анионоактивных ПАВ
катионоактивные ПАВ (полярная группа - катион), например, соли тетраалкиламмония [R4N] +X- или соли алкилпиридиния [RN+C5H5]X-, где R - углеводородная цепь с числом атомов углерода 8.
амфеотерные ПАВ : хлоргидрат алкилдиаминоэтилглицина – [Н3С-(СН2)2-NH- (CH2)2-NH-COOH]HCl.
Кнеионогенным ПАВ относят: твины и спаны. Твины – сложные эфиры ангидридасорбита и жирных кислот, алкилированных окисью этилена. Спаны – сложные эфиры сорбита и жирных кислот, имеющие общую формулу: НО-(СНОН)4-СН2ООСR.
Молекулы белков содержат в своих цепях как гидрофобные, так и гидрофильные группы, поэтому являются ПАВ. Радикалы могут приобретать различные заряды, поэтому они могут относиться к любой группе ПАВ.
Катионоактивные и анионоактивные ПАВ обладают ярко выраженным антимикробным действием и используются в хирургии в качестве антисептиков. Антимикробное действие ПАВ связывают с их влиянием на проницаемость клеточных мембран, а также ингибирующим действием на ферментативные системы микроорганизмов. Неионогенные ПАВ не обладают противомикробным действием.
При добавлении того или иного вещества к растворителю происходит изменение его поверхностной активности, которое при данной температуре зависит от концентрации добавляемого вещества.
Графическое изображение зависимости поверхностного натяжения раствора (σ) от концентрации растворенного вещества при данной температуре называется изотермой поверхностного натяжения. (рис. 4).

s 
ПИВ (Dσ > 0; g< 0) ПНВ (Dσ = 0; g = 0)
ПАВ (Dσ < 0; g >0)
С 
рис.4. Зависимость поверхностного натяжения растворов от концентрации вещества
Поверхностная активность зависит от природы ПАВ. В гомологических рядах карбоновых кислот, спиртов, аминов и некоторых других классах ПАВ действует правило Дюкло-Траубе: поверхностная активность ПАВ при удлинении гидрофобной части молекулы на одну метиленовую группу СН2 увеличивается в 3 - 3,5 раза (в среднем в 3,2 раза). Это правило соблюдается в разбавленных водных растворах данных ПАВ при их одинаковой молярной концентрации.
s
НСООН СН3СООН
С2Н5СООН С3Н7СООН
C
рис.5. Изотермы поверхностного натяжения водных растворов насыщенных карбоновых кислот при 298 К.
Как показывает рис. 5, чем длиннее углеводородный радикал и больше концентрация ПАВ, тем сильнее снижается поверхностное натяжение. Согласно правилу Дюкло-Траубе, поверхностная активность масляной кислоты С3Н7СООН больше поверхностной активности уксусной кислоты СН3СООН в 3,22 = 10,24 раза, так как они отличаются на две группы -СН2-, поэтому поверхностное натяжение раствора масляной кислоты меньше поверхностного натяжения раствора уксусной кислоты той же концентрации.
3. Сорбция. Удельная адсорбция. Распределение веществ на границе раздела фаз.
Поверхностные явления, самопроизвольно протекающие на поверхности и связанные с изменением состава поверхностного слоя, называют сорбцией.

Сорбция – процесс самопроизвольного накопления (поглощения) одного вещества на поверхности другого. То, вещество, которое поглощает называют сорбентом, а поглощаемое
–сорбтивом, а уже поглощенное - сорбатом.
Взависимости от степени связывания поглощаемого вещества сорбция может быть обратимой и необратимой. Чаще всего сорбция является обратимым процессом. Процесс, обратный сорбции, называется десорбция. В состоянии равновесия скорости сорбции и десорбции равны:
Запах, появляющийся над водной поверхностью, обусловлен процессом десорбции газов из жидкости.
В зависимости от степени проникновения сорбтива в сорбент – все сорбционные процессы делят на адсорбцию и абсорбцию.
Если поглощение вещества произошло только на поверхности, то для обозначение процесса и участников добавляют приставку ад (в переводе с лат. ad – на и sorbeo - поглощаю), а если во всем объеме, то приставку аб- (с лат. - в).
Адсорбция - накопление вещества на поверхности сорбента. Абсорбция - накопление вещества в объеме сорбента.
При адсорбции происходит взаимодействие поглощаемого вещества (адсорбата) с активными центрами поверхности адсорбента, которое может быть различным, вследствие чего различают физическую и химическую адсорбцию.
Если при сорбции состав поглощаемого вещества не изменяется, то это физическая сорбция, а если в результате взаимодействия сорбента с сорбтивом образуются новые соединения, то это химическая сорбция.
Физическая адсорбция обусловлена межмолекулярным взаимодействием за счет слабых сил Ван-дер-Ваальса или водородных (энергия взаимодействия 4-40 кДж/моль, поэтому она:
обратима: одновременно протекает десорбция;
мало специфична;
экзотермична, поэтому при нагревании равновесие смещается в сторону десорбции.
При химическои адсорбции (хемосорбции) между адсорбентом и адсорбатом образуется химическая связь (энергия возникающих связей 40-400 кДж/моль), что часто приводит к образованию на границе раздела фаз новых соединений. Например, адсорбция СО на гашенои извести ведет к образованию на ее поверхности тонкого слоя карбоната кальция:
СО2(г) + Са(ОН)2(т) = СаСО3(т) + Н2О(г)
Химическая адсорбция:
необратима;
специфична;
чаще экзотермична, чем эндотермична.
Чаще всего процессы адсорбции, абсорбции, физической и химической сорбции взаимосвязаны и разделить и бывает сложно. Например, сорбция всегда начинается с поглощения (физическая) и в зависимости от условий может переходить в химическую и наоборот. Для организма характерна смешанная адсорбция из многокомпанентных систем. Это смешанная адсорбция, так как в зависимости от природы одни вещества связываются слабо (физическая адсорбция), другие – прочно (химическая адсорбция).
Глубину протекания адсорбции характеризуют величиной, называемой – удельная адсорбция (Г) (другие названия: избыточная адсорбция, адсорбция Гиббса или просто адсорбция).
Адсорбция (Г) – это количество поглощаемого вещества, приходящееся на единицу площади поверхности адсорбента (для подвижных поверхностей):
Г=(n-no)/S
Часто трудно определить площадь пограничной неподвижной поверхности, поэтому величину адсорбции (Г) рассчитывают исходя из массы адсорбента.
Адсорбция (Г) – это количество поглощаемого вещества, приходящееся на единицу массы адсорбента (для неподвижных поверхностей):
Г=(n-no)/m
где: no –количество вещества в поверхностном слое до адсорбции,
n- количество вещества в поверхностном слое после достижения адсорбционного равновесия,
S – площадь поверхностного слоя, m – масса адсорбента в г.
Единица измерения Г (гамма) - моль/м2 или моль/г. Величина удельной адсорбции зависит от:
природы адсорбента;
площади граничной поверхности;
сродства адсорбтива к адсорбенту;
температуры;

концентрации растворенного вещества или давления газа.
Влияние природы адсорбента на величину адсорбции. В энергетическом отношении молекулы поверхностного слоя и расположенные внутри – неравноценны (рис. 6). Участки поверхности с наибольшим запасом поверхностнои энергии Гиббса называются активными центрами. Активные центры адсорбентов с аморфной структурой (активированный уголь) располагаются на выступах, впадинах и в капиллярах, а у кристаллов (оксиды алюминия, кремния) – на ребрах, углах и трещинах. Молекулы адсорбата, взаимодействуя с активными центрами адсорбента, удерживаются на его поверхности, поскольку снижают энергию поверхностного слоя.
рис. 5. Неоднородность поверхности твердого тела
Адсорбенты по химической природе делят на
-гидрофобные: неполярные жидкости, сажа, активированный уголь, тальк.
-гидрофильные: полярные жидкости, силикагель, алюмагель, глины.
Влияние площади граничной поверхности на величину адсорбции: твердые сорбенты,
имеющие большую площадь поверхности (сильнее измельчены и имеют больше пор) сильнее адсорбируют вещества: адсорбент тем эффективней, чем мельче измельчен и выше его пористость. Например, для получения новых пор и очистки от старых от смол уголь активируют: подвергают обжигу без доступа воздуха, далее его обрабатывают перегретым водяным паром.
Влияние сродства адсорбтива к адсорбенту на величину адсорбции: (принцип «подобное в подобном»). Полярные адсорбенты лучше адсорбируют полярные вещества. При адсорбции смеси газов соблюдается правило: лучше адсорбируется тот газ, который легче сжимается, так как его молекулы более склонны к межмолекулярным взаимодействиям.
Влияние температуры на величину адсорбции: адсорбция чаще процесс экзотермический, поэтому по принципц Ле Шателье при повышении температуры она уменьшается. Если адсорбируется вещество из раствора, то снижение адсорбции может быть связано с увеличением растворимости вещества в растворителе и ослаблением его связей с адсорбентом.
Концентрация поглощаемого вещества будет больше в той фазе, природа которой ближе к природе поглощаемого вещества, т.е. полярное вещество хорошо сорбируется
