
ОСНОВЫ ХИМИЧЕСКОЙ КИНЕТИКИ. ГЕТЕРОГЕННЫЕ РАВНОВЕСИЯ
.pdfОСНОВЫ ХИМИЧЕСКОЙ КИНЕТИКИ. ГЕТЕРОГЕННЫЕ РАВНОВЕСИЯ
Вопросы к теме:
1.Скорость реакции: средняя и истинная. Закон действующих масс.
2.Классификации реакций, применяющиеся в кинетике
3.Молекулярность и порядок реакции. Зависимость скорости реакции от концентрации.
4.Зависимость скорости реакции от температуры. Температурный коэффициент скорости реакции и его особенности для биохимических процессов. Энергия активации.
5.Катализ: гомогенный и гетерогенный. Ферментативный катализ. Уравнение Михаэлиса-Ментен.
6.Химическое равновесие. Обратимые и необратимые реакции
7.Константа химического равновесия. Прогнозирование смещения химического равновесия.
8.Гетерогенные равновесия. Константа растворимости. Условия образования и растворения осадков.
9.Реакции, лежащие в основе образования неорганического вещества костной ткани гидроксифосфата кальция. Явление изоморфизма.
10.Задачи.
1. Скорость реакции: средняя и истинная. Закон действующих масс.
Химическая кинетика — раздел физической химии, представляющий собой учение о скоростях и механизмах протекания химических реакций.
Химическая реакция. Химической реакцией можно считать любое изменение вещества, при котором образуются или разрываются химические связи между атомами. Различают простые и сложные реакции. Простые реакции — это реакции, протекающие в одну стадию. Их стехиометрическое уравнение правильно отражает реальный ход реакции:
H2 + I2 → 2HI
Сложные реакции протекают через несколько стадий. Стехиометрическое уравнение не отражает реального хода процесса и является выражением суммарного результата нескольких стадий. Например, реакция взаимодействия между пероксидом водорода и йодоводородом может протекать в две стадии:
Первая стадия: H2O2 + HI →НIО + H2O Вторая стадия: HIO + HI →I2 + H2O Суммарное уравнение: H2O2 + 2HI →I2 + 2H2O
Абсолютное большинство химических реакций являются сложными. Совокупность стадий, из которых складывается химическая реакция, носит название механизма химической реакции. Каждая отдельная стадия, через которую идет реакция, называется элементарным актом реакции. Исходные, конечные и промежуточные вещества. Вещества, которые образуются в процессе химического превращения и не изменяются при дальнейшем протекании реакции.

Вещества, которые образуются на первой стадии химической реакции, затем превращаются в другие вещества на следующей стадии этой же реакции, называются промежуточными веществами. Например, в выше рассмотренной реакции кислота HIO является промежуточным веществом.
Скорость химической реакции — это изменение концентрации любого из участвующих в реакции веществ в единицу времени. Средняя скорость реакции (V) за промежуток времени t2–t1 равна:
где ΔC – изменение концентрации, знак минус означает, что концентрация исходного вещества в процессе реакции постепенно убывает и, следовательно, скорость реакции уменьшается. Отношение в пределе, переходя к бесконечно малым величинам, дает
производную: 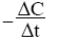
Таким образом, производная от концентрации по времени характеризует мгновенную (истинную) скорость химической реакции: V = − dC / dt.
Скорость химической реакции всегда является величиной положительной, отношение же dC/dt может иметь и положительное и отрицательное значение в зависимости от того, представляет ли С концентрацию одного из исходных веществ или одного из продуктов реакции. В первом случае dC/dt < 0, но так как скорость должна быть величиной положительной, перед производной ставят знак минус; во втором случае dC/dt >0 и чтобы скорость реакции имела положительное значение берут производную со знаком плюс. В общем случае кинетическое уравнение имеет вид: V = ± dC / dt.
Измеренные по разным веществам скорости не равны, а пропорциональны одна другой. Скорость химической реакции выражается в моль×л–1×с–1.
Определение скорости реакции. При определении скорости реакции производят измерение концентрации реагентов в зависимости от времени. Кривая, изображающая зависимость концентрации какого-либо вещества от времени в ходе процесса химического превращения, носит название кинетической кривой. Зная кинетическую кривую для какоголибо компонента, можно легко определить скорость его накопления или расходования графическим дифференцированием кинетической кривой (рис. 1.).
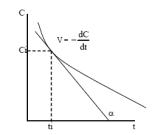
рис. 1. Кинетическая кривая
Крутизна кинетической кривой в каждый момент времени характеризует истинную скорость реакции в этот момент времени, так как наклон касательной в точке численно равен скорости: V = –dt / dC = tgα.
Существуют и косвенные методы определения скорости химической реакции, когда за ходом химического превращения следят за изменением рН раствора, электропроводности, показателя преломления, оптической плотности и т. д.
Скорость химической реакции зависит от многих факторов: концентрации, природы реагирующих веществ, давления (для газовых систем), температуры, катализаторов и даже формы реакционного сосуда. Зависимость скорости реакции от концентраций реагирующих веществ описывается основным постулатом химической кинетики (закон действующих
масс): скорость реакции в каждый момент времени пропорциональна произведению концентраций реагирующих веществ, возведенных в некоторые степени. Для реакции аА + вВ → сС + dD можно записать:
V = k[A]a×[B]в.
Уравнение, отражающее зависимость скорости реакции от концентраций реагирующих веществ, называется кинетическим уравнением реакции. Множитель k в этом уравнении показывает скорость химической реакции при концентрациях реагирующих веществ, равных 1 моль/л, называется константой скорости химической реакции. Она не зависит от концентрации и характеризует влияние природы реагирующих веществ на скорость их взаимодействия друг с другом. Из этого следует, что константа скорости реакции является мерой реакционной способности молекул.
2. Классификации реакций, применяющиеся в кинетике.
Гомогенные и гетерогенные реакции. Химическая реакция, протекающая в пределах одной фазы, называется гомогенной химической реакцией. Химическая реакция, протекающая на границе раздела фаз, называется гетерогенной химической реакцией. Примером гомогенных реакций может служить любая реакция в растворе. Примером
гетерогенной реакции может служить любая из реакций, идущих на поверхности твердого катализатора (гетерогенная каталитическая реакция).
Для гетерогенной (неоднородной) системы скорость химической реакции измеряется количеством веществ, вступивших в реакцию или образующихся в результате реакции за единицу времени на единице поверхности раздела фаз:
v Δn(x).
S Δt
Размерность скорости гетерогенной реакции: [моль∙м–2∙с–1].
Ферментативные, или микрогетерогенные, реакции играют ведущую роль в химических превращениях в живой природе. Ферменты (называемые также энзимами) — катализаторы белковой природы, образующиеся в живых организмах. Ферменты осуществляют сложный комплекс химических превращений, обеспечивающих жизнедеятельность (дыхание, пищеварение, синтез белков и т. п.) живых организмов. По некоторым свойствам, в первую очередь высокой химической специфичности и колоссальной активности, ферменты значительно превосходят промышленные катализаторы.
Большинство реакций являются сложными. Сложные реакции протекают через простые реакции, т. е. через несколько стадий. Рассмотрим несколько типов сложных реакций.
1. Последовательные реакции. При последовательных реакциях продукты одной стадии являются исходными для последующей.
А→В→С→Д Если одна из стадий протекает значительно медленнее других, то эта стадия будет
определять скорость всего процесса и ее называют лимитирующей стадией. По такому механизму идет гидролиз АТФ и крахмала, окисление питательных веществ до СО2 и Н2О в организме.
2. Параллельные реакции. Реакции, в ходе которых из одних и тех же исходных веществ одновременно образуется несколько продуктов реакции.
Например, реакция разложения гидразина может идти по двум параллельным путям: N2Н4 → N2 + 2Н2
3N2Н4→4NН3 + N2
3. Сопряженные реакции. С одним и тем же реагентом могут реагировать одновременно два или более веществ и такие реакции называются сопряженными. Например: А + В → АВ; А + Д → АД.
Внекоторых случаях одна реакция ускоряет своим течением другую. Одна идет самостоятельно, вторая — только в присутствии первой. Синтез пептидов и белков идет только в присутствии реакции гидролиза АТФ. Многие биохимические реакции в организме протекают по механизму сопряженных химических реакций.
4. Обратимые реакции протекают в двух противоположных направлениях до установления состояния равновесия, когда скорость обратной реакции равна скорости прямой: А + В С + Д
5. Цепные реакции протекают с участием свободных радикалов через ряд регулярно повторяющихся элементарных реакций. Каждая реакция состоит из трех стадий: инициирование цепи — образование свободных радикалов под влиянием облучения, теплового воздействия; рост цепи, обрыв цепи, в результате которого образуются нейтральные молекулы. По цепному механизму протекают фотохимические реакции, рост опухолей.
Например, реакция взаимодействия хлора с водородом может начинаться в результате воздействия света на молекулы хлора с образованием свободных атомов хлора: Cl2 →hν 2Cl
Вследующей стадии цепной реакции происходит рост цепи:
Cl· + Н2 → НCl + Н·; Н· + Сl2 → НCl + Cl·
Третьей стадией цепной реакции является обрыв цепи. Н· + Н· → Н2;
Cl· + Н· → НCl
6. Фотохимические реакции протекают под действием света. Под действием квантов света hν (h — постоянная Планка, ν — частота излучения) молекулы становятся возбужденными, т. е. активными и вступают в химическое взаимодействие. Фотохимические реакции характеризуются квантовым выходом. Под квантовым выходом понимается число молекул, которые прореагировали при поглощении одного кванта света. Фотохимические реакции лежат в основе механизма зрения, процесса фотосинтеза.
6СО2 + 6 Н2О →hν С6Н12О6 + 6О2
3. Молекулярность и порядок реакции. Зависимость скорости реакции от концентрации.
Показатели степени а и b кинетическом уравнении реакции называются порядком реакции по данному веществу. Сумма (а + b) — общий порядок реакции. Порядок реакции - величина формальная. Может быть положительной, отрицательной, целым, дробным,
нулевым числом. Порядок реакции определяется экспериментально, его нельзя предсказать заранее.
Для многих химических реакций порядок реакции по данному веществу не равен стехиометрическому коэффициенту.
Для простых реакций показатели степеней в кинетических уравнениях равны коэффициентам стехиометрических уравнений. Например, скорость реакции H2 + I2 = 2HI может быть записана следующим образом:
V = k[H2] × [I2],
где порядок реакции по водороду и йоду равен единице, а порядок реакции в целом равен 1 + 1 = 2. В этом случае стехиометрическое уравнение правильно отображает элементарный акт реакции.
Эта закономерность находит свое отражение в законе действующих масс, сформулированном в 1867 г. норвежскими учеными К. Гульдбергом и П. Вааге: скорость
простой реакции в каждый момент времени пропорциональна произведению концентраций реагирующих веществ, возведенных в степени, равные коэффициентам в стехиометрическом уравнении.
Таким образом, закон действующих масс является частным случаем основного постулата химической кинетики. Закон действующих масс является справедливым только для простых реакций.
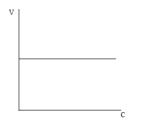
1. Для реакции нулевого порядка скорость реакции не зависит от концентрации вещества и графически скорость реакции от концентрации дает прямую линию, параллельную оси абсцисс (рис.2.).
рис. 2. Зависимость скорости реакции υ нулевого порядка от концентрации
Математическое выражение для реакции нулевого порядка V= − dC / dt = kC0 = k , где k — константа скорости и ее размерность равна: k = [с]×[t]−1.
К реакциям нулевого порядка относятся следующие реакции: а) фотохимические реакции Н2 + Cl2 → 2НCl;
б) реакция гидролиза этилацетата СН3СООС2Н5 + Н2О → СН3СООН + С2Н5ОН.

2. Для реакции первого порядка
V = − dC / dt = kC1 ,
а размерность константы скорости k = [t]−1. В этом случае зависимость lnс от времени имеет прямолинейный характер (рис. 3.).
рис. 3. Зависимость lnC от времени для реакции первого порядка
Первый порядок имеют:
-реакция гидролиза сахарозы С12Н22О11 + Н2О = С6Н12О6 + С6Н12О6;
-реакция разложения N2О5: N2О5(г) → 4NО2(г) + О2;
-реакции радиоактивного распада.
3. Скорость реакции второго порядка для двух реагентов подчиняется кинетическому уравнению V= − dC / dt = kC11 × C21. Если С1= С2 или, если реагируют одинаковые частицы, то
V = − dC / dt = kC12.
Вэтом случае размерность константы скорости реакции k равна [с]−1× [t]−1. Второй порядок имеют, например, реакции:
NOCl = 2NO + Cl2; 4НBr + O2 = 2Н2О + Br2.
Вслучае реакции второго порядка зависимость 1/С от времени имеет прямолинейный
характер. Эта зависимость показана на рис. 4.
рис. 4. Зависимость 1/С от времени для реакции второго порядка

Сравнивать между собой реакции разного порядка можно по скоростям, т. к. скорости реакции разного порядка имеют одинаковую размерность. Сравнение констант скорости разного порядка не имеет смысла, так как они имеют разные размерности. Можно сравнивать между собой константы скорости одного и того же порядка.
Период полупревращения (период полураспада) – это время, в течение которого прореагирует половина исходного вещества в химической реакции (t1/2). Для реакции нулевого порядка t1/2 = С0/2k, т. е. t1/2 пропорционально начальной концентрации (С0) исходного вещества. В случае реакции первого порядка t1/2 = ln2 / k = 0,693 / k, т.е. t1/2 не зависит от начальной концентрации исходного вещества, а константа скорости (k) обратно пропорциональна периоду полупревращения. Период полупревращения для реакции второго порядка равен: t1/2 = 1 / kC0, т.е. период полупревращения обратно пропорционален начальной концентрации.
Чем больше значение времени полупревращения t1/2, тем больше вещества находится в организме. Это имеет значение для токсикологии, фармакологии.
Молекулярность реакции — число молекул, участвующих в одном элементарном акте реакции. Следует отметить, что понятие молекулярности можно применять только для элементарных реакций. К числу элементарных реакций относится, например, разложение 1,2-диметилдиазена:
CH3N = NCH3 → C2H6 + N2.
Данная реакция является мономолекулярной в элементарном акте участвует одна молекула. Если в одном акте в реакцию вступают две молекулы, то реакция является
бимолекулярной. Например:
H2 + I2 → 2HI.
Соответственно при тримолекулярной реакции в одном элементарном акте участвуют три частицы (молекулы):
2NO + O2 → 2NO2
Интересно, что большинство реакций, встречающихся на практике, кажутся простыми. Однако детальное изучение кинетики показывает, что зачастую они протекают по более сложным механизмам. Так, реакция термического разложения паров дихлорэтана:
CH2Cl – CH2Cl |
|
|
CHCl = CH2 + HCl |
|
|||
на первый взгляд представляется элементарной. |
|
||
Действительно, кинетическое уравнение этой реакции имеет вид: v k C(C2H4Cl2) ,
что указывает на первый порядок.
Однако данная реакция не является мономолекулярной, так как протекает в несколько стадий:
1)C2H4Cl2 → C2H4Cl + Cl•
2)Cl• + C2H4Cl2 → C2H3Cl2 + HCl
3)C2H3Cl2 → C2H3Cl + Cl•
4)C2H4Cl + Cl• → C2H4Cl2
Вэтом механизме первая и третья стадии мономолекулярны, а вторая и четвертая –
бимолекулярны. Очевидно, говорить о молекулярности реакции разложения дихлорэтана в целом нельзя. В то же время можно говорить о ее первом кинетическом порядке.
Данный пример наглядно иллюстрирует факт, что порядок реакции далеко не всегда совпадает с ее молекулярностью. В целом, моно-, би- и тримолекулярные реакции являются, соответственно, реакциями первого, второго и третьего порядков; обратное же заключение может оказаться ошибочным.
4. Зависимость скорости реакции от температуры. Температурный коэффициент скорости реакции и его особенности для биохимических процессов. Энергия активации.
В 1884 г. Вант-Гофф установил, что при повышении температуры на 10 градусов скорость многих реакций увеличивается в 2–4 раза (Правило Вант-Гоффа). Математически эта зависимость выражается соотношением:
t2 t1
V2 V1 10
где V2 и V1 – скорости реакции при температурах t1 и t2, γ – температурный коэффициент скорости реакции. Для многих реакций γ имеет значения в пределах 2–4. Коэффициент γ показывает, во сколько раз увеличится скорость реакции при повышении температуры на каждые десять градусов. Правило Вант-Гоффа можно использовать тогда, когда реакция проводится при температуре близкой к комнатной.
Для биохимических реакций температурный коэффициент γ находится в интервале от 7 до 10, т. е. биохимические реакции сильнее зависят от температуры. Для расчета γ скорость биохимических реакций измеряется через 2., 3., 5. (Δt = 2., 3., 5. и т. д.). Все жизненные процессы идут в узком температурном интервале от 0°С до 45–50°С.
Теория активных соударений. Более точную зависимость константы скорости реакции от температуры дает теория активных соударений С. Аррениуса, предложенная им в 1889 г. В основе этой теории лежит представление о том, что для протекания химической реакции необходимо соударение между молекулами исходных веществ. Но не каждое соударение молекул приводит к химическому превращению: к нему приводит лишь активное соударение.
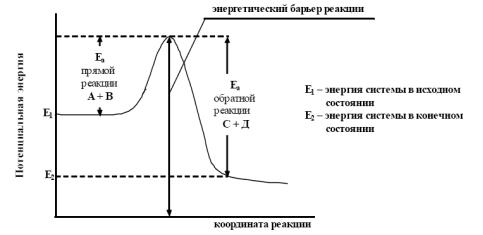
Активные соударения – это соударения, которые происходят, например, между молекулами А и В с большим запасом энергии. Тот минимальный запас энергии, которым должны обладать молекулы исходных веществ для того, чтобы их соударение было активным, называется энергетическим барьером реакции. Наглядное представление об энергетическом барьере реакции дает графическое изображение энергетики химической реакции (рис. 5.). На этой диаграмме в качестве абсциссы используется так называемая координата реакции, которая является сложной функцией межатомных расстояний. По оси ординат откладывается потенциальная энергия всей системы. То дополнительное количество энергии, которое надо добавить к средней энергии молекул исходных веществ, чтобы соударение между молекулами исходных веществ было активным, называется энергией активации (Еа). Чем больше Еа, тем меньше константа скорости и тем значительнее влияет на нее изменение температуры.
рис. 5. Энергетическая диаграмма реакции А+В = С+Д
Константа скорости реакции связана с энергией активации сложной зависимостью, описанной уравнением Аррениуса: k=A·е–Ea/RT, где А – предэкспоненциальный множитель; Еа
— энергия активации, R — универсальная газовая постоянная, равная 8,31 дж/моль–1К–1; Т — абсолютная температура; е — основание натуральных логарифмов. Предэкспоненциальный множитель А характеризует общее число двойных соударений, а также учитывает число соударений с благоприятной ориентацией. Во многих случаях, особенно при реакциях между сложными молекулами, необходимость ориентации может заметно тормозить скорость реакции. Например, чтобы при простом соударении молекулы йода и молекулы водорода образовались две молекулы йодистого водорода надо, чтобы ориентация молекулы была сходна с той, которая изображена на рис. 6.
