
ОСНОВЫ ХИМИЧЕСКОЙ ТЕРМОДИНАМИКИ
.pdfОСНОВЫ ХИМИЧЕСКОЙ ТЕРМОДИНАМИКИ
Вопросы к теме:
1.Термодинамические системы. Стандартное состояние.
2.Термодинамические процессы.
3.Основные понятия термодинамики: внутренняя энергия, работа, теплота.
3.Первое начало термодинамики. Энтальпия.
4.Термохимия.
5.Законы термохимии. Применение первого начала термодинамики к биосистемам.
6.Второе начало термодинамики. Энтропия. Энергия Гиббса, критерии самопроизвольного процесса.
7.Экзэргонические и эндэргонические реакции. Принцип энергетического сопряжения.
8.Задачи.
Термодинамика – это наука, изучающая законы превращения и передачи энергии.
Химическая термодинамика:
- изучает законы превращения энергии, сопровождающие химические процессы, - определяет возможность, направление протекания реакций при различных условиях.
Биоэнергетика (биотермодинамика) изучает превращения энергии в живых организмах. Она позволяет оценить энергетические изменения, происходящие в результате биохимических реакций, рассчитать осмотическое давление по обе стороны полупроницаемой мембраны и многое другое.
1. Термодинамические системы. Стандартное состояние.
Термодинамическая система — это тело или совокупность тел, ограниченных от окружающей среды мысленно или реально существующими границами. Примеры термодинамических систем: газ в сосуде, клетка, растение, орган.
Типы термодинамических систем:
1.Изолированные системы. Такие системы не обмениваются с окружающей средой ни веществом, ни энергией. В природе таких систем нет: это плод научной фантазии.
2.Закрытые системы. Эти системы обмениваются с окружающей средой энергией, но не веществом. Например: электролампочка, герметически закрытый сосуд с теплопроводящими стенками.
3.Открытые системы. Такие системы обмениваются с окружающей средой веществом и энергией. Например: живые организмы.
По составу системы разделяются на гомогенные и гетерогенные. Гомогенные системы однофазные, не имеют поверхности раздела. Все части системы имеют одинаковые химические и физические свойства. Например: воздух (смесь газов), истинные растворы.
Гетерогенные системы многофазные, неоднородные, имеют поверхность раздела. Например: лед в воде, жидкость и пар.
Фаза – это часть системы с одинаковыми физическими и химическими свойствами. Для сравнения свойств термодинамических систем необходимо точно указать их
состояние. С этой целью введено понятие стандартное состояние, за которое для
индивидуальной жидкости или твердого тела принимается такое физическое состояние, в котором они наиболее устойчивы при давлении в 1 атм (101 315 Па) и определенной постоянной температуре Т.
Температура может быть любой постоянной, но чаще всего это 298К. Для твердых веществ наиболее устойчивым состоянием при давлении 101,325 кПа и температуре 298К является кристаллическое, которое и принимается за стандартное. Для газов и паров стандартное состояние – это гипотетическое состояние, в котором газ при давлении в 101,325 кПа подчиняется законам идеальных газов при данной температуре. Величины, которые относятся к стандартному состоянию, пишутся с индексом «0» вверху и температурой внизу. Например: ΔН 0298.
2. Термодинамические процессы.
Любое изменение состояния системы – это термодинамический процесс. В зависимости от условий проведения процесса различают следующие виды процессов:
Круговой или циклический — процесс, в результате протекания которого, система возвращается в исходное состояние. После завершения кругового процесса изменения любой функции состояния системы равны нулю.
Изотермический — процесс, протекающий при постоянной температуре.
Т = const., Т = 0
Изохорный — процесс, при котором объем системы остается постоянным.
V = const., V = 0
Изобарный — процесс, протекающий при постоянном давлении.
Р = const., Р = 0
Адиабатический (адиабатный). Теплообмен с окружающей средой отсутствует.
Q = 0
Если термодинамические параметры состояния системы не изменяются во времени, то такая система находится в состоянии термодинамического равновесия. В зависимости от характера протекания процесса различают два типа термодинамических процессов:
1. Термодинамически обратимые процессы (не путать с кинетическими обратимыми процессами). Это такие процессы, которые можно провести как в прямом, так и в обратном
направлении через одни и те же стадии без каких-либо изменений в окружающей среде. Эти процессы протекают бесконечно медленно через ряд стадий бесконечно близких к равновесным. Например, движение поршня без трения при снятии с него песчинок.
2.Необратимые термодинамические процессы в прямом направлении протекают не так, как в обратном. Необратимые термодинамические процессы оставляют в окружающей среде следы своего протекания. Например, двигатель внутреннего сгорания, процессы жизнедеятельности.
3.Основные понятия термодинамики: внутренняя энергия, работа, теплота.
Все величины, характеризующие то или иное макроскопическое состояние системы, называются термодинамическими параметрами. Различают независимые (основные) и
зависимые термодинамические параметры. Независимые термодинамические параметры можно измерить. Это температура, давление, масса, объем, плотность. Зависимые термодинамические параметры нельзя измерить, так как они зависят от остальных параметров. Например, внутренняя энергия (U) зависит от температуры, концентрации и т. д. Зависимые термодинамические параметры называют функциями состояния системы. Это название введено для того, чтобы отличить свойства системы от таких характеристик процессов (функций процессов), как теплота и работа. Изменение таких параметров зависит только от их значений в начальном и конечном состояниях системы, но не зависит от пути перехода системы из одного состояния в другое.
Энергия. Внутренняя энергия. Количественной мерой движения материи является энергия. Внутренняя энергия системы (U) – это сумма кинетической энергии (Екин.) движения всех частиц системы (молекул, атомов, ионов, электронов и др.) и потенциальной энергии (Епот.) взаимодействия между ними.
U= Екин.+ Епот.
Мы не можем измерить абсолютное значение внутренней энергии какой-либо системы, но можем измерить изменение внутренней энергии (ΔU). Это достаточно для решения многих физико-химических проблем. Единица измерения энергии джоуль или калория
(Дж, кал), 1 Дж = 1 н·м (ньютон·метр); 1 ккал = 1000 кал = 4,184 кДж.
Работа и теплота. Изменение внутренней энергии системы связано с обменом энергией этой системы с окружающей средой. Этот обмен осуществляется в двух формах — либо в форме работы, либо в форме теплоты, либо одновременно. Работа и теплота — это формы передачи энергии от одной системы к другой.
Работа (А) — это форма передачи энергии в виде упорядоченного движения (движение поршня).
Теплота (Q) — форма передачи энергии в виде неупорядоченного движения и взаимодействия молекул при наличии градиента температуры. Если система получает некоторое количество энергии, передаваемое в форме тепла, то Q условно считают положительной величиной; если же система отдает энергию окружающей среде в форме тепла, то Q считают отрицательной величиной.
3. Первое начало термодинамики. Энтальпия.
Между теплотой (Q), работой (А) и изменением внутренней энергии ΔU существует зависимость, которая выражается в виде первого закона термодинамики. Первый закон термодинамики — это частный случай закона сохранения энергии и формулируется закон следующим образом: «если к системе подводится определенное количество энергии в
форме теплоты Q, то часть этой энергии идет на изменение внутренней энергии ΔU, а остальная часть — на совершение работы».
Q = U + А,
где А = р V, р — давление, V — изменение объема системы.
Применение первого закона термодинамики к различным процессам.
1. Изохорный процесс. V = const., V = 0, тогда р V = 0.
В этом случае математическое выражение первого закона термодинамики имеет вид:
Qv = U
где Qv — энергия, сообщаемая системе в изохорном процессе.
Из уравнения следует, что энергия, сообщенная системе в форме теплоты, идет только на приращение внутренней энергии системы. В этом случае Qv не зависит от пути перехода
системы из одного состояния в другое. |
|
2. Изобарный процесс. Р = const., |
Р = 0. |
В случае изобарного процесса Qр = |
U + р V или Qр = U2 – U1 + рV2 – рV1. |
Сгруппируем величины с одинаковыми индексами: Qр = (U2 + рV2) – ( U1 + рV1).
Так как внутренняя энергия, объем системы и давление – функции состояния, то сумма величин (U + рV) также должна быть функцией состояния и ее изменение не зависит от пути перехода системы из одного состояния в другое. Эту функцию состояния называют энтальпией и обозначают символом Н: Н = U + рV.
Из уравнений следует, что Qр = Н, т. е. в изобарном процессе энергия, сообщенная системе в форме теплоты, идет на приращение энтальпии системы. Энтальпия характеризует энергосодержание системы. Если Н < 0, то это экзотермический процесс, и он протекает с
выделением теплоты; если Н > 0, то это эндотермический процесс и он протекает с поглощением теплоты.
3. |
Изотермический процесс. Т = const и U = 0 для такого процесса, тогда Q = А. |
Таким образом, вся сообщенная системе энергия в форме теплоты превращается в |
|
работу. |
|
4. |
Адиабатный процесс. В адиабатном процессе система не обменивается с |
окружающей средой энергией (Q = 0), работа совершается за счет уменьшения внутренней энергии системы: А = – U.
4. Термохимия Термохимия - раздел термодинамики, который изучает энергетические эффекты
химических и физико-химических процессов.
Тепловой эффект реакции — это количество энергии, которое выделяется или поглощается в результате реакции. Величина теплового эффекта зависит от агрегатного состояния исходных и конечных веществ.
Н2(г) + 1/2 О2(г) = Н2О(ж) + 286 кДж/моль; Н2(г) + 1/2 О2(г) = Н2О(г) + 242 кДж/моль.
Стандартный тепловой эффект реакции – тепловой эффект реакции, измеренный при постоянной температуре (298К), постоянном давлении (101,325 кПа) и рассчитанный на один моль продукта реакции.
Термохимическое уравнение — это уравнение реакции со значением теплового эффекта. Существуют две формы записи термохимических уравнений.
1.Н2(г) + 1/2 О2(г) = Н2О(ж) + Q; Q = 286 кДж/моль, где Q — термохимический тепловой эффект реакции, который характеризует энергетические изменения в окружающей среде. Если Q > 0, то в окружающую среду выделяется энергия и процесс экзотермический, если Q < 0, то энергия поглощается из окружающей среды и процесс эндотермический.
2.Н2(г) + 1/2 О2(г) = Н2О(ж); ΔН = −286 кДж/моль,
где ΔН — термодинамический тепловой эффект реакции, который отражает энергетические изменения в системе;
ΔН < 0 – экзотермическая реакция, в системе происходит уменьшение энергии; ΔН > 0 – эндотермическая реакция, в системе происходит увеличение энергии.
Таким образом, Q = –ΔН, то есть термохимический тепловой эффект реакции равен по абсолютной величине термодинамическому тепловому эффекту, но противоположен по знаку.
Так как значения тепловых эффектов в той или иной степени зависят от внешних условий (температуры, давления и др.), то для того, чтобы иметь возможность сравнивать
тепловые эффекты различных реакций термохимические измерения проводят при одинаковых условиях, а именно:
1)в реакции участвуют индивидуальные вещества в их наиболее устойчивых модификациях;
2)концентрации реагентов составляют 1 моль вещества на 1 кг растворителя;
3)температура равна 250С (298 К);
4)давление соответствует 1 атм (760 мм рт. ст.; 101325 Па).
Такие условия называют стандартными.
За стандартное состояние (обозначают верхним индексом 0) принято устойчивое состояние вещества (устойчивая модификация для веществ в конденсированном состоянии; состояние идеального газа для газов), в котором оно существует при давлении 101,3 кПа и данной температуре (обычно 298 К).
Величину теплового эффекта реакции, измеренную при стандартных условиях и взятую с обратным знаком, называют стандартной энтальпией реакции и обозначают Н0.
Стандартной энтальпией образования вещества ( H0обр. ) называют изменение энтальпии реакции образования 1 моль данного вещества из соответствующих простых веществ, взятых в стандартном состоянии при стандартных условиях. Например:
C(тв.) О2(газ) СО2(газ); H0обр. CO2 393,5 кДж/моль.
Уравнение химической реакции, включающее величину теплового эффекта (энтальпии), называется термохимическим уравнением. Термохимические уравнения составляют таким образом, чтобы в качестве продукта всегда образовывался 1 моль вещества, поэтому в таких уравнениях стехиометрические коэффициенты могут быть дробными. Например:
- обычное химическое уравнение:
|
|
2H2 O2 2H2O; |
|
- термохимическое уравнение: |
|
||
H2(газ) |
1 |
O2(газ) H2O(газ); |
Hобр.0 H2O 242 кДж/моль. |
|
2 |
|
|
Величины стандартных энтальпий образования наиболее устойчивых простых веществ считают равными нулю. Например:
H0обр. O2 0;
H0обр. O3 0.
Величины стандартных энтальпий образования веществ это справочный материал. Следует отметить, что различному агрегатному состоянию одного и того же вещества могут
соответствовать различные значения стандартных энтальпий образования. Например:
H0обр. H2O(жидк.) 286 кДж/моль;
H0обр. H2O(газ) 242 кДж/моль.
Стандартной энтальпией сгорания вещества ( H0сгор. ) называется стандартная энтальпия реакции окисления 1 моль данного вещества до конечных продуктов окисления при стандартных условиях. Например:
С6H12O6(тв.) 6O2(газ) 6CO2(газ) 6H2O(жидк.);
H0сгор. С6H12O6 2810 кДж/моль.
Для высших оксидов элементов значения стандартных энтальпий сгорания принимают равными нулю.
Например:
H0сгор. СO2 = 0
5. Законы термохимии. Применение первого начала термодинамики к биосистемам.
Закон Лавуазье – Лапласа: энтальпия образования вещества равна энтальпии разложения вещества, но противоположна по знаку:
ΔНобр = –ΔНразл.
Например, энтальпия образования оксида кальция из металлического кальция и газообразного кислорода равна:
Са(г) + 1/2О2(г) = СаО(г); ΔН = – 636,4 кДж.
Для разложения 1 моль оксида кальция на кальций и кислород необходимо затратить 636,4 кДж:
СаО(г) = Са(т) + 1/2О2(г); ΔН = 636,4 кДж.
Закон Гесса (1840) (основной закон термохимии): теплота химической реакции
зависит только от начального и конечного состояния веществ и не зависит от промежуточных стадий процесса.
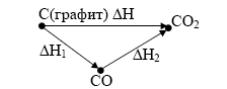
Например превращение графита в СО2 можно отразить следующей схемой:
I) С(т) + О2(г) → СО2(г); ΔН = –393 кДж.
II) С(т) + О=(г) → СО (г); ΔН1 = –110 кДж.
III) СО(г) + О2(г) → СО2(г); ΔН2 = –283 кДж.
Как видно, тепловой эффект первого процесса равен суммарному тепловому эффекту второго и третьего процессов.
Следствия из закона Гесса:
Следствие 1: тепловой эффект реакции равен сумме стандартных энтальпий образования продуктов реакции минус сумма стандартных энтальпий образования исходных веществ с учетом стехиометрических коэффициентов уравнения реакции.
ΔН0реакции = ΣΔН0 обр.прод. – ΣΔН0обр.исх.
Следствие 2: тепловой эффект реакции равен сумме стандартных энтальпий сгорания исходных веществ минус сумма стандартных энтальпий сгорания продуктов реакции с учетом стехиометрических коэффициентов уравнения реакции.
ΔН0реакции = ΣΔН0сг.исх. – ΣΔН0сг.прод.
Значения стандартных энтальпий образования и сгорания различных веществ имеются в справочниках. Эти значения используются для расчета тепловых эффектов различных процессов, в том числе и биохимических реакций.
Используя закон Гесса, можно рассчитать калорийность пищи, потребляемой ежедневно человеком, и дать необходимые рекомендации по составлению диеты в случае нарушения обмена веществ.
Глюкоза, попадая в организм, претерпевает серию сложных превращений. В результате окисления глюкозы, как и большинства питательных веществ, образуются углекислый газ и вода:
С6H12O6(тв.) |
|
6O2(газ) |
|
6CO2(газ) |
|
6H2O(жидк.); |
H0 |
|
|
|
|
р и |
2810 кДж. |
Следовательно, если человек съест 180 г глюкозы (1 моль), то в организме человека в результате окисления 1 моль глюкозы теоретически должно выделиться 2810 кДж (672 ккал) энергии.
Установлено, что при окислении основных питательных веществ выделяются следующие количества теплоты: 1 г. жиров 39,5 кДж, 1 г. углеводов 17,1 кДж, 1 г. белков 22,3 кДж.
Энергетическую потребность человека можно определить, поместив его в калориметр (прибор, исключающий теплообмен с окружающей средой) и измерив количество израсходованной им энергии.
Отдача теплоты человеком в состоянии покоя: 6300-7500 кДж в сутки. Любое движение
организма, любая работа, даже пищеварение, усиливают выделение тепла. Было установлено, что при легкой физической работе человеку необходимо 8400-12000 кДж в сутки, а при тяжелой 16700-20900 кДж в сутки.
Человеку для поддержания термодинамического равновесия требуется количество энергии, равное отдаче тепла. Зная состав отдельных питательных веществ и их энтальпии сгорания, можно рассчитать количество необходимых для питания человека продуктов. При избыточном или нерациональном потреблении питательных веществ часть продуктов не усваивается и откладывается организмом в депо в виде жировой подкожной клетчатки, вызывая ожирение.
6. Второе начало термодинамики. Энтропия. Энергия Гиббса, критерии самопроизвольного процесса
Множество различных процессов, которые идут вокруг нас, могут быть двух видов:
самопроизвольные и несамопроизвольные процессы.
Самопроизвольные процессы протекают без затраты энергии из окружающей среды. Примеры: смешение газов, падение шарика, растворение в воде аммоний нитрата NH4NO3.
Несамопроизвольные процессы протекают с затратой энергии из окружающей среды. Примеры: разделение смеси газов на отдельные газы, движение шарика вверх по наклонной плоскости.
Самопроизвольные процессы ведут к состоянию равновесия в системе (происходит выравнивание температуры, концентрации, давления и т. д.).
Количественной мерой приближения системы к состоянию равновесия является энтропия (S). Энтропия — это мера беспорядка в системе. С увеличением беспорядка в системе энтропия увеличивается. Энтропия увеличивается в ряду S(т) < S(ж) < S(г), т. к. с переходом системы из твердого состояния (т) беспорядок увеличивается. Энтропия является функцией состояния системы и зависит от ее конечного и начального состояния, от температуры и давления в системе.
Изменение энтропии ΔS реакционной системы рассчитывается по формуле:
ΔS0 реакции = Σm S0прод. – Σn S0исх. в-в.,
где S0 — стандартная энтропия образования, m и n — стехиометрические коэффициенты в уравнении реакции. Стандартное значение энтропии (S0) при 298К и давлении 1 атмосфера (атм.) или 101,325 кПа приведены в справочниках.
Согласно второму закону термодинамики самопроизвольно протекает процесс, который сопровождается увеличением энтропии в изолированных системах. Когда
энтропия системы достигает своего максимального значения, то система находится в состоянии термодинамического равновесия.
Математическое выражение второго закона термодинамики: ΔS > 0 — критерий самопроизвольного процесса;
ΔS = 0 — критерий равновесного состояния системы.
Свободная энергия Гиббса (изобарно-изотермический потенциал).
Для изучения открытых и закрытых систем в термодинамике используют так называемые термодинамические потенциалы, к числу которых относится изобарноизотермический потенциал G. Понятие об этом потенциале было введено на основе объединенного уравнения первого и второго закона термодинамики.
Р = const., |
Т = const., |
Q = ΔU + рΔV (1) |
Q = ТΔS (2) |
Значение Q подставляем в уравнение (1), получаем:
ТΔS = ΔU + А (3)
А = рΔV — это работа расширения. Запишем общую работу процесса:
Аобщ. = р ΔV + Апол. (4)
где Апол. — полезная работа, под которой подразумеваются другие виды работ (электрическая, химическая и т. д.). Уравнение (4) подставляем в уравнение (3); получаем:
ТΔS = ΔU + р ΔV + Апол.
Сделаем преобразования:
–А пол. = ΔU + р ΔV – ТΔS;
–А пол. = U2– U1 + рV2 – рV1 – ТS2 + ТS1;
–А пол. = (U2 + р V2 – ТS2) – (U1 + р V1 – ТS1). Известно, что U + pV = Н, где Н — энтальпия.
Тогда мы можем записать: –Апол. = (Н2 – ТS2) – (Н1 – ТS1),
где Н – ТS = G; В конечном итоге Апол. = G2 – G1 = ΔG или Апол. = –ΔG. Величину G называют свободной энергией Гиббса или изобарно-изотермическим
потенциалом. Из выражения Апол. = –ΔG следует: если система самопроизвольно совершает работу (А > 0), то ΔG < 0 т. е. процесс самопроизвольный, если А > 0 или ΔG < 0. Если система не совершает работу, то А = 0 и ΔG = 0, т. е. система находится в состоянии термодинамического равновесия.
Энтальпийный и энтропийный факторы. Выражение для свободной энергии Гиббса можно написать и в другом виде: ΔG = ΔН – ТΔS.
