
ТеорИмба
.pdf
неассоциированная гидроксильная группа будет иметь узкую полосу поглощения в области 3700 − 3580 см-1.
Образование водородных связей приводит к появлению дополнительных полос при более низких частотах (3550 − 3200 см-1) за счет уменьшения интенсивности поглощения «свободной» гидроксильной группы (рисунок 6).
Рис. 6. ИК-спектр 2-бутанола без растворителя и в четыреххлористом углероде
Большой интерес представляет поглощение карбонильной группы. Алифатические альдегиды поглощают в области 1740—1720 см-1. Это поглощение обязательно дублируется полосой валентных колебаний С-Н при 2800 см–1. Насыщенные кетоны имеют полосу поглощения в области 1725—1705 см-1.
Карбоксильная группа обнаруживается в ИК-спектре по валентным и деформационным колебаниям связи О-Н, валентным колебаниям связи С=О и деформационным колебаниям связи С-О.
Карбоновые кислоты вследствие образования водородных связей преимущественно существуют в виде димеров:
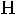 ...
... 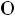
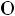 ...
... 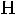

Рис. 7. Структура димера карбоновых кислот.
С этим связано то, что валентные колебания свободной гидроксильной группы (около 3520 см-1) наблюдаются только в очень разбавленных растворах в неполярных растворителях или в газовой фазе.
17

В случае образование димеров, аналогично спиртам, наблюдается уширение полосы валентных колебаний связи О-Н в области 3300-2500 см-1.
Полосы валентных колебаний С=О карбоксильной группы более интенсивны, чем полосы валентных колебаний карбонильной группы кетонов. Мономеры насыщенных алифатических кислот поглощают около 1760см-1. Образование водородных связей смещает поглощение в область более низких частот (1720 − 1706 см-1).
Деформационные колебания связей С-О и О-Н поглощают в области 1320 − 1210 и 1440 − 1396 соответственно. Полоса поглощения деформационного колебания С-О более интенсивна; полоса деформационных колебаний С-О-Н имеет умеренную интенсивность.
Характеристическая полоса в спектрах димеров карбоновых кислот наблюдается в области около 920 см-1 и обусловлена внеплоскостными деформационными колебаниями связи О-Н.
При переводе кислоты в соль происходит исчезновение полос, характерных для ОН-группы и появление интенсивных полос поглощения в области 1680—1610 см–1 и 1400—1300 см–1.
Спектр гексановой кислоты приведен на рисунке 8.
Рис. 8. ИК-спектр гексановой кислоты.
Широкая полоса валентных колебаний О-Н: 3300-2500 см-1; Валентные колебания С-Н: 2967, 2874, 2855 см-1, перекрываются с
широкой полосой валентных колебаний О-Н; 18
Валентное колебание карбоксильной группы С=О, характерное для димерного состояния: 1717 см-1;
Плоскостное деформационное колебание С-О-Н: 1424 см-1;
Валентное колебание С-О в димере: 1301 см-1;
Внеплоскосное деформационное колебание О-Н: 946 см-1.
Амидная группа характеризуется, прежде всего, двумя полосами поглощения – валентных колебаний связи С=О (полоса «Амид I» и деформационными колебаниями связи N-H (полоса «Амид II»). На рис. 9 представлен ИК-спектр амида акриловой кислоты.
Валентные колебания связи C=О (полоса «Амид I») наблюдаются в области 1690 − 1630 см-1 в спектрах разбавленных растворов первичных, вторичных и третичных амидов. Первичные и вторичные амиды часто ассоциированы, вследствие образование межмолекулярной водородной связи. Вследствие этого в твердом состоянии первая амидная полоса может быть смещена на 30-40 см-1 в низкочастотную сторону.
Деформационные колебания связи N-H (полоса «Амид II») первичных амидов проявляются в области 1620 − 1590 см-1. Все первичные амины в разбавленных растворах дают резкую полосу поглощения Амид II, интенсивность которой составляет от половины до одной трети интенсивности полосы поглощения C=О.
Внеплоскостные веерные колебания N-H первичных и вторичных амидов проявляются в виде широкой полосы средней интенсивности в интервале 800 − 670 см-1.
Валентные колебания (симметричные и антисимметричные) связи N-H первичных амидов обуславливают появление двух характеристических полос поглощения около 3520 − 3400 см-1. В случае вторичных амидов, на спектре будет присутствовать только одна полоса, наблюдаемая при 3500 − 3400 см-1 (разбавленные растворы) и 3330 − 3060 см-1 (концентрированные растворы или твердое состояние).
19

Рис. 9. ИК-спектр акриламида.
Валентные колебания N-H антисимметричные 3352 см-1, симметричные 3198 см-1;
Перекрывание валентного колебания С=О и полоса «Амид I»: 1679см-1;
Валентное колебание C-N: 1432 см-1;
Деформационное колебание N-H (полоса «Амид II»): 1617 см-1;
Широкая полоса деформационного внеплоскостного колебания N-H: 700600 см-1.
Для аминогруппы характерны полосы поглощения, обусловленными валентными и деформационными колебаниями связи N-Н и валентными колебаниями С-N
Для первичных и вторичных аминов наиболее характерными являются поглощение области 3300-3500 см–1, обусловленное валентными колебаниями N-H связи. Первичные алифатические и ароматические амины имеют в разбавленных растворах две полосы поглощения ~3500 (отвечающая валентным ассиметричным колебаниям) и ~3400 см-1 (отвечающая валентным симметричным колебаниям). Спектры вторичных аминов имеют одну полосу поглощения N-H связи в этой области. У третичных аминов, не имеющих N-H связи, естественно, нет этой полосы поглощения. Интенсивность полос поглощения валентных колебаний N-H связи значительно ниже интенсивности полос О-H связи, находящихся в той же области спектра. Образование водородных связей в меньшей степени влияет на положение и интенсивность полосы валентных колебаний N-H
20

связи, чем в случае О-H группы, что, возможно, связано с меньшей силой водородных связей в аминах.
Деформационные колебания связи N-H наблюдаются в области 1650 − 1580
см-1.
В ИК-спектрах первичных и вторичных аминов в области 909 − 670 см-1 наблюдается широкая полоса поглощения, связанная с веерными колебаниями связи N-H.
Валентные колебания связей C-N имеют характеристическую полосу около 1070 см-1
На рисунке 10 представлен ИК-спектр 2-метилпентандиамина-1,5.
Рис. 10. ИК-спектр 2-метилпентандиамина-1,5.
Валентные колебания группы N-H антисимметричное 3368 см-1, симметричное 3291 см-1;
Валентные колебания С-Н: 2928, 2859 см-1; Валентные колебания связей C-N: 1069 см-1;
Деформационное колебание N-H (ножничное): 1601 см-1;
Деформационное колебание СH2 ножничное симметричное: 1470 см-1;
Веерное колебание N-H: 900-700 см-1
21

Связь |
Соединение |
Частота, см |
Алканы |
2850-2960 |
Алкены и арены |
3010-3100 |
Алкины |
3300 |
Алканы
600-1500
Алкены
22
Интенсивность и характер полосы
Сильная
Средняя
Сильная
Слабая (обычно валентные колебания С-С связи не используются для идентификации

Алкины |
|
|
|
Нитрилы |
1620-1680 |
Переменная |
|
Спирты |
2100-2260 |
Переменная |
|
Простые эфиры |
2200-2300 |
Переменная |
|
Карбоновые кислоты |
1000-1300 |
Переменная |
|
Сложные эфиры |
1720-1740 |
Сильная |
|
Альдегиды |
|
|
|
Кетоны |
1720-1740 |
Сильная |
|
Карбоновые кислоты |
|
|
|
Сложные эфиры |
1705-1750 |
Сильная |
|
Спирты |
1700-1750 |
Сильная |
|
Фенолы |
|||
|
|
||
Амины |
|
|
|
|
3950-3650 |
Переменная |
|
Амины |
3300-3500 |
Средняя |
|
|
3300-3500 |
Средняя |
23
Для подготовки данного материала была использована следующая литература
1.А. В. Гармаш. Введение в спектроскопические методы анализа. Оптические методы анализа. / Гармаш А. В. [и др.] ; под ред. А. В. Гармаш. – М. : изд-во РАН, 1995. – 39 с.
2.В. И. Лебухов. Физико-химические методы исследования/ Лебухов В. И., Окара А. И., Павлюченкова Л. П. – СПб. : Лань, 2012. – 480 с.
3.В. И. Лебухов, А. И. Окара, Л. П. Павлюченкова. Физико-химические методы исследования. – СПб. : Лань, 2012. – 480 с.
4.Л. В. Левшин. Оптические методы исследования молекулярных систем. Ч. 1. Молекулярная спектроскопия/. Левшин Л. В, Салецкий А. М.– Москва: издво МГУ, 1994. – 320 с.
5.Л. В Левшин, А. М. Салецкий. Оптические методы исследования молекулярных систем. Ч. 1. Молекулярная спектроскопия. – М. : изд-во МГУ, 1994. – 320 с.
6.С. И. Карпов. Физико-химические методы анализа органических соединений: методические указания для ВУЗов. / Карпов С. И., Селеменев В.Ф., Матвева М. В., Беланова Н. А. – Воронеж: издательскополиграфический центр Воронежского государственного университета, 2008.
–94 с.
7.3. Б.Н.Тарасевич. ИК спектры основных классов органических соединений. Справочные материалы. / Тарасевич Б.Н. – Москва: МГУ им. М.В. Ломоносова, 2012. — 54 с.
8.Сильверстейн Р. Спектрометрическая идентификация органических соединений / Сильверстейн Р., Вебстерн Ф.,. Кимл Д - Москва: Бином, 2012.
–558 с.
9.Е.А. Краснокутская. Спектральные методы исследования в органической химии: Учебное пособие. Часть 1. Электронная и инфракрасная спектроскопия/ Краснокутская Е.А., Филимонов В.Д.- Томск: Томский политехнический университет, 2012. - 56 с.
24
Молекулярная абсорбционная спектроскопия в видимой и УФ-областях ЭМИ
Как вы помните, основой всех спектральных методов анализа является взаимодействие света с электромагнитным излучением.
Спектр ЭМИ с длинами волн от 1·10-11 до 3·1010 см условно разбит на несколько областей:
1.Крайний УФ диапазон: 1–10 нм
2.Дальнее УФ излучение: 10– 200 нм
3.Ближнее УФ излучение: 200– 400 нм
4.Видимый свет: 400–780 нм
5.Ближний ИК диапазон: 780–2,5*103 нм
6.Среднее ИК излучение: 2,5–50 мкм
7.Дальнее ИК излучение: 50–1000 мкм
Впрошлой лекции рассматривалось взаимодействие с веществом инфракрасного излучения. В этой лекции мы рассмотрим видимую и УФ-области ЭМИ. Спектроскопия видимой и УФ-областей является абсорбционным методом анализа то, есть основана на измерение энергии поглощенной веществом.
Поглощение обычно измеряют косвенно, то есть путем сравнения интенсивностей света падающего на образец и прошедшего сквозь него. Изучение взаимодействия ЭМИ излучения с веществом, чаще всего проводят в растворах, при этом изменение интенсивности светового потока при прохождении его через образец может быть вызвано не только светопоглощением определяемого вещества, но и светопоглощением растворителя, а также светорассеянием и отражением. Чтобы исключить влияние светорассеяния раствор должен быть прозрачным. Чтобы исключить влияние оказываемое поглощением ЭМИ растворителем, используют раствор сравнения, которым обычно является чистый растворитель.
Как известно, внутренняя энергия молекулы складывается из трех основных составляющих:
Е = Еэл + Екол + Евр Где: Еэл - энергии движения электронов, Екол - энергии колебаний атомов
молекулы, Евр - энергии вращения молекулы.
1
Если при поглощении веществом ИК-излучения происходят изменения энергии колебаний и вращений атомов молекулы, то при поглощении излучения в видимой и УФ областях спектра происходит изменение электронной составляющей общей энергии. Поэтому далее мы будем рассматривать энергию движения электронов. Если излучение определенной длины волны проходит через вещество и не поглощается им, то энергическое состояние молекулы остается без изменения. Если же излучение поглощается, то молекулы вещества переходят из энергетического состояния с меньшей энергией (Е1) в энергетическое состояние, характеризующееся большей энергией (Е2). Этот процесс сопровождается поглощением кванта света.
|
|
|
|
|
|
c |
- |
|
DE = E |
2 |
- E = h ×n = h × |
= h ×c ×n |
|||||
|
||||||||
|
1 |
|
|
|
l |
|
||
|
|
|
|
|
|
|
||
|
|
- |
= |
1 |
|
|
|
|
|
|
n |
|
|
|
|||
|
|
l |
|
|||||
|
|
|
|
|
||||
Изучая поглощение веществом излучения различных длин волн в видимой и УФ областях спектра можно получить электронный спектр поглощения этого вещества.
Для каждого поглощающего вещества имеется определенное распределение интенсивности поглощения по длинам волн, при этом на кривой поглощения имеются один или несколько максимумов. Область интенсивного поглощения называется полосой поглощения.
Спектрофотометрический метод анализа основан на поглощении монохроматического излучения, то есть излучения с одной длиной волны в интервале видимого и УФ излучения.
Фотоколориметрический метод анализа основан на поглощении полихроматического (немонохроматического) излучения, то есть пучка лучей с близкими длинами волны в видимой области спектра. Фотоколориметрию используют в основном для анализа окрашенных растворов.
Оба метода основаны на общем принципе — пропорциональной зависимости между светопоглощением и концентрацией определяемых веществ.
2
