
книги / 829
.pdf
где R1, R2, R3 – углеводородные радикалы жирных кислот, R – алкильный радикал спирта.
Более высокая скорость реакции переэтерификации отмечается
вусловиях основного катализа и ниже – в условиях кислотного, однако на выбор катализатора влияют и другие факторы. Так, в условиях основного катализа исходное масло не должно содержать свободных жирных кислот. По этому показателю отработанное подсолнечное масло (образец МПО) не соответствует требованиям технологии, использующей основной катализ, и для его переработки была выбрана технология с кислотным катализом. Содержание свободных жирных кислот строго регламентируется также и в составе биодизеля (не более
0,8 мг КОН/г по ATSM D 6751 [5]).
Выбор условий осуществления кислотного катализа был проведен с учетом литературных данных для процессов переработки обычных (не подвергнутых термической обработке) масел [15]. В качестве
катализатора использована H2SO4 (1 мол.%). Остатки ее легко удаляются из продуктов взаимодействия в форме CaSO4 (гипс). Для получения моноалкильных эфиров использовали этанол при соотношении масло:спирт, равном 1:30. Процесс проводили в реакторе при температуре 78 °С, скорость вращения мешалки 100 об/мин. Кинетические кривые, характеризующие изменение концентрации этиловых эфиров жирных кислот (С) в зависимости от времени взаимодействия (τ) для образцов МПП и МПО, приведены на рис. 1.
Обращает на себя внимание увеличение выхода этиловых эфиров жирных кислот при взаимодействии с этанолом образца МПО по сравнению с образцом МПП. Это можно объяснить тем, что в образце МПО содержатся свободные кислоты, которые способны участвовать
вреакции этерификации в условиях кислотного катализа [16]:
21

,
где R – углеводородный радикал жирной кислоты.
Рис. 1. Зависимости С от τ для образцов МПП (1) и МПО (2)
Реакция переэтерификации при этом не ингибируется.
Низкая скорость реакции переэтерификации обусловлена, в частности, плохой смешиваемостью спиртов с маслом [6]. Поэтому для интенсификации процесса взаимодействия было применено механическое перемешивание фаз. Результаты эксперимента, выражающие зависимость концентрации этиловых эфиров жирных кислот (С) от времени взаимодействия (τ) при разных скоростях вращения мешалки (ν), приведены на рис. 2.
Выход реакции переэтерификации возрастает при перемешивании взаимодействующих фаз этанола и масла, при этом увеличение скорости вращения мешалки в диапазоне 0–500 об/мин повышает концентрацию этиловых эфиров жирных кислот. Однако дальнейший рост скорости вращения мешалки (700 об/мин и выше) последовательно уменьшает выход реакции. Такой результат можно объяснить накоплением в системе дополнительных фаз – продуктов реакции, и в этих условиях происходит эмульгирование перемешивающихся фаз [6], которое порождает образование новых границ раздела фаз.
На рис. 3 приведен состав по жирным кислотам продуктов реакции переэтерификации образцов подсолнечного МПП и МПО.
22

Рис. 2. Зависимость С от τ (1–5) и С от ν (6). Скорость вращения мешалки ν, об/мин: 0 (без перемешивания) (3); 100 (2); 500 (1), 700 (4) и 900 (5)
Рис. 3. Состав по жирным кислотам продуктов переэтерификации образцов подсолнечного масла МПП (А) и МПО (Б). Этиловые эфиры жирных кислот: пальмитиновой (1), стеариновой(2), олеиновой(3), линолевой(4)
23
Количественные данные, характеризующие состав этиловых эфиров жирных кислот, достаточно близок для образцов подсолнечного масла МПП и МПО. Так, содержание линолевой кислоты составляет соответственно 6,31 и 6,50 мг/мл, олеиновой – 2,48 и 2,87 мг/мл, стеариновой – 0,28 и 0,31 мг/мл, пальмитиновой – 0,79 и 0,98 мг/мл.
В результате исследования установлено, что наличие в составе отработанных масел свободных жирных кислот определяет выбор кислотного катализатора. Выход этиловых эфиров жирных кислот повышается при перемешивании фаз, но увеличение скорости вращения мешалки выше 500 об/мин приводит к эмульгированию в жидкой фазе и понижению выхода продукта. Получение биодизеля на основе подсолнечного масла реализовано неоднократно [2, 4, 15]. Близость состава эфиров, полученных на основе образцов МПП и МПО, свидетельствует в пользу того, что отработанное подсолнечное масло может рассматриваться как сырье для получения биодизеля.
Список литературы
1. Hobbein B.E., Stefen J.D., Layzell D.B. Canadian Biodiesel Initiative. Final Report / Biocap: Canada, Kingstone, Ontario, 2004.
2.Звонов В.А., Козлов А.В., Теренченко А.С. Исследование эффективности применения в дизельных двигателях топливных смесей
ибиотоплив // Рос. хим. журн. 2008. №6. С. 147–151.
3.Брагинский О.Б. Альтернативные моторные топлива: мировые тенденции и выбор для России // Рос. хим. журн. 2008. №6. С. 137–146.
4.Demirbas A. Biodiesel production via non-catalytic SCF method and biodiesel characteristics // Energy Conversion and Management. 2006. V. 47. P. 2271–2282.
5.Yuan X. Optimization of conversion of waste rapeseed oil with high FFA to biodiesel using response surface methodology // Renew Energy. 2007, doi: 10.1016/j.renene. 2007.09.007
6.Encinar J.M., Gonzalez J.F., Rodriguez-Reinares A. Ethanolysis of used frying oil. Biodiesel preparation and characterization // Fuel Processing Technology. 2007. V. 88. P. 513–522.
7.Knothe G., Steidley K.R. Lubricity of Components of Biodiesel and Petrodiesel. The origin of Biodiesel Lubricity // Energy and Fuels. 2005. V. 19. P. 1192–1200.
8.Lang X. Preparation and Evalution of Vegetable Oil Derived Biodiesel Esters as Lubricity Additives // Tribo Test. 2001. P. 131–150.
24
9.Lacey P.I., Westbrook S.R. Lubricity Requirement of Low Sulfur Diesel Fuels // SAE Tech. Pap Ser. 1995. 950248
10.Mittelbach M., Enzelsberger H. Transesterification of Heated
Rapseed oil for Extending Diesel Fuel // J. Am. Oil Chem. Soc. 1999. V. 76. №5. Р. 545–550.
11.Kulkarni M.G., Dalai A.K. Waste Cooking Oil – An Economical Source for Biodiesel: A Review // Ind. Eng. Chem. Res. 2006. V. 45. P. 2901–2913.
12.Nawar W.W. Chemical changes in Lipids Produced by Thermal Processing // J. Chem. End. 1984. V. 61. №4. P. 299–302.
13.Bastida S., Sanchez-Maniz F.J. Thermal Oxidation of Olive Oil,
Sunflower Oil and a Mix of Both Oils during Forty Discontinuous Domestic Fryings of Different Foods // Food Sci.Technol. Int. 2001. V. 7. №1. P. 15–21.
14.Canakci M., Scinli H. Biodiesel production from various feedstocks and their effects on the fuel properties // J. Ind. Microbial Biotechnol. 2008. V. 35. P. 431–441.
15.Marchetti J.M., Miguel V.U., Errazu A.F. Possible methods of biodiesel production // Renewable and Sustainable Energy Rewiews. 2007. V. 11. P. 1330–1311.
16.Sharma Y.C., Singh B., Upadnyay S.N. Advancements in development and characterization of biodiesel: A rewiew // Fuel. 2008. V. 87. P. 2355–2373.
Получено 17.06.2009
УДК 663.15
А.И. Нечаев, В.В. Вольхин
Пермский государственный технический университет
ВЫБОР И КУЛЬТИВИРОВАНИЕ МИКРООРГАНИЗМОВ, СПОСОБНЫХ ПРОИЗВОДИТЬ БУТАНОЛ МЕТОДОМ АНАЭРОБНОГО БРОЖЕНИЯ
Выбраны микроорганизмы – представители рода Clostridium, способные в условиях анаэробного брожения осуществлять трансформацию глюкозы в бутанол, этанол и ацетон. Подобраны условия, обеспечивающие получение преимущественно бутанола.
Одним из наиболее перспективных типов альтернативных моторных топлив являются спирты [1, 2]. Из их числа лидером по производству и потреблению остается биоэтанол [3]. Однако наряду со многими ценными свойствами этанол обладает существенными недостатками: глубоко обезвоженный этанол, используемый в смесях с бензином в качестве топлива в двигателях внутреннего сгорания, проявляет повышенную гигроскопичность и вновь легко насыщается влагой из воздуха, что приводит в конечном итоге к расслоению топливных смесей [4]. По этой причине, например, не удается транспортировать биоэтанол по трубопроводам, а смешение этанола с бензином требует специальных устройств, которые приходится дополнительно устанавливать на заправочных станциях.
Бутанолу, в отличие от этанола, не свойственны указанные недостатки. Он значительно менее гигроскопичен, легко и в более широких пределах по составу смешивается с бензином [5]. Для транспортировки, хранения и заправки транспортных средств смесями бутанола и бензина вполне пригодна существующая инфраструктура. Поэтому интерес к производству биобутанола резко возрастает преимущественно в последний период. Особое внимание этому виду топлива для транспортных средств уделяют корпорация DuPond и компания British Petroleum. Вместе с тем трудности возникли с технологией производства биобутанола, которая остается на стадии разработки [5]. Результаты зависят от выбора вида сырья, микроорганизмов для процесса ферментации, режима проведения всех стадий процесса.
26
Данное исследование посвящено выбору микроорганизмов, выделенных из местных источников, которые способны производить бутанол из растительного сырья, определению условий их культивирования и функционирования в процессе ферментации. В соответствии с ранее накопленным опытом [6, 7], процесс ферментации осуществляли в анаэробных условиях.
Методики эксперимента. Выделение накопительной культуры, способной в ходе процесса жизнедеятельности производить бутанол, осуществлено из нескольких источников: речной активный ил, активный ил очистных сооружений (анаэробная зона аэротенка) и неперепревший навоз. Культивирование микроорганизмов проводили при 37 °С в анаэробных условиях, использовали две питательные среды (№ 3 и 4). Состав среды №3 (г/л): глюкоза – 10,0; пептон – 10,0; К2НРО4 – 1,0; СаСО3 – 3,0 – 5,0; вода водопроводная. Среду стерилизовали в автоклаве при 121 °С (Ризб = 1 атм) в течение 1 ч. Состав среды №4 (г/л): КH2PO4 – 0,5, К2HPO4 – 0,5, MgSO4 – 0,5, NaCl – 0,5, CaCO3 –
10, глюкоза – 20, пептон – 5, pH 7. Стерилизация среды проведена в автоклаве в тех же условиях, которые приняты для среды №3.
Селекцию микроорганизмов выполняли в жидкой среде, из которой предварительно путем кипячения был удален кислород. Жидкую среду изолировали от воздуха слоем вазелинового масла [8, 9]. По результатам исследования выбор был сделан в пользу среды №4. Все дальнейшие исследования проводили при культивировании в анаэростате в атмосфере CO2. После внесения инокулята среду пастеризовали на водяной бане (с кипящей водой) в течение 45 с [8]. Источником углерода в обеих средах является глюкоза. Выбор глюкозы в качестве углеродсодержащего объекта для изучения стадий ферментации является традиционным [7,10].
Для определения динамики роста микроорганизмов была использована зависимость оптической плотности клеточной суспензии от количества клеток бактерий, накопившихся в ней за определенный период. Величину светорассеяния измеряли с помощью фотоэлектрокалориметра ФЭК АР-101. Светофильтр рассчитан на длину волны 540 нм. Принцип работы и порядок измерения в микробиологическом эксперименте ничем не отличается от измерения оптической плотности растворов [11]. Измерение оптической плотности клеточной суспензии проводили в течение 50 ч до момента, пока культура не вышла на стадию отмирания. В качестве нулевой пробы была взята стерильная сре-
27

да до внесения инокулята. Пробы для определения оптической плотности отбирали в стерильных условиях и после каждого отбора пробы анаэростат с культурой продували газообразным СО2.
Значения рН среды измеряли с помощью иономера И-160. Для качественного и количественного анализа органических компонентов среды, в том числе продуктов, образующихся в результате ферментации, использован газовый хроматограф «Хроматек Кристалл 5000.2», детектор – пламенно-ионизационный (230 °С), колонка HP-FFAP 50 м × 0,32 мм, температурный режим – 77–180 °С, температура испарителя 190 °С. В качестве газа носителя применялся гелий. Количество вводимой пробы – 1 мкл. Продолжительность анализа – 20 мин [12]. Для идентификации компонентов среды при газохроматографическом анализе использовали метод добавки.
В ходе пробоподготовки (отделение анализируемой среды от биомассы) использовали центрифугу MiniSpin (Eppendorf). Режим центрифугирования: скорость центрифугирования – 11,5 тыс.об/мин, продолжительность – 15 мин.
Результаты и их обсуждение. Выделенные микроорганизмы исследовали микроскопическим методом (рис. 1).
Рис. 1. Микрофотографии микроорганизмов: а – увеличение микроскопом ×1000; б – увеличение микроскопом ×1000 и фотоаппаратом ×3
По морфологическим отличиям микроорганизмов [11] и с учетом литературных данных по условиям селекции [7, 10] выделенную культуру отнесли к роду Clostridium. Палочковидные бактерии этого рода являются облигатно анаэробными, грамположительными, образующими терморезистентные эндоспоры. Микроорганизмы, отобранные для исследования из различных источников, видимых отличий в скорости роста и морфологии не показали.
28
Бактерии рода Clostridium представлены в природе несколькими видами. Для производства бутанола наиболее приемлема группа мезо-
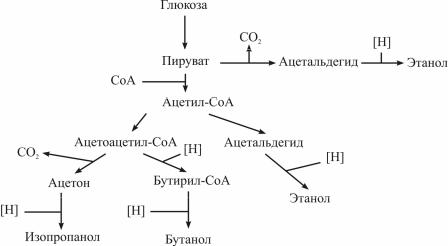
филов – C.acetobutylicum и С.beijerinckii [10]. Зависимости от рН среды ферментация глюкозы с помощью C.acetobutylicum приводит к разным продуктам: при рН > 5,6 главными продуктами являются ацетат, бутират, Н2 и CO2 [13]. При низких рН основными продуктами брожения становятся бутанол, этанол и ацетон [10]. Общая биохимическая схема анаэробного расщепления глюкозы представлена на рис. 2 [10].
Рис. 2. Биохимическая схема анаэробного расщепления глюкозы при низких рН
Расщепление глюкозы происходит по реакции внутримолекулярной дисмутации с участием углеродных атомов, образуется пируват. Возможно частичное декарбоксилирование пирувата и образование ацетальдегида с последующим его восстановлением до этанола. В качестве восстановителя формально указан атомарный водород, что соответствует, например, сопряженной паре реакций СО→СО2 и Н2→2Н [6]. На самом деле восстановителем биосубстратов выступает восстановленная форма НАДФ·Н+ [14].
При участии кофермента А, HSCoA формируется основное направление трансформации пирувата. Производные кофермента А – тиоэфиры карбоновых кислот. В тиоэфирах атом углерода имеет высокий частичный положительный заряд δ+ и соответственно высокую электрофильность, что облегчает нуклеофильное замещение у этого атома. Кофермент А легко присоединяет ацильную группу, и она при этом настолько активизируется, что легко участвует в образовании
29

связей С–С в биосубстратах [14]. Удвоение числа атомов углерода в молекуле отражает уравнение реакции:
Образуется комплекс ацетоацетилкофермент А. При недостатке восстановителя комплекс распадается с образованием ацетоуксусной кислоты, которая самопроизвольно декарбоксилируется, превращаясь в ацетон. Однако в среде с хорошо выраженными восстановительными свойствами формируется комплекс – СН3СН2СН2CO-SCoA (бутирилСоА), в котором бутирил (анион) восстанавливается до бутанола и последний выделяется из состава комплекса и переходит в раствор.
Таким образом, для повышения выхода бутанола в процессе анаэробного брожения необходима среда с хорошо выраженными восстановительными свойствами.
Задача последующих экспериментов заключалась в исследовании кинетики роста культуры с учетом рН среды и определении целевых продуктов брожения, к которым относится бутанол.
Для исследования кинетики роста культуры была построена зависимость изменения оптической плотности культуральной жидкости (D) от времени культивирования (τ). График, выражающий эту зависимость, построен в полулогарифмических координатах lnD = f(τ) (рис. 3).
Рис. 3. Зависимость lnD = f(τ)
30
