
Лисачук Л. Н. Основные понятия и законы химии. Растворы
.pdf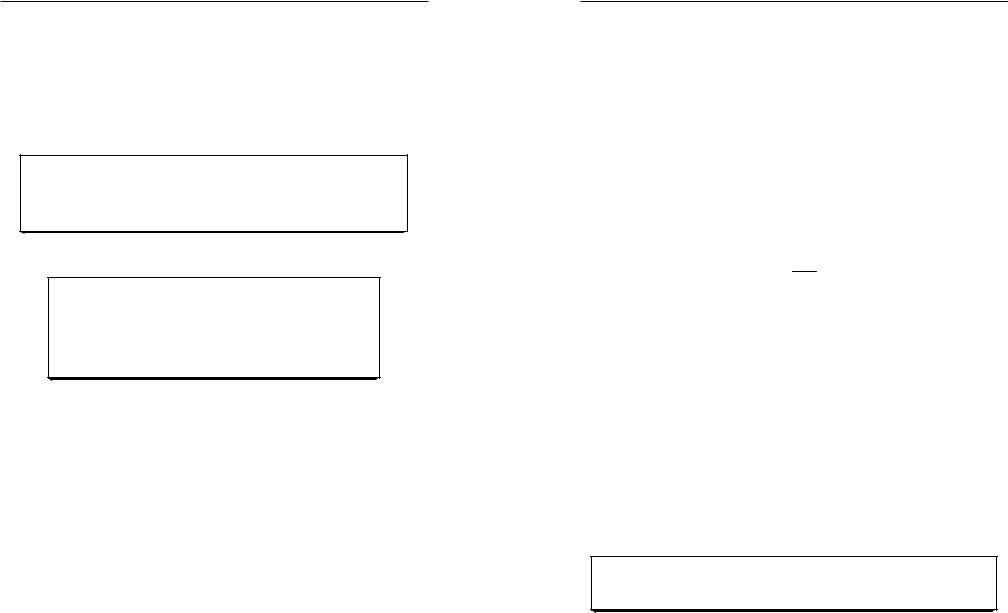
Количество вещества. Моль. Молярная масса
7.1.КОЛИЧЕСТВО ВЕЩЕСТВА. МОЛЬ
Вхимии используют физическую величину – количе-
ство вещества.
Количество вещества обозначают символом n или ν
(«ню»).
Количество вещества – это физическая величина, которая определяет число структурных частиц вещества (молекул, атомов, ионов или других частиц).
Единица количества вещества – моль.
Моль – это количество вещества (порция вещества), которое содержит столько структурных частиц, сколько содержится атомов в 12 г (в двенадцати граммах) углерода.
В 12 г углерода содержится 6,02 1023 атомов. Следова-
тельно, моль любого вещества также содержит 6,02 1023 структурных частиц.
Например:
моль воды содержит 6,02 1023 молекул воды;
моль водорода содержит 6,02 1023 молекул водорода;
моль атомов водородасодержит 6,02 1023 атомовводорода. Число структурных частиц, которое содержит 1 моль
любого вещества, называют постоянной Авогадро ( N A ).
Количество вещества. Моль. Молярная масса
|
N A = |
N |
, |
(1) |
|
|
|||
|
|
ν |
|
|
где N – |
число структурных частиц; |
|
||
ν – |
количество вещества, моль. |
|
||
Если 1 моль вещества содержит 6,02 1023 частиц, то
N A |
= |
6,02 1023 |
= 6,02 1023 моль−1 . |
|
1 моль |
||||
|
|
|
Количество вещества можно вычислить из формулы (1):
ν = N .
N A
7.2.МОЛЯРНАЯ МАССА
Вхимии и физике применяется физическая величина – молярная масса. Молярную массу обозначают символом M .
|
M = |
m |
, |
|
ν |
||
|
|
|
|
где m – |
масса вещества, кг; |
|
|
ν – |
количество вещества, моль. |
||
Следовательно, |
|
||
Молярная масса – это физическая величина, которая равна отношению массы вещества к количеству вещества.
Единицы молярной массы – килограмм на моль
41 |
42 |

Количество вещества. Моль. Молярная масса
(кг/моль) или грамм на моль (г/моль).
Молярная масса характеризует массу одного моля вещества.
Числовое значение молярной массы равно числовому значению относительной молекулярной массы.
Значит, чтобы определить молярную массу вещества, нужно:
определить по формуле вещества значение относительной молекулярной массы;
к результату написать единицы молярной массы. Например, молярную массу BaSO4 вычисляют так:
M r (BaSO4 )=Ar (Ba)+ Ar (S)+4 Ar (O)=137 +32 +4 16=233 .
Тогда M (BaSO4 )= 233 г/моль. Это значит, что масса BaSO4 количеством вещества один моль равна 233 г.
Молярная масса – это важная и постоянная характеристика каждого вещества. Она выражает зависимость между массой и количеством вещества. Поэтому по формуле
M = νm можно определить любую из величин, если извест-
ны две остальные.
ВЫЧИСЛЕНИЯ С ИСПОЛЬЗОВАНИЕМ ПОНЯТИЯ «МОЛЬ»
ПРИМЕР 1. Сколько молекул содержит кислород количеством вещества 0,6 моль?
43
Количество вещества. Моль. Молярная масса
Дано: |
|
|
|
|
РЕШЕНИЕ |
ν(O2 )= 0,6 моль |
|
Первый метод |
|||
|
|
|
|
|
|
N (O2 )= ? |
|
При |
решении задачи используем |
||
|
|
|
формулу |
||
|
|
|
|||
|
|
|
ν = |
N (O2 ) |
. |
|
|
|
|
||
|
|
|
|
N Α |
|
Отсюда N (O2 )=ν N A |
= 0,6 моль 6,02 1023 моль−1 = |
||||
= 3,6 1023 |
молекул. |
|
|
||
ОТВЕТ: |
кислород количеством вещества 0,6 моль содержит |
||||
3,6 1023 |
молекул. |
|
|
||
Второй метод
Составляем пропорцию и решаем её:
|
1 моль |
O |
2 |
содержит 6,02 1023 молекул, |
||||||
|
0,6 моль O |
2 |
содержит |
х |
молекул. |
|||||
|
|
1 |
= |
|
6,02 1023 |
|
|
|||
Значит, |
|
|
|
|
|
. |
Отсюда |
|||
0,6 |
|
|
|
|||||||
|
|
|
|
|
x |
|
|
|||
|
|
x = 0,6 6,02 1023 = 3,6 1023 |
молекул. |
|||||||
ОТВЕТ: |
кислород количеством вещества 0,6 моль содержит |
|||||||||
3,6 1023 |
молекул. |
|
|
|
|
|
|
|
||
ПРИМЕР 2. Какое количество вещества составляют
18 1023 атомов меди?
44

Количество вещества. Моль. Молярная масса
Дано: |
|
|
|
|
|
|
|
|
|
|
|
|
|
РЕШЕНИЕ |
|
|
|||||
N (Cu)=18 1023 атомов |
|
|
|
|
|
Первый метод |
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
Количество |
вещества |
атомов |
||||||||
ν (Cu)= ? |
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
меди вычисляем по формуле |
|||||||||
|
|
|
|
|
N (Cu) |
||||||||||||||||
ν = |
N |
. |
ν = |
= |
|
18 1023 |
≈ 3 моль. |
||||||||||||||
N A |
|
NA |
|
|
|
1023 |
моль−1 |
||||||||||||||
|
|
|
|
|
|
|
6,02 |
|
|
|
|||||||||||
ОТВЕТ: |
18 1023 |
атомов меди составляют 3 моль. |
|
|
|||||||||||||||||
|
|
|
|
|
Второй метод |
|
|
|
|
|
|
||||||||||
Составляем пропорцию и решаем её: |
|
|
|
||||||||||||||||||
6,02 1023 атомов составляют |
1 моль атомов меди, |
||||||||||||||||||||
18 1023 атомов составляют |
х моль атомов меди. |
||||||||||||||||||||
Значит, |
6,02 |
1023 |
|
= |
|
1 |
|
. |
Отсюда x = |
|
18 1023 |
= 3 моль. |
|||||||||
18 |
1023 |
|
|
x |
6,02 1023 |
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
ОТВЕТ: |
18 1023 |
атомов меди составляют 3 моль. |
|
|
|||||||||||||||||
ПРИМЕР 3. Вычислить массу сульфата магния MgSO4 |
|||||||||||||||||||||
количеством вещества 0,25 моль. |
|
|
|
|
|
|
|
|
|||||||||||||
Дано: |
|
|
|
|
|
|
|
|
|
|
|
|
|
РЕШЕНИЕ |
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
ν(MgSO4 )= 0,25 моль |
|
|
|
|
|
|
|
|
Первый метод |
|
|||||||||||
m (MgSO4 )= ? |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
m |
|
|
|
|
||
|
|
|
|
|
|
|
Поскольку M = ν , то m |
= M ν. |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||
M r (MgSO4 )=Ar (Mg)+Ar (S)+4 Ar (O)=24 +32 +4 16 =120;
Количество вещества. Моль. Молярная масса
M (MgSO4 )=120 г/моль.
Подставляем значения в формулу для массы: m (MgSO4 )=120 г/моль 0,25 моль = 30 г.
ОТВЕТ: масса MgSO4 равна 30 г.
Второй метод
M r (MgSO4 )=Ar (Mg)+Ar (S)+4 Ar (O)=24 +32 +4 16=120;
|
|
|
M (MgSO4 )=120 г/моль. |
|
|||||
Составляем пропорцию и решаем её: |
|
||||||||
|
1 моль |
MgSO4 |
– 120 г MgSO4 , |
|
|||||
|
0,25 моль |
MgSO4 |
– х г |
MgSO4 . |
|
||||
Значит, |
1 |
= |
120 |
. Отсюда x = |
0,25 |
моль 120 г |
= 30 г . |
||
0,25 |
|
|
1 моль |
||||||
|
|
x |
|
|
|
|
|||
ОТВЕТ: масса MgSO4 |
равна 30 г. |
|
|
||||||
ПРИМЕР 4. Сколько молей составляет сульфат магния
MgSO4 массой 48 г?
Дано: |
|
|
|
РЕШЕНИЕ |
|
|
m (MgSO4 )= 48 г |
|
|
Первый метод |
|
|
|
|
|
|
|
|
|
|
ν(MgSO4 )= ? |
|
M = |
m |
, отсюда ν = |
m |
|
|
ν |
M . |
||||
|
|
|||||
M r (MgSO4 )= 24 + 32 + 4 16 =120 . |
|
|
||||
|
M (MgSO4 )=120 |
г/моль. |
|
|
||
45 |
46 |
Количество вещества. Моль. Молярная масса
Подставляем значения вформулу для количества вещества:
ν = m = 48 г = 0,4 моль.
M 120 г/моль
ОТВЕТ: 48 г MgSO4 составляют 0,4 моль.
Второй метод
M r (MgSO4 )= 24 + 32 + 4 16 =120 ;
M (MgSO4 )=120 г/моль.
Составляем пропорцию и решаем ее:
120 г MgSO4 составляют 1 моль MgSO4 , 48 г MgSO4 составляют х моль MgSO4 .
Следовательно, 12048 = 1x . Тогда x = 112048 = 0,4 моль.
ОТВЕТ: 48 г MgSO4 составляют 0,4 моль.
ЛЕКСИКА ТЕМЫ
Русский язык |
Английский язык |
Французский язык |
|
|
|
1 |
2 |
3 |
|
|
|
Важный |
important |
important |
|
|
|
Выражать |
to express |
exprimer |
|
|
|
Зависимость |
dependence |
dépendance |
|
|
|
Ион |
ion |
ion |
|
|
|
Использование |
using |
utilisation |
|
|
|
Моль (м.р.) |
mole, mol |
mole |
|
|
|
|
|
47 |
Количество вещества. Моль. Молярная масса
1 |
2 |
3 |
|
|
|
Молярный |
molar |
molar |
|
|
|
Порция |
portion |
portion |
|
|
|
Постоянный |
constant |
constant |
|
|
|
Следовательно |
therefore |
donc |
|
|
|
Следовать |
to follow |
suivre |
|
|
|
Составлять |
to compose, compile |
faire |
|
|
|
Структурная |
structural particle |
particule |
частица |
|
structurale |
Структурный |
structural |
structural |
|
|
|
Физическая |
physical value |
grandeur physique |
величина |
|
|
Характеризовать |
to characterize |
caractériser |
|
|
|
Характеристика |
characteristic |
caractéristique |
|
|
|
|
|
|
ЗАПОМНИТЕ КОНСТРУКЦИИ |
|
1. |
Значит |
= |
из этого следует = следовательно |
|
2. |
Чтобы + |
Инфинитив … , нужно + |
Инфинитив |
|
|
Чтобы |
определить молярную массу |
вещества, нужно |
|
определить относительную молекулярную массу и к результату написать единицы молярной массы.
КОНТРОЛЬНЫЕ ВОПРОСЫ И ЗАДАНИЯ
ЗАДАНИЕ 1. Ответьте на вопросы. 1. Что такое количество вещества?
48

Количество вещества. Моль. Молярная масса
2.Какие структурные частицы вещества вы знаете?
3.В каких единицах выражают количество вещества?
4.Что такое моль?
5.Моль различных веществ содержит одинаковое или разное число молекул?
6.Что такое молярная масса?
7.В каких единицах выражают молярную массу?
8.Чему равно числовое значение молярной массы вещества?
9.Как определить молярную массу вещества?
|
ЗАДАНИЕ 2. Определите молярные массы веществ: |
||
1) |
Na 2 CrO4 ; 2) Fe(OH)3 ; 3) H 2SiO3 ; 4) Zn(OH)2 ; 5) AlPO4 ; |
||
6) |
MgBr2 ; 7) Pb(NO3 )2 ; 8) Fe2 (SO4 )3 ; 9) (NH 4 )2 SO4 . |
||
ОТВЕТ: |
1) 162; 2) 107; 3) 78; 4) 99; 5) 122; 6) 184; 7) 331; |
||
8) 400; |
9) 132. |
|
|
|
ЗАДАНИЕ 3. Вычислите массу: |
||
а) |
сульфата калия K 2SO4 |
количеством вещества 0,7 моль; |
|
б) гидроксида алюминия |
Al(OH)3 количеством вещества |
||
|
0,7 моль; |
|
|
в) |
нитрата бария Ba(NO3 )2 количеством вещества 0,3 моль. |
||
ОТВЕТ: |
а) 121,8 г; б) 54,6 г; в) 78,3 г. |
||
|
ЗАДАНИЕ 4. Определите, сколько молей составляет: |
||
а) |
серная кислота H 2SO4 |
массой 88,2 г; |
|
б) |
вода H2O массой 0,9 кг; |
||
Количество вещества. Моль. Молярная масса
в) карбонат кальция CaCO3 массой 47 г.
ОТВЕТ: а) 0,9 моль; б) 50 моль; в) 0,47 моль.
ЗАДАНИЕ 5. Напишите, что обозначают эти символы:
1.n или ν – ...
2.N – ...
3.NA – ...
4. M – ...
Образец: M r – относительная молекулярная масса.
49 |
50 |

Валентность
Атомы могут соединяться друг с другом. Атом элемента может присоединять только определённое число атомов других элементов. Например, NaCl, CaCl2 , AlCl3 , CCl4
или HCl, H 2 O, NH3 , CH 4 .
Валентность – это способность атомов данного элемента присоединять определённое число атомов других элементов.
Максимальное значение валентности – 8, а минимальное – 1.
Валентность обозначают римской цифрой над символом элемента. Например:
I II III IV V VI VII VIII
H F, Ca O, Al2 O3 , CCl4 , P2 O5 , S O3 , Mn2 O7 , Re O.
Некоторые элементы имеют постоянную валентность. Это значит, что элемент имеет только одно значение валентности. Например: Na, K, H, F –всегда одновалентны; O, Ca, Ba, Mg, Zn – всегда двухвалентны; Al – всегда трёхвалентен.
Многие элементы имеют переменную валентность. Это значит, что элемент имеет несколько значений валентности.
II
Например, железо имеет валентность два ( FeO ) и три
( Fe2O3 ). Сера имеет валентность два ( H 2S ), четыре ( SO2 ),
VI
шесть ( SO3 ).
52
Валентность
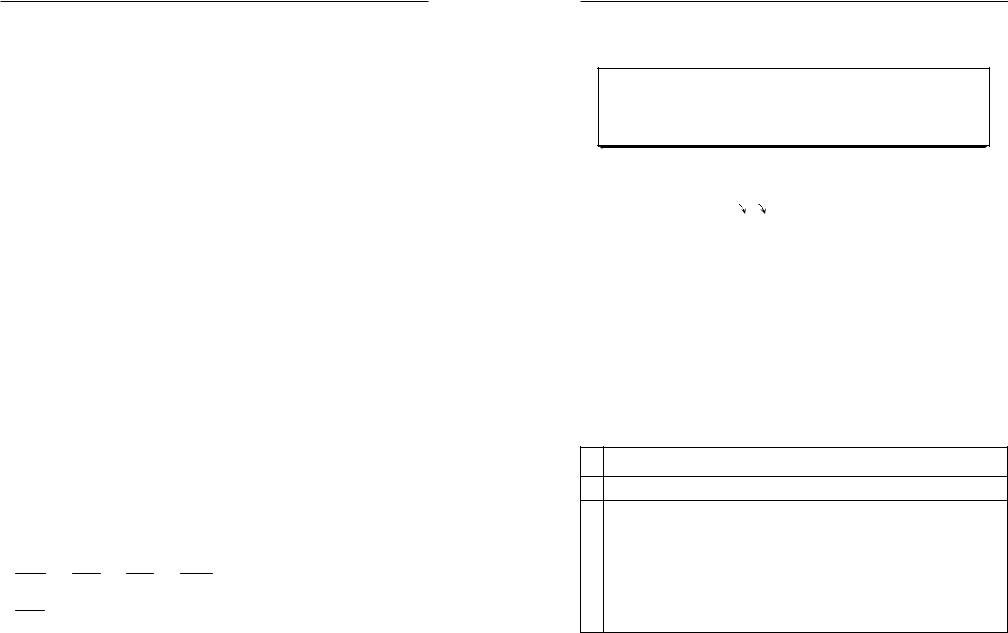
Значения валентностей некоторых элементов смотрите в таблице 3.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Таблица 3 |
|
|
|
|
ВАЛЕНТНОСТЬ НЕКОТОРЫХ ЭЛЕМЕНТОВ |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||
Валентность |
|
Химический |
Формула соединения |
|||||||||||
|
|
элемент |
|
|
(примеры) |
|||||||||
|
|
|
|
|
|
|
|
|
|
|||||
1 |
|
|
|
|
2 |
|
|
|
|
3 |
||||
|
|
|
|
|
|
Валентность постоянная |
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
||||
I |
|
|
|
H, Li, Na, K, F |
H2O , Na 2 O |
|||||||||
II |
|
|
|
O, Ca, Mg, Ba, Zn |
CaO , MgO |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||
III |
|
|
|
Al |
|
|
|
Al2 O3 |
|
|||||
|
|
|
|
|
|
Валентность переменная |
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||
I и II |
|
|
|
Cu |
|
|
|
Cu 2 O , CuO |
||||||
II и III |
|
|
|
Fe, Co, Ni |
FeO , Fe2O3 |
|||||||||
II и IV |
|
|
|
C, Sn, Pb |
CO , CO2 , SnO , SnO2 |
|||||||||
III и V |
|
|
|
P |
|
|
|
PH |
3 |
, P O |
5 |
|||
|
|
|
|
|
|
|
2 |
|||||||
II, III, VI |
|
|
|
Cr |
|
|
|
CrO , Cr2 O3 , CrO3 |
||||||
II, IV, VI |
|
|
|
S |
|
|
|
H 2S , SO2 , SO3 |
||||||
|
Группу атомов тоже можно характеризовать валентно- |
|||||||||||||
стью. Например: |
|
|
|
|
|
|
|
|
|
|||||
|
I |
I |
|
I |
|
I |
|
|
|
|
||||
− |
OH |
, − |
NO3 |
, − |
NO2 |
, − |
NH4 |
– одновалентные группы; |
||||||
|
II |
II |
|
II |
|
II |
|
|
|
|
||||
−CO3 , −SO4 , −SO3 , −SiO3 – двухвалентные группы;
III
− PO4 – трёхвалентная группа.
Валентность
Чтобы определить валентность элемента по формуле вещества или проверить формулу, нужно знать правило:
В бинарном соединении произведение валентности на число атомов одного элемента равно произведению валентности на число атомов другого элемента.
Например:
III II
Cr2 O3 3 2 = 2 3.
СОСТАВЛЕНИЕ ФОРМУЛ ВЕЩЕСТВ
Если мы знаем валентность элементов и групп атомов, то можем составить формулу вещества.
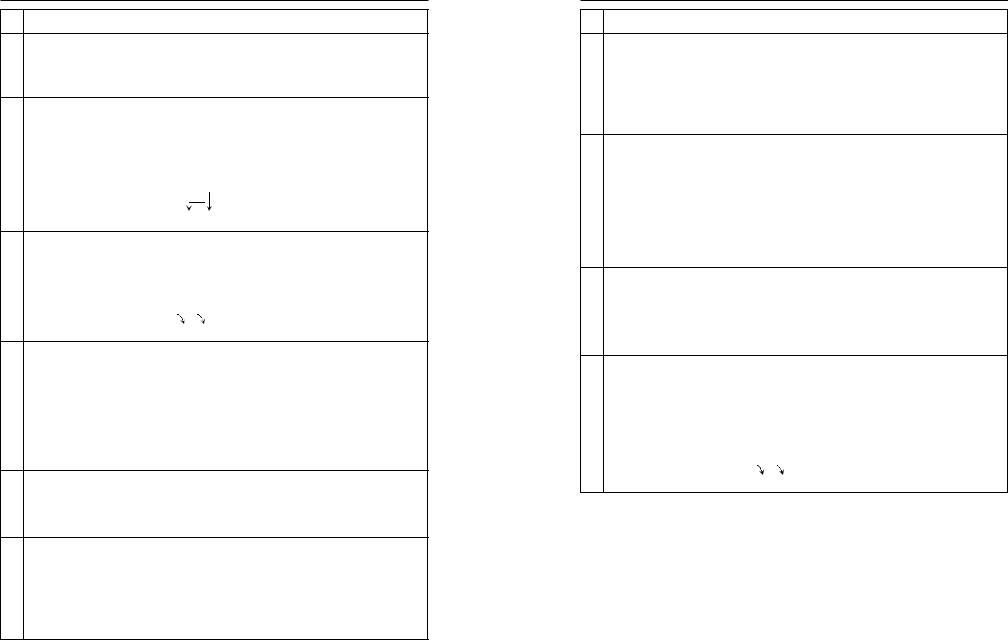
ПРИМЕР. Вещество состоит из атомов алюминия и кислорода. Как составить формулу вещества? Порядок действий смотрите в таблице 4.
Таблица 4
№Порядок действий
1 |
2 |
Первый метод
1.Написать символы элементов, из которых состоит вещество (действия 2–4 выполнять у символов, которые
написали в пункте 1).
AlO
53 |
54 |
Валентность
1 |
2 |
2.Написать надсимволами элементов их валентность.
IIIII
Al O
3.Написать индексы у символов элементов: значение валентности первого элемента будет индексом второго элемента, а значение валентности второго элемента будет индексом первого элемента.
III II
Al2 O3 Al2O3
4.Проверить формулу: в правильной формуле произведение валентности на число атомов одного элемента равно произведению валентности на число атомов другого элемента.
III II
Al2 O3 3 2 = 2 3
Второй метод
1.Написать символы элементов, из которых состоит вещество (действия 2–7 выполнять у символов, которые написали в пункте 1).
AlO
2.Написать над символами элементов их валентность.
IIIII
Al O
3.Определить наименьшее общее кратное значений валентностей элементов. Для этого перемножить значения валентностей элементов.
3 2 = 6
55
Валентность
1 |
2 |
4.Написать значение наименьшего общего кратного вверху между символами элементов.
IIIII
Al 6 O
5.Найти индексы элементов: разделить значение наименьшего общего кратного на валентность каждого элемента. Частное будет индексом элемента.
6:3=2 (индекс алюминия) 6:2=3 (индекс кислорода)
6.Написать индексы у символов элементов.
III6 II
Al2O3 → Al2O3
7.Проверить формулу: в правильной формуле произведение валентности на число атомов одного элемента равно произведению валентности на число атомов другого элемента.
III II
Al2 O3 3 2 = 2 3
ОПРЕДЕЛЕНИЕ ВАЛЕНТНОСТИ ЭЛЕМЕНТОВ ПО ФОРМУЛЕ ВЕЩЕСТВА
Если мы знаем валентность одного элемента, то по формуле вещества можем определить валентность другого элемента.
56

Валентность
ПРИМЕР. Формула вещества Al2S3 . Валентность алю-
миния три. Как определить валентность серы? Порядок действий смотрите в таблице 5.
|
|
Таблица 5 |
|
|
|
№ |
Порядок действий |
|
|
|
|
1 |
|
2 |
|
|
|
|
Первый метод |
|
1. |
Написать формулу вещества (действия 2, 4 и 5 вы- |
|
|
полнять у символов, которые написали в пункте 1). |
|
|
Al2S3 |
|
|
|
|
2. |
Написать над символом элемента известную валент- |
|
|
ность. Неизвестную валентность обозначить через х. |
|
|
III |
x |
|
Al 2 S 3 |
|
|
|
|
3. |
Найти сумму валентностей атомов элемента с извест- |
|
|
ной валентностью. Для этого умножить значение ва- |
|
|
лентности элемента на индекс этого элемента. |
|
|
III x |
3 2 = 6 |
|
Al 2 S 3 |
|
|
|
|
4. |
Написать результат сверху между символами элементов. |
|
|
|
6 x |
|
Al 2 S 3 |
|
|
|
|
5. |
Определить неизвестную валентность. Для этого надо |
|
|
разделить сумму валентностей на число атомов (на ин- |
|
|
декс) элемента, валентность которого нужно определить. |
|
|
6 : 3 = 2 |
|
|
|
|
Валентность
1 |
2 |
6. Частное (валентность) написать римской цифрой над символом элемента.
III II
Al 2 S 3
7.Проверить результат: если валентность определили правильно, то произведение валентности на число атомов одного элемента равно произведению валентности на число атомов другого элемента.
III II
Al 2 S 3 3 2 = 2 3
Второй метод
1.Обозначить неизвестную валентность через х, а известную – римской цифрой над символом элемента.
III x
Al 2 S 3
2.Написать в математической форме правило: произведение валентности на число атомов одного элемента равно произведению валентности начисло атомов другого элемента.
3 2 = x 3
3.Определить неизвестную валентность. Для этого надо решить уравнение.
x= 332 = 2
4.Написать валентность, которую определили, над символом элемента.
II
Al 2 S 3
57 |
58 |

Валентность
1 |
2 |
5.Проверить результат: если валентность определили правильно, то произведение валентности на число атомов одного элемента равно произведению валентности на число атомов другого элемента.
|
III II |
|
|
Al 2 S 3 3 2 = 2 |
3 |
|
ЛЕКСИКА ТЕМЫ |
|
Русский язык |
Английский язык Французский язык |
|
1 |
2 |
3 |
Бинарный |
binary |
binaire |
Валентность (ж.р.) |
valency |
valence |
Двухвалентный |
divalent |
bivalent |
Максимальный |
maximal |
maximum |
Минимальный |
minimal |
minimum |
Наименьшее |
the least general |
plus petit commun |
общее кратное |
|
multiple |
Одновалентный |
monovalent |
monovalent |
Переменный |
variable |
variable |
Присоединять |
to join |
additionner |
Римский |
roman |
romain |
Соединять |
to connect |
combiner |
Составить формулу |
to compile the |
établir la formule |
|
formula |
|
Составление |
composition |
rédaction |
Составлять |
to compose |
composer |
Трёхвалентный |
trivalent |
trivalent |
Валентность
ЗАПОМНИТЕ КОНСТРУКЦИЮ
|
можно |
Что (В.п.) |
характеризовать |
чем (Т.п.) |
|
|
характеризуют |
Группу атомов тоже можно характеризовать валентностью. = Группу атомов тоже характеризуют валентностью.
КОНТРОЛЬНЫЕ ВОПРОСЫ И ЗАДАНИЯ
ЗАДАНИЕ 1. Ответьте на вопросы.
1.Что такое валентность?
2.Какое минимальное значение валентности?
3.Какое максимальное значение валентности?
4.Какие элементы имеют постоянную валентность? Дайте примеры.
5.Какие элементы имеют переменную валентность? Дайте примеры.
6.Какое правило нужно знать, чтобы проверить формулу бинарного соединения?
ЗАДАНИЕ 2. Определите валентность элементов в следующих соединениях:
|
x |
x |
x |
x |
x |
x |
а) |
H Cl, |
H Br, |
H 2 S, |
N H 3 , |
Si H 4 , |
C H 4 ; |
|
x |
x |
x |
x |
x |
x |
б) |
Sn O, |
Sn O2 , |
Cr O, |
Cr2 O3 , |
Cr O3 , |
Cl2 O7 . |
59 |
60 |
